Antikoagulation in der Schwangerschaft und Stillzeit
Autorin:
Dr. med. Leila Sultan-Beyer
Chefärztin Gynäkologie und Geburtshilfe
Kantonsspital Winterthur
E-Mail: leila.sultan-beyer@ksw.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Antikoagulation während der Schwangerschaft ist ein komplexes Thema, das sowohl die Gesundheit der Mutter als auch die des ungeborenen Kindes betrifft. In diesem Artikel werden die häufigsten Indikationen für eine antikoagulative Therapie in der Schwangerschaft, die Auswahl geeigneter Antikoagulanzien sowie deren Risiken und Nebenwirkungen erörtert.
Hintergrund
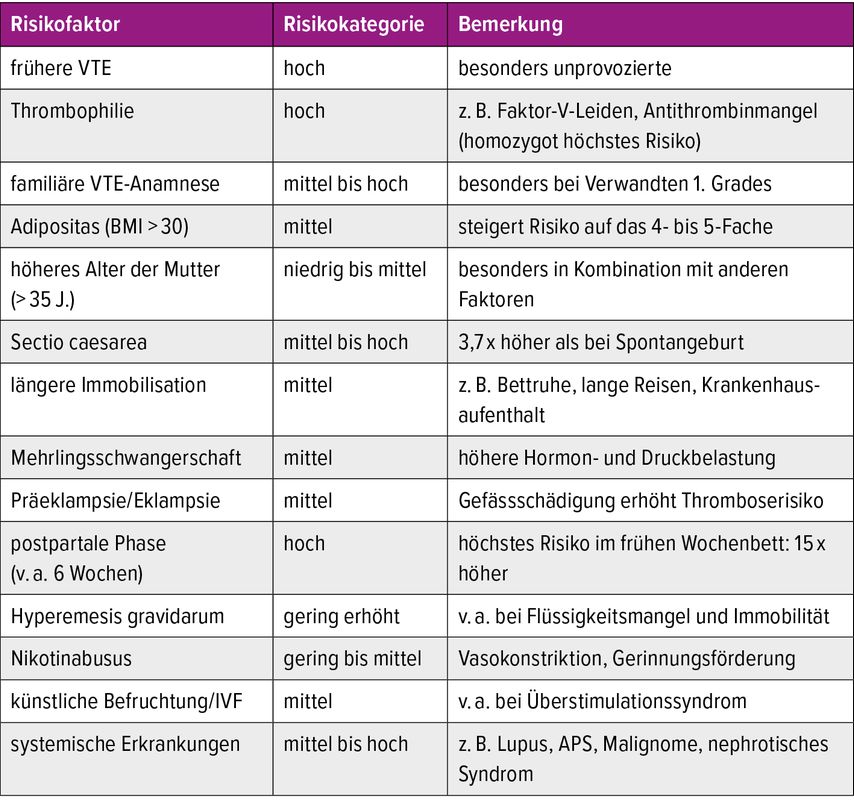
Die Schwangerschaft stellt eine besondere Herausforderung für das hämostatische Gleichgewicht dar. Zum einen ist das Risiko für venöse Thromboembolien (VTE) während der Schwangerschaft im Vergleich zu Nichtschwangeren etwa fünffach erhöht, zum anderen besteht insbesondere während der Geburt ein erhöhtes Blutungsrisiko. Das Risiko für eine postpartale VTE ist sogar 15-fach erhöht.1,2 Ein erhöhtes thromboembolisches Risiko besteht somit bereits im 1. Trimenon, es steigt im Verlauf der Schwangerschaft weiter an und erreicht seinen Gipfel in der frühen postpartalen Phase. Venöse Thromboembolien zählen – neben der schweren postpartalen Hämorrhagie (PPH) – zu den führenden Ursachen maternaler Mortalität. Die Inzidenz wird auf etwa 2/1000 Schwangerschaften geschätzt.3 Dieses Risiko ist nicht uniform, sondern wird massgeblich durch individuelle Faktoren wie Alter, Adipositas, rheumatoide Vorerkrankungen sowie thromboembolische Vorereignisse beeinflusst (Tab. 1). Ob sich diese Risikofaktoren kumulieren oder gar potenzierend auswirken, ist unklar. Ein weiteres Dilemma in der klinischen Entscheidungsfindung besteht darin, dass Schwangere sehr häufig aus randomisiert-kontrollierten Studien ausgeschlossen werden, was zu einer begrenzten Evidenzlage hinsichtlich der optimalen Auswahl und Dosierung von Antikoagulanzien in der Schwangerschaft und im Wochenbett führt.
Tab. 1: Risikofaktoren für schwangerschaftsassoziierte venöse Thromboembolien (modifiziert nach Hart et al. 2020)14
Indikationen für Antikoagulation in der Schwangerschaft
Die Indikation für eine Antikoagulation während der Schwangerschaft ergibt sich aus der Notwendigkeit, thromboembolische Ereignisse bei der werdenden Mutter zu verhindern, um so die Morbidität und Mortalität für Mutter und Kind deutlich zu senken. Eine VTE-Prophylaxe ist immer dann indiziert, wenn der zu erwartende protektive Effekt das Risiko unerwünschter Nebenwirkungen, insbesondere das Risiko der Blutung, übersteigt. Beispiele hierfür sind Thrombosen in der Vorgeschichte der Patientinnen, genetische Prädispositionen sowie Autoimmunerkrankungen, die ihr Risiko erhöhen. VTE in der Vergangenheit stellen einen der wichtigsten Risikofaktoren dar, da ein signifikant erhöhtes Rezidivrisiko besteht. Hierbei ist von entscheidender Bedeutung, ob es sich um ein provoziertes oder unprovoziertes thromboembolisches Ereignis gehandelt hat; d.h., ob die VTE im Zusammenhang mit hormonellen Einflüssen (Schwangerschaft, Einnahme hormoneller, östrogenhaltiger Kontrazeptiva etc.) stand oder ob vorübergehende Faktoren wie z.B. ein operativer Eingriff oder eine verlängerte Immobilisation eine Rolle spielten.4,5
Thrombophilien-relevanter Risikofaktor
Bei den Thrombophilien unterscheidet man zwischen den hereditären und erworbenen Formen. Die hereditäre Thrombophilie beruht auf genetischen Veränderungen, die zu einer gesteigerten Gerinnungsneigung führen. Zu den häufigsten Formen zählen die Faktor-V-Leiden-Mutation, die eine Aktivierungsresistenz gegenüber aktiviertem Protein C verursacht, sowie die Prothrombin-G20210A-Mutation, die mit einem erhöhten Prothrombinspiegel einhergeht. Seltener, aber klinisch bedeutsam sind Antithrombin-, Protein-C- und Protein-S-Mangel, welche meist autosomal-dominant vererbt werden und mit einem höheren VTE-Risiko assoziiert sind. Das höchste Risiko für VTE besteht bei homozygoter Faktor-V-Leiden-Mutation oder homozygoter Prothrombin-Mutation.1,6 Die erworbene Thrombophilie entsteht im Laufe des Lebens und ist häufig mit Grunderkrankungen oder exogenen Faktoren assoziiert. Die wichtigste Form bei Frauen im gebärfähigen Alter ist das Antiphospholipid-Syndrom (APS), charakterisiert durch das Vorhandensein antiphospholipider Antikörper (z.B. Lupus-Antikoagulans, Anticardiolipin- oder 2-Glykoprotein-I-Antikörper) und klinische Manifestationen wie Thrombosen oder habituelle Aborte.
Mechanische Herzklappen
Frauen mit vorbestehenden Herzerkrankungen, insbesondere mit kongenitalen Herzvitien oder mechanischen Herzklappen, stellen eine Hochrisikogruppe in der Schwangerschaft dar. Sie benötigen zwingend eine konsequente Antikoagulation. Dabei ist die Nutzen-Risiko-Abwägung besonders komplex, da Vitamin-K-Antagonisten (z.B. Warfarin, Phenprocoumon) mit einem erhöhten Risiko für fetale Fehlbildungen assoziiert sind, andererseits jedoch am effektivsten vor thromboembolischen Komplikationen schützen. In der klinischen Praxis wird bei Schwangeren mit mechanischen Herzklappen häufig ein stufenweises Vorgehen gewählt: Zu Beginn der Schwangerschaft (innerhalb der ersten 6–12 Wochen) erfolgt in der Regel eine Antikoagulation mit niedermolekularem oder unfraktioniertem Heparin. Nach Abschluss des ersten Trimenons kann – abhängig vom individuellen Risiko – vorübergehend auf Vitamin-K-Antagonisten umgestellt werden. In der späten Schwangerschaft sowie peripartal erfolgt dann die Rückumstellung auf Heparin.7–9
Empfohlene Antikoagulanzien während der Schwangerschaft
Die Wahl des Antikoagulans ist ein Kompromiss zwischen der effektivsten Prävention thromboembolischer Ereignisse bei der Mutter und der Minimierung potenzieller Risiken für den Fetus. Mehrere Faktoren beeinflussen diesen Entscheidungsprozess, Kliniker müssen ihre Wahl individuell auf die Charakteristika und Anamnese jeder Schwangeren abstimmen. Verschiedene Leitlinien, wie z.B. die Leitlinien des American College of Obstetricians and Gynecologists (ACOG), des Royal College ofObstetricians and Gynaecologists (RCOG) und der Society for Maternal-Fetal Medicine, bieten hierzu Orientierung. Es muss jedoch erwähnt werden, dass ein Grossteil der Leitlinien auf Beobachtungsstudien und retrospektiven Daten basiert, somit teilweise uneinheitlich ist und häufig die Empfehlungen nicht auf randomisiert-kontrollierte Studien zurückzuführen sind.
Niedermolekulares Heparin (NMH) ist erste Wahl
Vorteile:
-
NMH (z.B. Enoxaparin oder Dalteparin) ist aufgrund seiner Wirksamkeit, der vorhersagbaren Pharmakokinetik und seines Sicherheitsprofils typischerweise erste Wahl für die Prophylaxe wie auch für die Behandlung von VTE in der Schwangerschaft.
-
Diese Substanzen passieren die Plazenta nicht in signifikanten Mengen, wodurch das Risiko negativer Auswirkungen auf die fetale Entwicklung reduziert wird.
-
NMH ist in Form von Fertigspritzen erhältlich, somit wird eine bequeme, subkutane Verabreichung ohne häufige Laborüberwachung ermöglicht.
Besonderheiten:
-
Die therapeutische Dosierung ist gewichtsadaptiert und erfordert möglicherweise Anpassungen im Verlauf der Schwangerschaft, insbesondere bei Adipositas.10
Unfraktioniertes Heparin (UFH)
Vorteile:
-
UFH ist eine geeignete Alternative, wenn NMH kontraindiziert ist oder wenn eine schnellere Reversibilität erforderlich ist.
-
UFH (Liquemin®) hat eine kürzere Halbwertszeit als NMH, was bei dringenden Interventionen oder vor der Entbindung vorteilhaft sein kann.
Besonderheiten:
-
UFH erfordert eine engmaschige Gerinnungskontrolle, da schwangerschaftsbedingte Veränderungen wie erhöhte renale Clearance und verändertes Verteilungsvolumen eine stabile therapeutische Einstellung erschweren.
Alternativen
-
Fondaparinux (Arixtra®) wird deutlich seltener eingesetzt. Es ist kein Heparin, sondern ein synthetisch hergestellter Faktor-Xa-Hemmer, der jedoch eine sehr ähnliche Wirkung hat.
-
Indiziert ist es bei Heparinallergie, St.n. HIT (Heparin-induzierte Thrombozytopenie) oder Niereninsuffizienz.
-
Danaparoid (Orgaran®) wird ebenfalls bei Heparinallergie oder bei St.n. HIT angewendet.
Relative Kontraindikationen
Warfarin, Vitamin-K-Antagonisten (VKA)
Warfarin passiert die Plazenta und ist besonders im ersten Trimester mit einem erhöhten Risiko embryopathischer Veränderungen assoziiert. Typische Merkmale der sogenannten Cumarin-Embryopathie sind die nasale Hypoplasie, verkürzte Röhrenknochen, Verkalkungsstörungen der Wirbelkörper und Handknochen, Mikrozephalie, Augenfehlbildung, Hydrocephalus und in schweren Fällen auch eine mentale Retardierung. Somit ist es im 1. Trimenon generall kontraindiziert. Ausnahmen sind Patientinnen, bei denen der Nutzen die Risiken überwiegt (z.B. Patientinnen mit mechanischen Herzklappen).
Direkte orale Antikoagulanzien (DOAK)
Direkte orale Antikoagulanzien wie z.B. Dabigatran, Rivaroxaban oder Apixaban sind plazentagängig und aufgrund mangelnder Datenlage und möglicher Risiken für den Fetus und das Neugeborene kontraindiziert.
Peripartale Antikoagulation
Antikoagulation erhöht das Risiko epiduraler oder spinaler Hämatome bei neuroaxialer Anästhesie. Daher sollten Patientinnen mit prophylaktischem NMH mindestens 12 Stunden vor geplanten Eingriffen die Therapie pausieren. Bei therapeutischer NMH-Dosis wird eine Unterbrechung für mindestens 24 Stunden vor Eingriffen empfohlen. Die Wiederaufnahme der Therapie erfolgt je nach Dosis und nach Entfernung neuroaxialer Katheter nach bestimmten Zeitintervallen. Alternativ kann peripartal eine Umstellung auf UFH erfolgen, da dessen kurze Halbwertszeit eine bessere Steuerbarkeit bei Einleitung, PDA oder Notfallmassnahmen bietet. Die letzte UFH-Gabe sollte 4–6 Stunden vor Neuroaxialanästhesie liegen.
Überwachung der Therapie
Die physiologischen Veränderungen in der Schwangerschaft – Zunahme des Plasmavolumens, gesteigerte renale Clearance, Veränderungen der Proteinbindung – können die Wirkung und Elimination von Antikoagulanzien beeinflussen. Eine regelmässige Anti-Faktor-Xa-Messung unter prophylaktischer NMH-Therapie ist jedoch umstritten und wahrscheinlich nur in Ausnahmefällen nötig. Zudem gibt es keine klar definierten «Optimalwerte» des Anti-Faktor Xa für ein Monitoring der prophylaktischen Gabe in der Schwangerschaft.5,11 Bei übermässiger Gewichtszunahme der Schwangeren sollte an eine Dosisanpassung insbesondere der therapeutischen Dosierung gedacht werden, auch wenn hier die Daten noch kontrovers sind.4,10 Die Anti-Faktor-Xa-Spiegel werden in der Regel 3–4 Stunden nach subkutaner Injektion gemessen. Die Überwachung der Therapie unter UFH erfolgt in der Regel mittels aPTT (aktivierte partielle Thromboplastinzeit).
Post partum
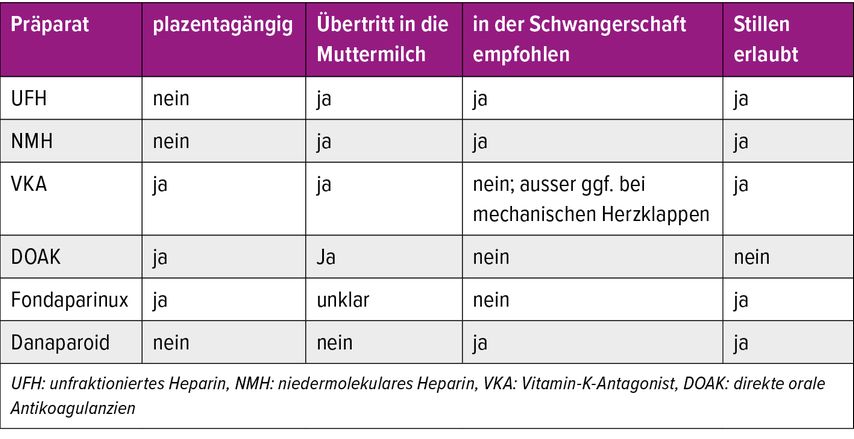
Ist die Indikation für eine VTE-Prophylaxe in der Schwangerschaft gegeben, ist nach der Geburt eine Fortsetzung der Antikoagulation für mindestens sechs Wochen indiziert, da das VTE-Risiko postpartal am höchsten ist. In der Stillzeit sind NMH und UFH unbedenklich, DOAK und VKA nur nach sorgfältiger Risikoabwägung (Tab. 2).
Tab. 2: Wahl des Antikoagulans für die Schwangerschaft und Stillzeit (modifiziert nach Scheres et al.)15
Risiken und Nebenwirkungen
Blutungen sind die häufigste Komplikation der Antikoagulation, können aber durch kontrollierte Dosierungen minimiert werden. Bei NMH sind schwere Blutungen selten (<1%), leichte Suffusionen häufiger.11 UFH birgt im Vergleich zu NMH ein erhöhtes Risiko von 2–5% für Heparin-induzierte Thrombozytopenie (HIT Typ II) sowie Osteoporose bei Langzeitgabe in der Schwangerschaft.12,13 Fetale Risiken bestehen in erster Linie indirekt. Heparin selbst ist nicht plazentagängig und kann somit nicht zum Fetus gelangen. Indirekt können jedoch eine verstärkte maternale Blutung, ein retrochoriales Hämatom oder eine Heparin-induzierte Thrombozytopenie (HIT) zu einer intrauterinen Wachstumsrestriktion (IUGR) oder im Extremfall zur akuten Plazentalösung führen.
Patientenaufklärung
Eine umfassende Aufklärung ist entscheidend, um schwangeren Patientinnen eine informierte Therapieentscheidung zu ermöglichen. Sie sollten sowohl über die Notwendigkeit der Antikoagulation als auch über Risiken und Nutzen der Behandlungsoptionen aufgeklärt und aktiv in den Entscheidungsprozess einbezogen werden.
Fazit
Die Entscheidung für die Antikoagulation in der Schwangerschaft erfolgt stets individuell, basierend auf einer umfassenden Risikoabschätzung. Dabei spielen die persönliche und familiäre Anamnese sowie zusätzliche Risikofaktoren eine zentrale Rolle. Die enge interdisziplinäre Zusammenarbeit zwischen Geburtshelfern, Hämatologen und weiteren Disziplinen ist entscheidend, um sowohl die mütterliche als auch die fetale Sicherheit optimal zu gewährleisten.
Literatur:
1 Jackson E et al.: Risk of venous thromboembolism during the postpartum period: a systematic review. Obstet Gynecol 2011; 117(3): 691-703 2 Pomp ER et al.: Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. J Thromb Haemost 2008; 6(4): 632-7 3 Naess IA et al.: Incidence and mortality of venous thrombosis: a population-based study. J Thromb Haemost JTH 2007; 5(4): 692-9 4 Scheres LJJ et al.: Everything the clinician needs to know about evidence-based anticoagulation in pregnancy. Blood Rev 2019; 33: 82-97 5 Studt JD, Trinchero A: Gerinnungshemmung in Schwangerschaft und Wochenbett. Gynäkol 1 2022; 55(8): 567-74 6 Asmis L, Hellstern P: Thrombophilia testing - a systematic review. Clin Lab 2023; 69(4): doi 10.7754/Clin.Lab.2022.220817 7 Hüttel E et al.: Pregnancy outcome of first trimester exposure to the vitamin K antagonist phenprocoumon depends on duration of treatment. Thromb Haemost 2017; 117(5): 870-9 8 Gohlke-Bärwolf C: Anticoagulation in pregnancy and post partum in heat valve diseases, thrombosis or atrial fibrillation: fetal risk versus maternal thromboembolism. Z Kardiol 2001; 90 Suppl 4: 49-56 9 Majdevac S et al.: Management of mechanical aortic valve thrombosis during the first trimester of pregnancy. J Card Surg Juni 2022; 37(6): 1776-8 10 Bistervels IM et al.: Intermediate-dose versus low-dose low-molecular-weight heparin in pregnant and post-partum women with a history of venous thromboembolism (Highlow study): an open-label, multicentre, randomised, controlled trial. The Lancet 2022; 400(10365): 1777-87 11 Romualdi E et al.: Anticoagulant therapy for venous thromboembolism during pregnancy: a systematic review and a meta-analysis of the literature. J Thromb Haemost 2013; 11(2): 270-81 12 Dahlman TC et al.: Bone mineral density during long-term prophylaxis with heparin in pregnancy. Am J Obstet Gynecol 1994; 170(5 Pt 1): 1315-20 13 Lefkou E et al.: Review: Low-molecular-weight heparin-induced osteoporosis and osteoporotic fractures: a myth or an existing entity? Lupus 2010; 19(1): 3-12 14 Hart C et al.: Prevention of venous thromboembolism during pregnancy and the puerperium with a special focus on women with hereditary thrombophilia or prior VTE—position paper of the Working Group in Women’s Health of the Society of Thrombosis and Haemostasis (GTH). Hämostaseologie 2020; 40: 572-90 15 Scheres LJJ et al.: Everything the clinician needs to know about evidence-based anticoagulation in pregnancy. Blood Rev 2019; 33: 82-97
Das könnte Sie auch interessieren:
Strahlenempfindlichkeit verschiedener Gewebe
Diagnostische Bildgebung und Strahlentherapie sind aus der modernen Medizin nicht mehr wegzudenken. Zweifellos bringen sie unseren Patienten grossen Nutzen, man darf jedoch nicht ...
Der Einfluss des vaginalen Mikrobioms auf die HPV-Infektion
Die Infektion mit dem humanen Papillomavirus (HPV) stellt weiterhin ein grosses medizinisches Problem dar, da sie die Entstehung von Tumoren begünstigen kann – insbesondere im Bereich ...
Wie unterscheiden und therapieren?
Zyklusabhängige Beschwerden werden von ca. 90% der Frauen im reproduktiven Alter wahrgenommen und sind auf physiologische Hormonschwankungen zurückzuführen. In ca. 20–30% der Fälle liegt ...