
Hypoxie als Auslöser für Migräne und Aura
Spezialambulanz für Kopf- und<br>Gesichtsschmerzen<br>Universitätsklinik für Neurologie<br>Innsbruck<br>E-Mail: f.frank@i-med.ac.at
Migräneforschung hat dank der Entwicklung neuer Therapeutika in den letzten Jahren bemerkenswerte Fortschritte erzielt. Einen großen Beitrag hierzu haben Erkenntnisse aus der Grundlagenforschung an Tier und Mensch geliefert. Hypoxie könnte als experimentelles Modell ohne pharmakologische Stimuli anwendbar sein.
Migräne ist eine in großem Ausmaß belastende neurologische Erkrankung, die etwa 13% der Weltbevölkerung betrifft.1Die Erkrankung war bereits in der Antike nicht unbekannt war, wie das Zitat von Hippokrates rechts zeigt. Neben der substanziellen individuellen Einschränkung von MigränepatientInnen ergibt sich auch eine enorme sozioökonomische Belastung, da zumeist Menschen während ihrer „produktivsten Lebensjahre“ betroffen sind. Um eine adäquate Versorgung dieser PatientInnen zu gewährleisten, konnten besonders in den letzten Jahrzenten beträchtliche Fortschritte in der Erforschung der Migräneerkrankung und ihrer Therapie erzielt werden.
Ein wichtiges Werkzeug zur Erkenntnisgewinnung sind experimentelle Modelle wie etwa Tiermodelle. Da sich das Krankheitsbild der Migräne jedoch phänomenologisch als äußerst komplex präsentieren kann, ist die Entwicklung von humanen Modellen, die eine möglichst natürliche Migräneattacke provozieren und so zur Untersuchung dieser dienen können, von großer Bedeutung.
Hypoxie in der Migränepathophysiologie
Ein solches humanes Modell könnte durch die Anwendung von normobarer Hypoxie zur Verfügung gestellt werden. Aktuelle pathophysiologische Daten zeigen, dass zu Beginn der Migräneattacke eine neuronale Dysfunktion im Hypothalamus und im Hirnstamm zu vermuten ist, die eine fehlerhafte Verarbeitung von Afferenzen aus dem trigeminovaskulären Komplex verursacht. Dieser Komplex beinhaltet neben dem Ganglion trigeminale sowie dem Nucleus caudalis trigemini die A-delta- und C-Nozizeptoren mit ihren peripheren Endigungen an den meningealen Gefäßen. Nach nozizeptiver Innervation entleeren sich vasoaktive Neuropeptide wie „Calcitonin Gene-Related Peptide“ (CGRP), Substanz P, Neurokinin A und Hypophysenadenylatcyclase-aktivierendes Polypeptid (PACAP), welche eine weitere Sensitivierung des trigeminalen Systems vorantreiben können. Neben mechanischer und thermischer Reizung dieser Nozizeptoren kann eine Aktivierung auch durch reaktive Sauerstoff- und Stickstoffspezies (ROS, RNS) vermittelt werden. Diese Moleküle werden unter anaeroben Konditionen vermehrt in den Kreislauf freigesetzt, wie etwa unter Hypoxie. Der Zusammenhang zwischen Hypoxie und Migräne ist auch klinisch fassbar. Dies zeigt sich zum einen in der erhöhten Prävalenz von Migräne in Hochregionen wie den Anden oder dem Himalaya, zum anderen darin, dass Migräne einen unabhängigen Risikofaktor für die Entwicklung von Höhenkopfschmerz darstellt.2 Interessanterweise wird diskutiert, dass Migränetrigger, wie sie häufig von PatientInnen berichtet werden, in der Lage sind oxidativen Stress zu generieren. Hierfür werden erhöhte mitochondriale Energieproduktion, Toxizität und Membrandysfunktionen sowie Kalziumüberladung, Exzitotoxizität, Neuroinflammation und Mikrogliaaktivierung verantwortlich gemacht.3
Migränetrigger-Studien
In experimentellen Settings konnte die Wirksamkeit von Hypoxie als Migränetrigger mehrfach gezeigt werden. So entwickelte eine Subgruppe (15%) von migräne-nativen TeilnehmerInnen nach 12 Stunden Exposition gegenüber normobarer Hypoxie Kopfschmerzen mit eindeutigen Migränefeatures.4 In anderen Studien konnte gezeigt werden, dass Migräne bei 40 bis 60% der StudienteilnehmerInnen durch Hypoxie ausgelöst werden kann.5,6 Dies erscheint auf den ersten Blick einer mäßigen Erfolgsrate zu entsprechen, ist aber mit den pharmakologischen Triggermethoden Nitroglycerin (NTG), Sildenafil oder Infusion von CGRP und PACAP durchaus gleichzusetzen. Ein Vorteil von Hypoxie gegenüber dem Goldstandard Nitroglycerin ist die unimodale Kopfschmerzantwort mit der Auslösung von „typischen“ Migräneattacken.
In Versuchen mit Nitroglycerin wird meist ohne Latenz ein unspezifischer Kopfschmerz ausgelöst, der zum Teil erst nach einigen Stunden von Migränekopfschmerzen gefolgt wird. Ein Unterbrechen des Versuches ist nach Gabe von NTG nicht mehr möglich. In einer Innsbrucker Studie mit 30 freiwilligen MigränepatientInnen konnte unter 6 Stunden Exposition gegenüber normobarer Hypoxie bei 63,3% Migräne ausgelöst werden.7 Bei 16,6% der PatientInnen wurde auch eine Migräneaura getriggert; interessanterweise entwickelten 2 der TeilnehmerInnen mit Migräneaura diese im Rahmen des Versuches zum ersten Mal. Beide berichteten von visuellen Symptomen im Sinne von Flimmerskotomen, welche die Kriterien für Aura laut der gängigen Klassifikation der International Headache Society (ICHD-III) erfüllten. Ein genaues Nachverfolgen dieser ProbandInnen hat ergeben, dass es nach dem Versuch zu keiner weiteren Migräneaura gekommen ist. Dieses Ergebnis ist besonders interessant, da Migräneaura als exklusives Charakteristikum für diese Erkrankung gilt. Als der Aura zugrunde liegend wird allgemein anerkannt eine sich über den Kortex ausbreitende Depolarisationswelle („Cortical Spreading Depression“, CSD) gesehen. Ein Zusammenhang zwischen Migräneaura und Migränekopfschmerz wird derzeit vermutet, konnte jedoch bisher nicht nachgewiesen werden, sodass beide Formen (Migräne mit und Migräne ohne Aura) als zwei eigenständige Subtypen gesehen werden. Hypoxie könnte auch in diesem Fall ein Bindeglied darstellen, da gezeigt wurde, dass diese Depolarisationen mit hypoxischen Zuständen im Gewebe korrelieren und diese auslösen können.8 Ob eine „Cortical Spreading Depression“ nun auch bei MigränepatientInnen ohne Aura auftritt und aufgrund verschiedener Schwellenwerte im Gehirn subklinisch verläuft, bleibt fraglich und die Beantwortung dieser Frage wird auch in Zukunft ein herausforderndes Thema in der Migräneforschung darstellen. Mit der Exposition gegenüber normobarer Hypoxie steht nun jedoch ein sicheres experimentelles Modell zur Verfügung, das ohne die Anwendung von chemischen Substanzen in der Lage ist, Migräneattacken und Aura auszulösen. In Zukunft könnte so neben der Erforschung der Pathomechanismen der Migräne auch die Medikamentenentwicklung unterstützt werden.
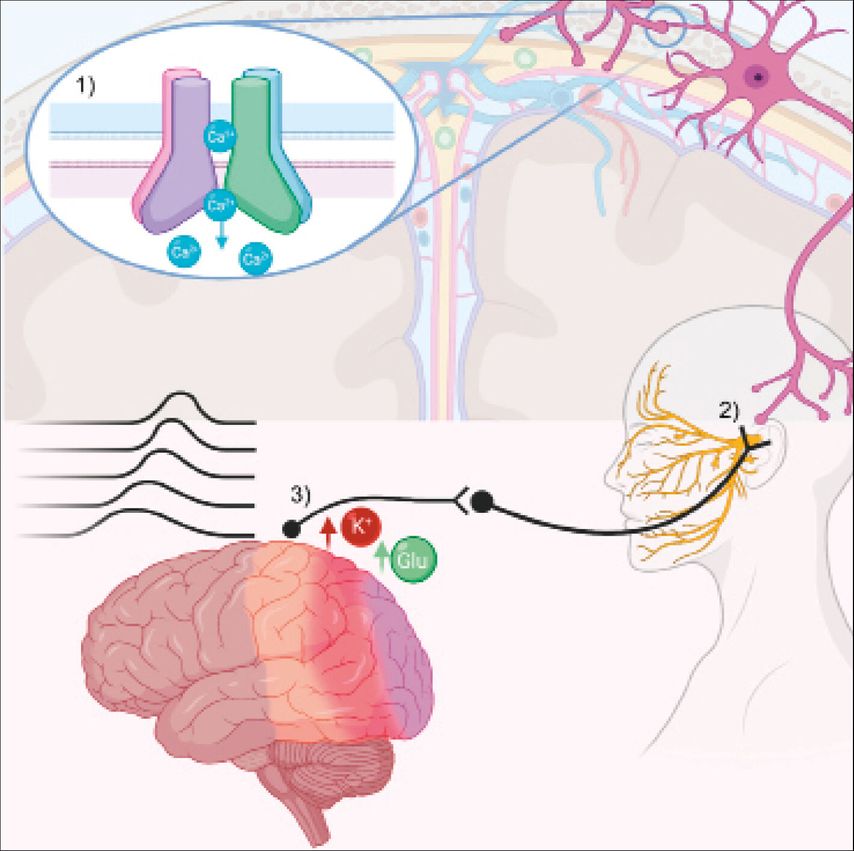
Abb 1: Nach hypoxischem Stimulus kann der Einbau von TRP-Kanälen in die Plasmamembran von duralen Nozizeptoren gefördert werden (1), zusätzlich erlaubt Hypoxie einen gesteigerten Kalzium-Influx in das Neuron. Es kommt zur Depolarisation und Signalweiterleitung in das Ganglion trigeminale (2). Hier könnten eine vermehrte Sensitivierung und Signaltransmission in weitere schmerzmodulierende und schmerzrezeptive Hirnstrukturen stattfinden (Thalamus, Kortex, Hirnstamm, Hypothalamus etc.). An kortikalen Neuronen dürften einerseits die afferenten Signale als auch eine hypoxisch-bedingte extrazellulär erhöhte Kalium- und Glutamatkonzentration (3) zu einer Annäherung an das Schwellenpotenzial führen. Nach ausreichender Stimulation könnte so die Cortical Spreading Depression initiiert werden.
Literatur:
1 Vos T et al.: Lancet 2017; 390(10100): 1211-592 Burtscher M et al.: Cephalalgia 2011; 31(6): 706-11 3 Borkum JM: Headache 2016; 56: 12-35 4 Broessner G et al.: Cephalalgia 2016; 36: 765-71 5 Schoonman GG et al.: Cephalalgia 2006; 26(7): 816-9 6 Arngrim N et al.: Brain 2016; 139(3): 723-37 7 Frank F et al.: Cephalalgia 2020; online first. DOI:10.1177/0333102420949202 8 Takano T et al.: Nat Neurosci 2007 Jun; 10(6): 754-62
Das könnte Sie auch interessieren:
Blutbiomarker-Diagnostik in der klinischen Praxis: Anwendungsempfehlungen
Blutbasierte Biomarker (BBM) eröffnen neue Möglichkeiten für die frühzeitige Diagnostik der Alzheimererkrankung. Sie könnten die Identifikation von Patient:innen mit kognitiven ...
Optische Kohärenztomografie bei Multipler Sklerose – wie viel ist genetisch?
Mit der optischen Kohärenztomographie kann durch die Messung retinaler Schichtatrophie die neuroaxonale Schädigung bei Multipler Sklerose erfasst werden. Eine neue Studie gibt Einblick ...
APOE und Anti-Amyloid-Therapien: Genetik im klinischen Alltag
Mit der Zulassung der ersten krankheitsmodifizierenden Therapien hat ein Paradigmenwechsel in der Behandlung der Alzheimerkrankheit begonnen. Anti-Amyloid-Antikörper können den ...


