APOE und Anti-Amyloid-Therapien: Genetik im klinischen Alltag
Autorin:
Theresa König, PhD
Universitätsklinik für Neurologie
Medizinische Universität Wien
E-Mail: theresa.koenig@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit der Zulassung der ersten krankheitsmodifizierenden Therapien hat ein Paradigmenwechsel in der Behandlung der Alzheimerkrankheit begonnen. Anti-Amyloid-Antikörper können den kognitiven Abbau nachweislich verlangsamen, auch wenn sie die Erkrankung nicht aufhalten. Parallel dazu rückt auch die Genetik erneut in den klinischen Fokus, insbesondere das Gen Apolipoprotein E (APOE). Der APOE-Genotyp beeinflusst nicht nur das Erkrankungsrisiko, sondern auch wer behandelt werden kann – und wer vorerst nicht.
Keypoints
-
APOE4 ist der stärkste genetische Risikofaktor für die sporadische Alzheimererkrankung und beeinflusst Erkrankungsrisiko sowie -beginn dosisabhängig.
-
APOE-Genotypisierung ist essenziell vor Beginn einer Therapie mit Anti-Amyloid-Antikörpern; APOE4-Homozygote sind derzeit von Lecanemab ausgeschlossen.
-
APOE ist kein diagnostisches Gen: Der Genotyp allein erlaubt keine Vorhersage, ob und wann eine Demenz eintritt, sollte nicht zur allgemeinen Risikovorhersage eingesetzt werden und muss immer im klinischen Kontext interpretiert werden.
-
Lebensstilinterventionen bleiben zentral, besonders für APOE4-Träger:innen: Mediterrane Ernährung, Bewegung, vaskuläre Risikokontrolle und kognitive Aktivität können das Risiko messbar beeinflussen.
Genetik der Alzheimerkrankheit
Das Risiko, an Alzheimer zu erkranken, ist zu einem erheblichen Teil genetisch beeinflusst – Schätzungen gehen von einer Heritabilität zwischen 60 und 80 Prozent aus. Darunter versteht man den Anteil des Erkrankungsrisikos, der durch genetische Faktoren erklärt werden kann, während der Rest auf Umwelt- und Lebensstilfaktoren entfällt.
Bei Patient:innen mit frühem Krankheitsbeginn (<65 Jahren; „early-onset AD“) finden sich in einem kleinen Teil der Fälle autosomal-dominante Mutationen in den Genen APP, PSEN1 und PSEN2, welche nahezu immer zur Erkrankung führen. Diese hochpenetranten Mutationen sind jedoch selten und machen weniger als ein Prozent aller Alzheimerfälle aus.1 In der weitaus häufigeren spät beginnenden Form („late-onset AD“) spielen hingegen polygene Risikofaktoren eine zentrale Rolle. Moderne Genomanalysen („genome-wide association studies“, GWAS) haben zahlreiche Risikogene identifiziert (darunter TREM2, CLU, ABCA7, BIN1 oder SORL1), die jeweils moderate bis kleine Effektstärken aufweisen und gemeinsame biologische Pfade wie Immunantwort, Lipidmetabolismus und endosomale Verarbeitung betreffen.2
Trotz dieser Vielzahl genetischer Einflüsse bleibt das bereits 1993 beschriebene APOE-Gen der mit Abstand stärkste und klinisch relevanteste genetische Risikofaktor der sporadischen Alzheimererkrankung.
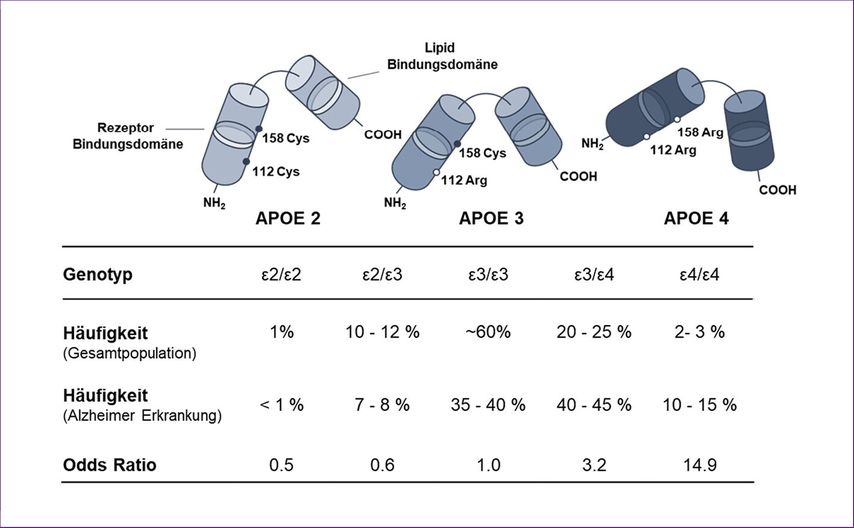
Abb. 1: APOE-Isoformen und Alzheimerrisiko. Die drei APOE-Isoformen (ε2, ε3, ε4) unterscheiden sich an den Aminosäurepositionen 112 und 158. APOE4 erhöht das Alzheimerrisiko dosisabhängig, während APOE2 protektiv wirkt
APOE: Struktur, Isoformen und Risiko
Das APOE-Gen liegt auf Chromosom 19q13.2 und codiert das Protein Apolipoprotein E (APOE), ein Schlüsselprotein im Lipid- und Cholesterintransport im zentralen Nervensystem (ZNS). Es liegt in drei Hauptallelen vor (ε2, ε3 und ε4), welche durch zwei Single-Nucleotide-Polymorphismen (SNPs), also Veränderungen einzelner Nukleotide im Gen, definiert werden.
Diese genetischen Varianten verändern jeweils eine Aminosäure an den Positionen 112 und 158 des Proteins und bestimmen die drei Isoformen APOE2, APOE3 und APOE4. Während APOE3 (Cys112/Arg158) als neutrale Referenzform gilt, wirkt APOE2 (Cys112/Cys158) protektiv und ist mit einem reduzierten AD-Risiko assoziiert. APOE4 (Arg112/Arg158) hingegen erhöht das Risiko für eine Alzheimererkrankung um etwa das Drei- bis Fünfzehnfache, je nach Vorliegen einer oder zweier APOE4-Kopien. Etwa 20–25 Prozent der europäischen Bevölkerung tragen ein APOE4-Allel (heterozygot), und rund zwei Prozent tragen zwei APOE4-Allele (homozygot) – unter Alzheimerpatient:innen liegt dieser Anteil jedoch bei bis zu 15 Prozent.3
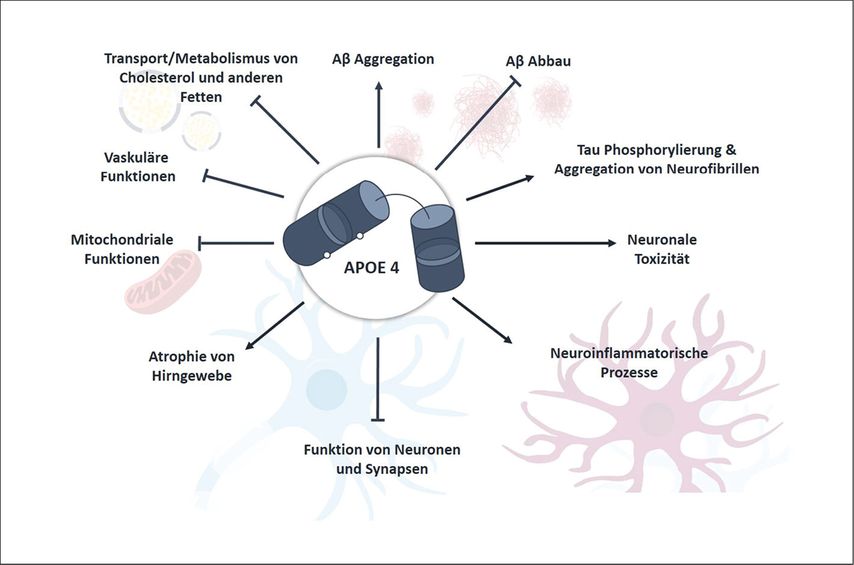
Abb. 2: Pathophysiologische Wirkmechanismen von APOE4 in der Alzheimererkrankung. APOE4 beeinflusst zahlreiche neurobiologische Prozesse, die zur Alzheimerpathogenese beitragen
Pathophysiologische Bedeutung
APOE wird im ZNS vor allem von Astrozyten exprimiert, aber auch von Mikroglia, Neuronen sowie Endothel- und glatten Gefäßmuskelzellen. Neben seiner zentralen Rolle im Lipid- und Cholesterintransport, trägt APOE zur Synapsenstabilität, neuronal-glialen Kommunikation, Immun- und Entzündungsregulation sowie zur perivaskulären und glialen Clearance von Amyloid-β (Aβ) bei.
APOE4 beeinträchtigt diese essenziellen Funktionen und verstärkt dadurch unterschiedliche pathologische Mechanismen der Alzheimererkrankung.4 Aktuelle Studien zeigen, dass APOE4-Homozygote bereits in jüngerem Alter charakteristische klinische, pathologische und biomarkerbasierte Veränderungen aufweisen. Diese Ergebnisse legen nahe, dass APOE4-Homozygotie eine eigene genetisch definierte Form der Alzheimererkrankung darstellen könnte.5 Vor dem Hintergrund neuer therapeutischer Optionen sind insbesondere drei Mechanismen hervorzuheben:
Amyloid--Metabolismus und Clearance
APOE4 beeinträchtigt die Bindung von Aβ an Lipoprotein-Rezeptoren und vermindert den Transport über die Blut-Hirn-Schranke. Die Folgen sind eine eingeschränkte perivaskuläre und gliale Clearance und eine frühere, ausgeprägtere Aβ-Ablagerung. Zusätzlich fördert APOE4 die Aggregation und Fibrillisierung von Aβ, wodurch Plaques stabiler und schwerer abzubauen sind.
Neuroinflammation und Mikroglia-Dysregulation
APOE4 führt zu einem proinflammatorischen Mikroglia-Profil und begünstigt einen reaktiven, potenziell neurotoxischen Astrozyten-Phänotyp. Dies resultiert in erhöhter Zytokinproduktion (z.B. IL-1β, TNF-α), chronischer Neuroinflammation, gestörter Synapsenhomöostase und sekundärer neuronaler Schädigung.
Vaskuläre Dysfunktion und Blut-Hirn-Schranken-Störung
APOE4 führt zu einer vaskulären Instabilität, einer erhöhten Permeabilität der Blut-Hirn-Schranke und einer reduzierten perivaskulären Clearance. Zudem besteht eine enge Assoziation mit der zerebralen Amyloidangiopathie (CAA), welche Mikroblutungen und Gefäßfragilität begünstigt.
Diese Kombination aus verringerter Amyloid-Clearance, verstärkter Neuroinflammation und vaskulärer Vulnerabilität trägt wesentlich dazu bei, dass APOE4-Träger:innen ein höheres Risiko für therapiebedingte ARIA („amyloid-related imaging abnormalities“) unter Anti-Amyloid-Antikörpern aufweisen.6
APOE und Anti-Amyloid-Therapien
Mit dem Einsatz von Anti-Amyloid-Antikörpern steht erstmals eine Therapie zur Verfügung, die gezielt gegen Amyloidablagerungen gerichtet ist und den Krankheitsverlauf messbar verlangsamen kann. Ein zentrales Thema im Rahmen dieser Behandlungen ist das Auftreten von ARIA. Diese im MRT nachweisbaren Veränderungen zählen zu den relevantesten therapieassoziierten Nebenwirkungen. Unter dem Begriff ARIA werden zwei Hauptformen unterschieden:
-
ARIA-E („edema/effusion“): meist asymptomatische vasogene Ödeme oder kortikale Hyperintensitäten
-
ARIA-H („hemosiderin deposition/hemorrhagic changes“): mikrohämorrhagische Veränderungen wie Mikroblutungen oder oberflächliche Hämosiderinablagerungen
ARIA treten typischerweise in den ersten Monaten nach Therapiebeginn auf und entstehen vermutlich durch eine rasche Amyloid-Clearance aus den Gefäßwänden im Rahmen einer CAA. Diese führt zu einer vorübergehenden Erhöhung der Gefäßpermeabilität, lokalen Entzündungsreaktionen und Mikroblutungen.
Die CAA gilt somit als zentrales Bindeglied zwischen APOE4, Amyloidpathologie und ARIA-Risiko. Amyloid lagert sich dabei nicht nur im Hirnparenchym, sondern auch in den Wänden kleiner und mittelgroßer Gefäße ab. Dadurch werden Gefäßwände fragiler, die perivaskuläre Clearance wird eingeschränkt und die Blut-Hirn-Schranke beeinträchtigt. APOE4 verstärkt diese Prozesse zusätzlich, indem es den Abtransport von Amyloid-β entlang der Gefäße reduziert und vaskuläre Entzündungsreaktionen fördert. Diese Kombination aus Amyloidlast und vaskulärer Vulnerabilität führt zu einem deutlich erhöhten Risiko für ARIA-E und ARIA-H bei APOE4-Träger:innen.7
In der Phase-III-Studie zu Lecanemab (CLARITY-AD) zeigte sich entsprechend ein klarer Zusammenhang zwischen APOE-Genotyp und ARIA-E-Inzidenz.
-
APOE4-Homozygote: ∼45% (vs. ∼22% unter Placebo)
-
APOE4-Heterozygote: ∼19% (vs. ∼9% unter Placebo)
-
Nicht-Träger:innen: ∼13% (vs. ∼4% unter Placebo)
Aufgrund dieses deutlich erhöhten Risikoprofils sind APOE4-homozygote Patient:innen laut EMA-Zulassung derzeit von einer Behandlung mit Lecanemab ausgeschlossen. Das Risiko ist besonders in den ersten drei Monaten der Therapie am höchsten – in jener Phase der intensivsten Amyloid-Clearance und erhöhten Gefäßpermeabilität.8
ARIA-Ereignisse werden bei allen klinisch wirksamen Anti-Amyloid-Antikörpern beobachtet, einschließlich Lecanemab, Donanemab und Aducanumab. Unterschiede liegen vor allem in Häufigkeit und Schweregrad, die eng mit dem APOE-Genotyp und der Therapiedynamik zusammenhängen.
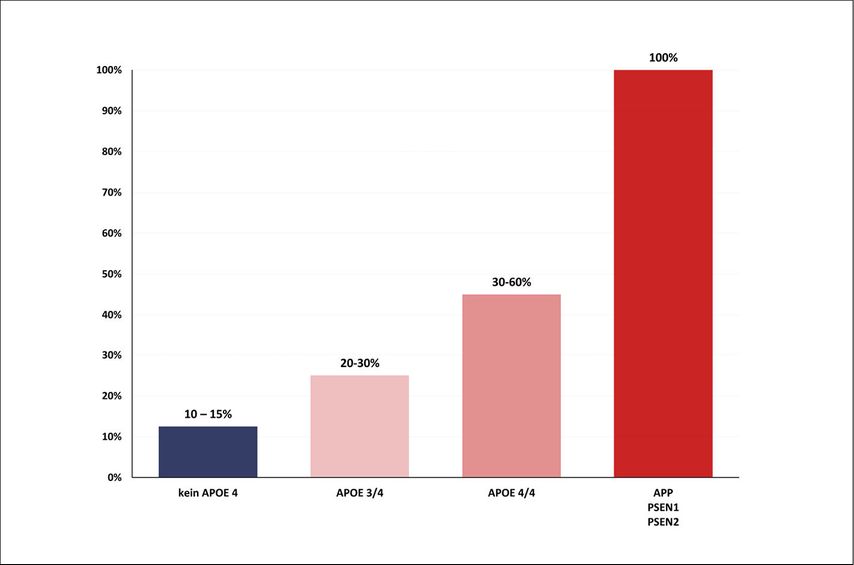
Abb. 3: Geschätztes Lebenszeitrisiko für die Entwicklung einer Alzheimererkrankung bis ca. 85 Jahre in Abhängigkeit vom APOE-Genotyp und im Vergleich zu autosomal-dominanten Varianten in APP, PSEN1 und PSEN2
Wann eine APOE-Testung sinnvoll ist – und wie sie durchgeführt wird
Die aktuelle S3-Leitlinie Demenzen (DGN/DGPPN, Version 5.2, 2025) rät weiterhin von einer APOE-Testung ab. Im Kontext der neuen krankheitsmodifizierenden Alzheimertherapien ist diese Empfehlung jedoch nicht mehr uneingeschränkt haltbar, da der APOE-Genotyp inzwischen direkte therapeutische Konsequenzen hat, insbesondere im Hinblick auf ARIA-Risiko und Therapieeignung. Trotzdem gilt unverändert: APOE ist kein diagnostisches Gen, sondern ein Risikomodifikator. Der Genotyp eignet sich daher nicht zur Routinediagnostik, nicht zur allgemeinen Risikovorhersage und nicht als Screening-Instrument – insbesondere nicht bei asymptomatischen Personen.
Die APOE-Genotypisierung ist daher gezielt und indikationsbasiert einzusetzen, z.B.:
-
vor geplanter Anti-Amyloid-Antikörper-Therapie zur Risikostratifizierung und Therapieentscheidung
-
in ausgewählten Fällen mit sehr frühem Krankheitsbeginn (<65 Jahren), wenn eine zusätzliche genetische Risikoeinschätzung sinnvoll erscheint
-
in Einzelfällen bei deutlicher familiärer Häufung, sofern Patient:innen nach Aufklärung eine Testung wünschen
-
im wissenschaftlichen bzw. Studienkontext
Die APOE-Genotypisierung erfolgt üblicherweise aus EDTA-Vollblut. Im Labor wird daraus genomische DNA isoliert und anschließend gezielt auf die beiden relevanten SNPs untersucht, welche die Allelvarianten ε2, ε3 und ε4 definieren. Dadurch lässt sich eindeutig bestimmen, welche APOE-Isoform(en) eine Person trägt.
Am häufigsten kommen PCR-basierte Methoden zum Einsatz, mit denen die entsprechenden Genregionen amplifiziert und die APOE-Varianten direkt bestimmt werden. Alternativ kann die Analyse mittels Sanger-Sequenzierung erfolgen. Für große Studienkohorten oder Forschungszwecke werden zunehmend Hochdurchsatz-Sequenzierungsverfahren und Genotypisierungs-Arrays eingesetzt, die neben APOE auch zahlreiche weitere genetische Varianten erfassen; diese spielen in der klinischen Routine jedoch eine untergeordnete Rolle.
Kommunikation genetischer Ergebnisse
Das Wissen um den eigenen APOE-Genotyp kann für Patient:innen psychologisch belastend sein. Studien zeigen jedoch, dass eine verantwortungsvolle Aufklärung und ärztliche Beratung in der Regel keine negativen psychischen Auswirkungen haben, unter der Voraussetzung, dass der Befund sorgfältig kommuniziert und ausreichend begleitet wird.9
Wichtig ist zu betonen, dass APOE4 ein Risikofaktor, aber kein diagnostisches Kriterium ist. Der Genotyp allein erlaubt keine sichere Vorhersage, ob oder wann eine Alzheimererkrankung auftritt. Zwar ist bei APOE4-Träger:innen im Durchschnitt mit einem früheren Erkrankungsbeginn zu rechnen, jedoch nicht vergleichbar mit autosomal-dominanten Mutationen (APP, PSEN1, PSEN2). Bei diesen monogenetischen Formen der Alzheimererkrankung treten klinische Symptome typischerweise bereits zwischen dem 30. und 60. Lebensjahr auf.
Zum Vergleich: Bei APOE4-Homozygoten liegt das mediane Erkrankungsalter typischerweise im späten 60er- bis frühen 70er-Lebensalter, während APOE3-Homozygote im Durchschnitt erst in den späten 70ern bis frühen 80ern symptomatisch werden. Diese Unterschiede reflektieren eine altersabhängige Penetranz. Nicht jede:r APOE4-Träger:in erkrankt – und viele Nicht-Träger:innen entwickeln dennoch eine Alzheimerdemenz. Entsprechend sollte die genetische Information immer im Kontext klinischer, biomarkerbasierter und bildgebender Befunde interpretiert werden.10–12
Viele Patient:innen äußern Sorge, dass ihre Kinder den APOE4/4-Genotyp erben könnten. Die kodominante Vererbung von APOE folgt den klassischen Mendel’schen Regeln: Jedes Kind erhält jeweils ein Allel von jedem Elternteil. Ist ein Elternteil APOE4-homozygot (ε4/ε4) und der andere APOE3-homozygot (ε3/ε3), werden die Kinder obligat APOE3/4-heterozygot sein. Entscheidend ist: Auch wenn ein Elternteil APOE4-homozygot ist, bedeutet dies nicht, dass die Kinder ebenfalls homozygot werden – dafür müssten beide Elternteile mindestens ein ε4-Allel tragen.
Neben genetischen Aspekten stellt sich für viele Betroffene die Frage: Was kann ich selbst tun, um mein Risiko zu beeinflussen? Dieses Thema gewinnt insbesondere vor dem Hintergrund an Bedeutung, dass APOE4-homozygote Patient:innen derzeit von einer Therapie mit Anti-Amyloid-Antikörpern ausgeschlossen sind und somit bislang keine krankheitsmodifizierende Behandlungsmöglichkeit zur Verfügung steht. Für Menschen mit erhöhtem genetischem Risiko rückt daher die gezielte Prävention in den Vordergrund.
Mehrere große epidemiologische und Interventionsstudien zeigen, dass Lebensstilfaktoren das individuelle Erkrankungsrisiko und den Zeitpunkt des Krankheitsbeginns beeinflussen können.13 Evidenzbasierte Maßnahmen umfassen insbesondere:
-
mediterrane Ernährung
-
regelmäßige körperliche Aktivität
-
kognitive Stimulation und soziale Aktivität
-
konsequente Kontrolle vaskulärer Risikofaktoren (z.B. Blutdruck, Lipidstatus, Blutzucker, Gewicht, Schlaf)
In einer aktuellen Studie zeigte sich, dass bei älteren, präklinischen Personen mit erhöhtem Amyloidbefund eine höhere Schrittzahl (5000–7500 Schritte/Tag) mit einer deutlich verzögerten Tau-Akkumulation und langsamerem kognitivem und funktionellem Abfall assoziiert war.14 Überdies wurde hinsichtlich Ernährung kürzlich gezeigt, dass besonders APOE4-Homozygote stark von einer mediterranen Ernährung profitieren.15 Ähnliche Vorteile wurden für eine gute vaskuläre Risikokontrolle und kognitive Stimulation gezeigt. Die Lebensstilmodifikation erhält damit eine zentrale Rolle in der Beratung und Begleitung von Personen mit erhöhtem genetischem Risiko. Präventionsstrategien sollten daher auch integraler Bestandteil der Beratung von APOE4-Träger:innen sein und bieten eine wissenschaftlich fundierte Möglichkeit, das individuelle Risiko zu reduzieren und Krankheitsbeginn und -progression potenziell hinauszuzögern.
Fazit
Mit den neuen krankheitsmodifizierenden Therapien gewinnt die genetische Risikostratifizierung bei Alzheimer an klinischer Bedeutung. APOE4 ist dabei nicht nur der stärkste genetische Risikofaktor für die sporadische Alzheimererkrankung, sondern beeinflusst auch das Nebenwirkungsprofil unter Anti-Amyloid-Antikörpern und damit die Therapieeignung. Zugleich eröffnet das Wissen um den Genotyp die Möglichkeit, gezielt präventiv zu handeln, insbesondere bei Patient:innen ohne aktuelle Therapieoption. Eine strukturierte Aufklärung, sorgfältige Indikationsstellung und ein individuelles Präventionskonzept sind daher entscheidend.
Literatur:
1 Guerreiro R, Hardy J: Genetics of Alzheimer’s disease. Neurotherapeutics 2014; 11(4): 732-7 2 Andrade-Guerrero J et al.: Alzheimer’s disease: An updated overview of its genetics. Int J Mol Sci 2023; 24(4): 3754 3 Farrer LA et al.: Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease - A meta-analysis. APOE and Alzheimer Disease Meta Analysis Consortium. JAMA 1997; 278(16): 1349-56 4 Raulin AC et al.: ApoE in Alzheimer’s disease: pathophysiology and therapeutic strategies. Mol Neurodegener 2022; 17(1): 72 5 Fortea J et al.: APOE4 homozygozity represents a distinct genetic form of Alzheimer’s disease. Nat Med 2024; 30(5): 1284-91 6 Hampel H et al.: Amyloid-related imaging abnormalities (ARIA): radiological, biological and clinical characteristics. Brain 2023; 146(11): 4414-24 7 Foley KE, Wilcock DM: Three major effects of APOE(epsilon4) on Abeta immunotherapy induced ARIA. Front Aging Neurosci 2024; 16: 1412006 8 Honig LS et al.: Updated safety results from phase 3 lecanemab study in early Alzheimer‘s disease. Alzheimers Research & Therapy 2024; 16(1): 105 9 Christensen KD et al.: Disclosing genetic risk for Alzheimer’s dementia to individuals with mild cognitive impairment. Alzheimers Dement (N Y) 2020; 6(1): e12002 10 Rasmussen KL et al.: Absolute 10-year risk of dementia by age, sex and APOE genotype: a population-based cohort study. CMAJ 2018; 190(35): E1033-41 11 Qian J et al.: APOE-related risk of mild cognitive impairment and dementia for prevention trials: An analysis of four cohorts. PLoS Med 2017; 14(3): e1002254 12 Bateman RJ et al.: Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. N Engl J Med 2012; 367(9): 795-804 13 Livingston G et al.: Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet 2020; 396(10248): 413-46 14 Yau W-YW et al.: Physical activity as a modifiable risk factor in preclinical Alzheimer’s disease. Nat Med 2025; doi: 10.1038/s41591-025-03955-6 15 Liu Y et al.: Interplay of genetic predisposition, plasma metabolome and Mediterranean diet in dementia risk and cognitive function. Nat Med 2025; doi: 10.1038/s41591-025-03891-5
Das könnte Sie auch interessieren:
Parkinsonprävention durch Lebensstilmodifikation
Noch bevor die ersten motorischen Symptome der Parkinsonkrankheit auftreten, beginnt die Erkrankung auf biologischer Ebene. Auch wenn bislang keine pharmakologische Neuroprotektion oder ...
Pharmakologische und neuromodulatorische Behandlungen des Clusterkopfschmerzes
Die Behandlung des chronischen Clusterkopfschmerzes steht noch heute vor großen Herausforderungen. Am 19. European Headache Congress (EHC) 2025 präsentierte Dr. Anja Petersen, ...
Ist die ketogene Diät eine Präzisionsmedizin?
Die ketogenen Ernährungstherapien sind etablierte Behandlungsformen bei Epilepsie. Während sie primär bei therapierefraktären pädiatrischen Epilepsien eingesetzt werden, finden sie ...