Update ANCA-Vaskulitis
Autor: PD Dr. med Harald Seeger
Klinik für Nephrologie
Universitätsspital Zürich
E-Mail: harald.seeger@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die mit antineutrophilen zytoplasmatischen Antikörpern (ANCA) assoziierten Vaskulitiden (AAV) sind eine Gruppe von Autoimmunerkrankungen, die durch eine destruktive Entzündung von kleinen und mittelgrossen Blutgefässen und das Vorhandensein von zirkulierenden ANCA gekennzeichnet sind. Die Prävalenz beträgt circa 300–421 Personen pro Million. Betroffen sind vor allem ältere Patienten im Alter von 60–70 Jahren. Dieser Artikel bietet ein Update über neue Studienresultate zur Therapie der AAV.
Keypoints
-
Niedrig dosierte Glukokortikoid-Induktions-Regimes zeigen eine vergleichbare Wirksamkeit wie Standard-Dosis-Regimes, sind aber mit weniger Nebenwirkungen assoziiert. Sie sollten deshalb in Zukunft bevorzugt werden.
-
Die Plasmapherese gehört nicht zur AAV-Standardinduktionstherapie.
-
RTX ist Azathioprin in der Erhaltungstherapie überlegen. Allerdings kommt es nach Stopp einer 18-monatigen Erhaltungstherapie mit RTX häufig zu Rezidiven. Eine Verlängerung der Erhaltungstherapie mit RTX um weitere 18 Monate ist sehr effizient und sollte bei erhöhtem Rezidivrisiko evaluiert werden.
-
Der C5aR-Antagonist Avacopan zeigt eine vergleichbare Wirksamkeit wie GC bei der Remissionsinduktion und ist mit weniger Nebenwirkungen assoziiert. Unter Therapie mit Avacopan kommt es im ersten Jahr zu deutlich weniger AAV-Rückfällen. Avacopan könnte auch für andere autoimmune Glomerulopathien in der Zukunft eine vielversprechende Therapie darstellen.
Einleitung
Zu den klinischen Phänotypen der AAV gehören die mikroskopische Polyangiitis (MPA), die Granulomatose mit Polyangiitis (GPA), die eosinophile Granulomatose mit Polyangiitis (EGPA) und die renal limitierte Vaskulitis. Bis zu 75% der Patienten weisen eine Nierenbeteiligung auf, was mit einer erhöhten Morbidität und Mortalität vergesellschaftet ist. Diese ist oft durch eine schnell fortschreitende Glomerulonephritis gekennzeichnet. Studien aus den letzten Jahrzehnten haben zu einer deutlichen Verbesserung der Therapiemöglichkeiten der AAV geführt und diese von einer tödlichen Krankheit zu einer chronischen Erkrankung mit rezidivierendem Verlauf gemacht.1 Während die Erkrankung mit den aktuellen Therapien in den meisten Fällen gut kontrollierbar ist, rücken nun vor allem die behandlungsassoziierten Komplikationen in den Vordergrund. Die aktuellen Bestrebungen zielen darauf hin, weniger toxische Therapiestrategien für die AAV zu entwickeln.
«Unmet needs» und ungeklärte Fragen bei der Therapie der AAV
Traditionell behandelt man Patienten mit neu aufgetretener AAV oder AAV-Rezidiv aufgrund der rasch einsetzenden entzündungshemmenden Wirkung initial mit Glukokortikoiden (GC). Diese werden kombiniert mit Cyclophosphamid oder Rituximab (RTX). Die anfängliche Induktionstherapie zielt darauf ab, die Krankheit zu kontrollieren und die Patienten in Remission zu bringen. Die anschliessende Erhaltungstherapie bezweckt, die Patienten über längere Zeit in Remission zu halten.GC-Nebenwirkungen wie Infektionen, Gewichtszunahme, Diabetes mellitus, Frakturen und andere tragen massgeblich zur Morbidität und Mortalität von Patienten mit AAV bei. So wurde gezeigt, dass im ersten Jahr der Therapie mehr Patienten an den Nebenwirkungen der Behandlung sterben als an der Krankheit selbst. Aus diesem Grund besteht der dringende Bedarf, GC schonender einzusetzen und alternative Substanzen zu entwickeln, welche eine den GC vergleichbare Wirksamkeit aufweisen, aber mit weniger Nebenwirkungen vergesellschaftet sind.
Ein ungeklärter Faktor bei der AAV-Induktion ist auch der Stellenwert der Plasmapherese (PEX). Studienergebnisse weisen darauf hin, dass die ANCA-Antikörper an der Pathogenese der Vaskulitis massgeblich beteiligt sind. Insofern scheint es logisch, dass die PEX, welche die ANCA-Antikörper aus dem Plasma entfernt, einen nützlichen Effekt bei der raschen Eindämmung der Erkrankung hat. Die Datenlage diesbezüglich ist jedoch alles andere als eindeutig. Eine weitere ungeklärte Frage ist die der optimalen AAV-Erhaltungstherapie und ihrer Dauer. Auch hierzu liegen neue und interessante Studien vor.
PEXIVAS-Studie2
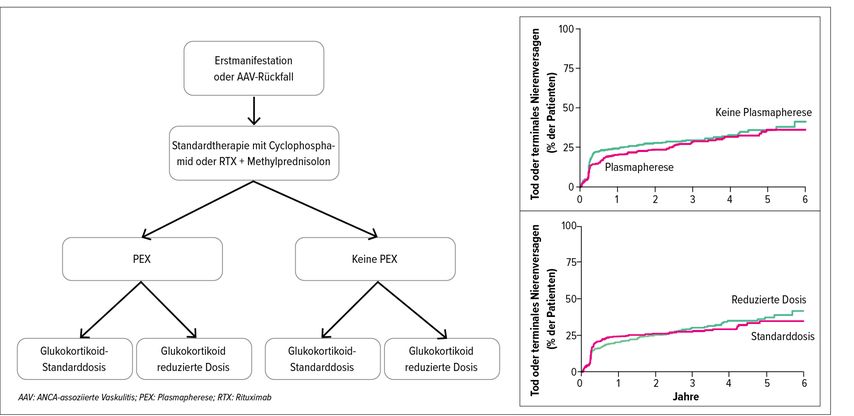
In den letzten zwei Jahren wurden mehrere kontrollierte Studien publiziert, welche den Einsatz niedrig dosierter GC-Schemata zur Induktionstherapie untersuchten. In der PEXIVAS-Studie, welche mit 704 eingeschlossenen Patienten bislang die grösste randomisierte und kontrollierte Studie bei der AAV ist, wurde der Einsatz der PEX im Vergleich zu keiner PEX und von oralen GC in Standard- oder reduzierter Dosierung (50% der Standarddosis) bei Patienten mit schwerer AAV-Vaskulitis (GPA oder MPA) untersucht (Abb. 1). Alle Patienten erhielten eine immunsuppressive Induktionstherapie mit entweder Cyclophosphamid (84%) oder RTX (16%) jeweils in Kombination mit Methylprednisolon-Stössen.
Abb. 1: PEXIVAS-Studie: Design (links) und primärer Endpunkt (Tod oder terminales Nierenversagen; rechts) (adaptiert nach Walsh et al., 2020)2
Die Studie ergab, dass der Einsatz der PEX nicht zu einer signifikanten Reduktion im primären zusammengesetzten Endpunkt aus Tod oder terminalem Nierenversagen (28,4% in der PEX-Gruppe versus 31,0% in der Non-PEX-Gruppe; Abb. 1 rechts oben) oder zu einer Verbesserung der sekundären Endpunkte anhaltende Remission, schwerwiegende unerwünschte Ereignisse oder schwerwiegende Infektionen nach einem Jahr führte. Subgruppenanalysen bei Patienten mit schwerem Nieren- oder Lungenbefall (alveoläre Hämorrhagie) zeigten einen Trend zu einem besseren Outcome in der PEX-Gruppe, der jedoch nicht statistisch signifikant war. Da nicht bei allen Patienten Nierenbiopsien durchgeführt wurden und Patienten mit schwerster alveolärer Hämorrhagie wahrscheinlich nicht eingeschlossen wurden, schliesst diese Studie einen möglichen Nutzen der PEX für Patienten mit schwerer, rapid progredienter Glomerulonephritis ohne fortgeschrittene renale Sklerosierung oder für Patienten mit schwerer diffuser alveolärer Hämorrhagie nicht sicher aus. Bei allen anderen Patienten liegt jedoch eindeutig kein Zusatznutzen der PEX vor. Das dosisreduzierte GC-Behandlungsschema war dem Standard-Dosierungsschema in Bezug auf die primären (27,9% vs. 25,5%; Abb. 1 rechts unten) und sekundären Endpunkte nicht unterlegen. Es zeigte sich hingegen ein signifikant geringeres Risiko für schwere Infektionen nach einem Jahr bei Patienten mit reduzierter GC-Dosis (HR: 0,69; 95% CI: 0,52–0,93).
RITAZAREM-Studie3
Vor Kurzem wurden auch die Ergebnisse der Induktionsphase der RITAZAREM-Studie veröffentlicht, die die Wirksamkeit von RTX als Induktions- und Erhaltungstherapie bei Patienten mit rezidivierender AAV (MPA oder GPA) untersuchte. In dieser Studie erhielten 188 Patienten mit AAV-Rezidiv eine Induktionstherapie mit RTX und GC für 4 Monate. Danach wurden sie nach dem Zufallsprinzip einer Erhaltungstherapie mit RTX (1g alle 4 Monate) oder Azathioprin für weitere 20 Monate zugeteilt. Nach Ermessen des Arztes wurde ein High- oder Low-Dose-GC-Schema eingesetzt. Die Ergebnisse der Induktionsphase zeigten, dass die Behandlung mit RTX und GC bis zum 4. Monat eine Remissionsrate von 90% erzielte. Es bestätigten sich damit die Ergebnisse aus der RAVE-Studie, welche ebenfalls ergab, dass RTX eine hervorragende Option für Rezidive einer AAV darstellt. 70% der Patienten in der RITAZAREM-Studie erhielten das Low-Dose-GC-Schema. Die Wahl des GC-Induktionsschemas war nicht prädiktiv für das Ansprechen auf die Therapie. Dies traf sowohl für Patienten mit einer schweren als auch solche mit einer leichteren Erkrankungsmanifestation zu. Zusammengefasst bestätigen diese Resultate die Erkenntnisse aus der PEXIVAS-Studie und demonstrieren, dass ein Low-Dose-GC-Induktionsschema der bisherigen GC-Standarddosierung auch bei Patienten mit AAV-Rezidiv nicht unterlegen ist.
Noch unpublizierte Resultate der RITAZAREM-Studie, welche am Kongress der European Renal Association – European Dialysis and Transplant Association (ERA-EDTA) 2020 vorgestellt wurden, zeigten zudem, dass RTX Azathioprin bei der Remissionserhaltung signifikant überlegen war.
ADVOCATE-Studie4
In den letzten Jahren rückte das Komplementsystem auch bei der AAV immer mehr in den Fokus. Es konnte im Tiermodell gezeigt werden, dass der Komplementrezeptor (C5aR) für die Komplementkomponente C5a eine entscheidende Rolle bei der Pathogenese der AAV spielt. C5a fungiert als Anaphylatoxin und rekrutiert Immunzellen an den Ort einer Gewebeschädigung. Avacopan ist ein niedermolekularer C5aR-Antagonist, welcher die chemotaktischen und proinflammatorischen Eigenschaften von C5a blockiert. Die randomisierte und doppelt verblindete Phase-III-Studie ADVOCATE untersuchte die Wirksamkeit von Avacopan bei 331 Patienten mit AAV und Nierenbeteiligung. Eingeschlossen wurden Patienten mit neu diagnostizierter oder rezidivierender AAV (MPA oder GPA) mit einer eGFR von über 15ml/min/1,73m2. Die Patienten erhielten entweder Cyclophosphamid oder RTX zur Induktion. Patienten unter Cyclophosphamid erhielten zur Erhaltungstherapie Azathioprin, während in der RTX-Gruppe bis zum Monat 12 kein RTX als Erhaltungstherapie zusätzlich zu den initialen vier Infusionen à 375mg/m2 KÖF verabreicht wurde.
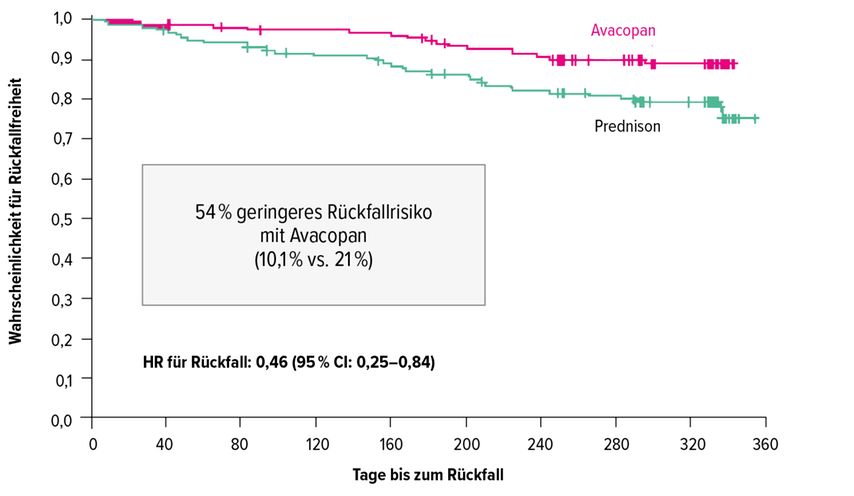
Die Studienteilnehmer erhielten entweder Avacopan oral in einer Dosis von 30mg zweimal täglich oder orales Prednison in einem Tapering-Schema. Zusätzliche intravenöse und/oder orale GC waren vor Studienbeginn und während der ersten 4 Wochen erlaubt, wenn dies zur anfänglichen Kontrolle der Erkrankung, zur Behandlung einer Nebennierenrindeninsuffizienz oder zur Therapie eines Relapses erforderlich war. Endpunkte waren Remission in Woche 26 bzw. anhaltende Remission in Woche 26 bzw. 52. Die Remissionsraten der Patienten unter Avacopan und der Patienten, die Prednison erhielten, lagen in Woche 26 bei 72,3% respektive 70,1%, was die Nichtunterlegenheit von Avacopan gegenüber Prednison demonstrierte. Zusätzlich war in Woche 52 die anhaltende Remission in der Avacopan-Gruppe signifikant häufiger (65,7% vs. 54,9% mit Prednison; Abb. 2). Unter Avacopan bestand ein 54% geringeres Rückfallrisiko (HR: 0,46, 95% CI: 0,25–0,84) (Abb. 2). Darüber hinaus zeigten sekundäre Analysen, dass bei den mit Avacopan behandelten Patienten eine bessere Erholung der Nierenfunktion und eine schnellere Reduktion der Proteinurie zu verzeichnen waren. Weiterhin bestand unter Avacopan ein Benefit in der gesundheitsbezogenen Lebensqualität und es traten weniger GC-Nebenwirkungen auf. Die Rate der schwerwiegenden unerwünschten Ereignisse in der Avacopan- und der Prednison-Gruppe betrugen 37,3% bzw. 39,0%. Bei den mit Avacopan behandelten Patienten traten keine Neisseria-meningitidis-Infektionen auf, wie sie bei Patienten mit atypischem hämolytischem Syndrom oder paroxysmaler nächtlicher Hämoglobinurie unter C5-Blockade mit Eculizumab beschrieben wurden.
Abb. 2: ADVOCATE-Studie: Rückfallrisiko unter Avacopan resp. Prednison (adaptiert nach Jayne et al., 2021)4
Die ADVOCATE-Studie belegt, dass die Inhibition der C5a-Wirkung eine vergleichbare entzündungshemmende Potenz hat wie die traditionell bei autoinflammatorischen Erkrankungen eingesetzten Steroide, jedoch mit signifikant weniger Nebenwirkungen. Diese Erkenntnis eröffnet auch neue Perspektiven für die Therapie anderer immunvermittelter Nierenerkrankungen, bei denen das Komplementsystem eine wichtige Rolle spielt und bei denen GC therapeutisch eingesetzt werden, wie zum Beispiel der IgA-Nephritis, der Lupus-Nephritis, der membranösen Glomerulonephritis oder der C3-Glomerulonephritis.
BREVAS-Studie5
Diverse Studien suggerieren eine Rolle für den B-Lymphozyten-Stimulator (BLyS) bei der Pathogenese der AAV. BLyS wird von Neutrophilen exprimiert, welche Schlüsselzellen bei der AAV-Pathogenese sind. Zudem wurden erhöhte Konzentrationen von zirkulierendem BLyS bei Patienten mit AAV festgestellt. Belimumab ist ein humaner monoklonaler Antikörper gegen BLyS und zugelassen für die Behandlung von Erwachsenen mit aktivem systemischem Lupus erythematodes. Die Phase-III-Studie BREVAS untersuchte den Effekt der zusätzlichen Gabe von 10mg/kg Belimumab alle 28 Tage bei Patienten mit AAV unter Erhaltungstherapie mit Azathioprin 2mg/kg und niedrig dosierten GC. Die Studie umfasste 105 AAV-Patienten in Remission, von denen 27 eine Induktionstherapie mit RTX und 78 mit Cyclophosphamid in Kombination mit hoch dosierten GC erhalten hatten. Der primäre Endpunkt der Studie war ein Komposit aus einem Birmingham Vasculitis Activity Score (BVAS) von mindestens 6 Punkten, mindestens einem major BVAS-Item oder der Einnahme eines Nichtstudienmedikamentes (immunmodulatorische Substanz, RTX, Cyclophosphamid, andere Immunsuppressiva oder GC<10mg/d). Während des Studienzeitraums trat dieser Endpunkt bei 18,9% der Patienten unter Belimumab auf und bei 21,2% der Patienten, die neben der Erhaltungstherapie Placebo erhalten hatten. Der Unterschied war nicht signifikant. Ein vergleichbarer Anteil der Patienten in beiden Gruppen erlitt einen AAV-Schub (11,3% vs. 15,4%). Interessanterweise zeigte sich, dass keiner der 14 Patienten mit RTX-induzierter Remission, die anschliessend Belimumab erhielten, ein AAV-Rezidiv erlitt, während Rezidive in der Placebo-Gruppe gleichmässig über beide Induktionsschemata verteilt waren. Dies ist ein interessantes Ergebnis, welches weitere Untersuchungen rechtfertigt. Andererseits erhalten heutzutage die meisten Patienten, welche mit RTX induziert wurden, nicht Azathioprin, sondern RTX zur Erhaltung, was erfreulicherweise mit sehr geringen Rückfallraten assoziiert ist. Zusammenfassend lässt sich sagen, dass Belimumab bei Patienten mit AAV und Erhaltungstherapie mit Azathioprin + GC keinen Zusatznutzen zu bringen scheint.
MAINRITSAN-3-Studie6
Die MAINRITSAN-1-Studie hatte gezeigt, dass RTX zur AAV-Erhaltungstherapie Azathioprin überlegen ist. Im Langzeit-Follow-up der MAINRITSAN-1-Studie fiel indes auf, dass es innerhalb von 36 Monaten nach Stoppen der Erhaltungstherapie auch in der RTX-Gruppe in 30% zu Rückfällen kam.7 Die MAINRITSAN-2-Studie zur AAV-Erhaltungstherapie zeigte, dass die Gabe von RTX, gesteuert anhand der ANCA-Titer und der CD19-Zellen, vergleichbar wirksam war wie fixe RTX-Gaben à 500mg alle 6 Monate.8
In der MAINRITSAN-3-Studie wurde die Wirksamkeit einer Verlängerung der RTX-Erhaltungstherapie um weitere 18 Monate untersucht. An dieser Phase-III-Studie nahmen 97 Patienten teil, die nach 18 Monaten RTX-Erhaltungstherapie in der Studie MAINRITSAN 2 in kompletter Remission waren. Die Teilnehmer erhielten entweder RTX (500mg alle 6 Monate) oder Placebo. Nach 28 Monaten hatten signifikant weniger Studienteilnehmer unter RTX als unter Placebo einen Rückfall erlitten (4% vs. 26%), was einer 7,5-fachen Verringerung des Risikos entspricht. Bei den Teilnehmern unter RTX wurden keine schweren Rückfälle gemeldet, während diese bei Teilnehmern unter Placebo in 13% auftraten. Rückfälle traten bei Patienten mit ANCA gegen Proteinase 3 (PR3) häufiger auf als bei Patienten mit ANCA gegen Myeloperoxidase (MPO). Im Placebo-Arm erlitten 40% der Teilnehmer mit PR3-ANCA einen Rückfall, verglichen mit 12% der Teilnehmer mit MPO-ANCA. Die Rate der unerwünschten Ereignisse war in beiden Gruppen ähnlich (92% für RTX und 94% für Placebo), ebenso die Rate der schwerwiegenden unerwünschten Ereignisse (24% vs. 30%) und die der schwerwiegenden Infektionen (12% vs. 9%). Die verlängerte Erhaltungstherapie mit RTX schien also weder die Anzahl der unerwünschten Ereignisse noch deren Schweregrad zu erhöhen. Einschränkend muss gesagt werden, dass nur Individuen eingeschlossen wurden, die bereits in der Lage waren, eine Remission mit RTX zu erreichen, und die das Medikament gut vertragen hatten, sodass die Ergebnisse vermutlich nicht auf alle AAV-Patienten anwendbar sind.
Literatur:
1 Kitching AR et al.: ANCA-associated vasculitis. Nat Rev Dis Primers 2020; 6: 71 2 Walsh M et al.: Plasma exchange and glucocorticoids in severe ANCA-associated vasculitis. N Engl J Med 2020; 382: 622-31 3 Smith RM, et al.: Rituximab as therapy to induce remission after relapse in ANCA-associated vasculitis. Ann Rheum Dis 2020; 79: 1243-9 4 Jayne DRW et al.: Avacopan for the treatment of ANCA-associated vasculitis. N Engl J Med 2021; 384: 599-609 5 Jayne D et al.: Efficacy and safety of belimumab and azathioprine for maintenance of remission in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized controlled study. Arthritis Rheumatol 2019; 71: 952-63 6 Charles P et al.: Long-term rituximab use to maintain remission of antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Intern Med 2020; 173: 179-87 7 Terrier B et al.: Long-term efficacy of remission-maintenance regimens for ANCA-associated vasculitides. Ann Rheum Dis 2018; 77: 1150-6 8 Charles P et al.: Comparison of individually tailored versus fixed-schedule rituximab regimen to maintain ANCA-associated vasculitis remission: results of a multicentre, randomised controlled, phase III trial (MAINRITSAN2). Ann Rheum Dis 2018; 77: 1143-9