Wieviel Vorhofflimmern ist Vorhofflimmern und ab wann wird antikoaguliert?
Autor:innen:
Dr. Dagmar Burkart-Küttner
Dr. Markus Meißner
2. Medizinische Abteilung/Kardiologie
Hanusch-Krankenhaus, Wien
E-Mail: markus.meissner@oegk.at
E-Mail: dagmar.burkart-kuettner@oegk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Vorhofflimmern (VHF) ist sehr häufig und tritt in vielen unterschiedlichen Erscheinungsformen auf. Während wir relativ genau wissen, wie klinisches VHF zu behandeln ist, stellt uns subklinisches VHF immer noch vor große Herausforderungen. Es tritt bei einem Viertel der Herzschrittmacherpatienten auf und das Schlaganfallrisiko ist abhängig vom individuellen Risikoprofil und der Flimmerlast. Wann eine Antikoagulation begonnen werden sollte, ist Gegenstand aktueller Forschung.
Keypoints
-
Klinisches VHF muss ab einem CHA2DS2VA-Score von 2 antikoaguliert werden.
-
Subklinisches VHF ist häufig und birgt vor allem in einem alten und multimorbiden Patientenkollektiv ein erhöhtes Schlaganfallrisiko.
-
Ob eine orale Antikoagulation notwendig ist, hängt stark vom Risikoprofil des Patienten und der Last des subklinischen VHF ab.
-
Sollte ein Patient ein subklinisches VHF ohne Indikation zur Antikoagulation haben, sind engmaschige Verlaufskontrollen notwendig, um eine Progression früh zu bemerken.
Vorhofflimmern ist die häufigste Rhythmusstörung der Welt. Ursächlich ist meistens eine ektope Aktivierung aus den Pulmonalvenen im linken Vorhof. Es handelt sich um eine supraventrikuläre Arrhythmie mit unkoordinierter atrialer Aktivierung, die zu einem Verlust der Vorhofkontraktion führt. Im EKG fällt ein Vorhofflimmern durch fehlende P-Wellen und einen irregulären RR-Abstand auf. Die Diagnose wird durch typische Symptome wie Palpitationen und Dyspnoe sowie durch die Dokumentation in einem 12-Kanal-EKG oder auf einem Rhythmusstreifen (1 bis 6 Ableitungen) über 30 Sekunden gestellt.1,2
Schlaganfall- und Blutungsrisiko eines klinischen Vorhofflimmerns
Unbehandeltes klinisches VHF erhöht das Risiko für einen ischämischen Schlaganfall um das 5-Fache. Allerdings ist das Schlaganfallrisiko von vielen Faktoren abhängig und variiert stark zwischen unterschiedlichen Patienten.1,2 Die VHF-Last hat einen Einfluss auf das Thromboembolierisiko. So liegt das durchschnittliche Schlaganfallrisiko bei subklinischem VHF bei ca. 1%,wohingegen es bei permanentem/persistierendem VHF bei ca.3% liegt. Das Risiko für paroxysmales VHF bewegt sich bei ca.2%.3 Trotz dieser Erkenntnis hängt beim klinischen VHF die Indikation zur oralen Antikoagulation vor allem von klassischen Risikofaktoren ab, die mittels CHA2DS2VASc-/CHA2DS2VA-Score berechnet werden. Ab einem CHA2DS2VA-Score von 2 liegt das jährliche Thromboembolierisiko durch klinisches VHF bei 2,2%.4 Es bestehen noch weitere Risikofaktoren für einen Schlaganfall, die allerdings in den genannten Scores nicht enthalten sind, wie zum Beispiel Übergewicht, linksatriale Dilatation und Niereninsuffizienz.2
Unter einer oralen Antikoagulation steigt das Blutungsrisiko. Durch eine Therapie mit direkten oralen Antikoagulanzien (DOAK) erleiden ca.2–3% der Patienten pro Jahr eine schwere Blutung und 0,3–0,8% eine intrakranielle Blutung.5–8 Das Blutungsrisiko ist wie das Schlaganfallrisiko sehr individuell vom jeweiligen Patienten abhängig. Eine Orientierungshilfe kann hier der HAS-BLED-Score sein, allerdings wird er in den 2024 erschienenen Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) nicht mehr empfohlen.1
Orale Antikoagulation eines klinischen Vorhofflimmerns
DOAK können das Schlaganfallrisiko um bis zu zwei Drittel senken, jedoch erhöhen sie auch das Blutungsrisiko. Zu beachten ist allerdings, dass Schlaganfälle meistens schwerere und länger anhaltende Konsequenzen nach sich ziehen als Blutungen.9 Daher kann ab einem jährlichen Thromboembolierisiko von 1–2% mit einer oralen Antikoagulation begonnen werden. Ab 2% besteht eine klare Empfehlung für eine Therapie (1A-Empfehlung). Daraus lässt sich ableiten, dass ab einem CHA2DS2VA-Score von 2 Punkten bei klinischem VHF eine lebenslange Antikoagulation begonnen werden muss (1C-Empfehlung). Patienten mit hypertropher Kardiomyopathie oder kardialer Amyloidose sollen unabhängig vom CHA2DS2VA-Score immer ein DOAK erhalten (1B-Empfehlung). Unter speziellen Umständen benötigen auch Patienten mit einem CHA2DS2VA-Score von 0 oder 1 eine Antikoagulation:einerseits zumindest 3 Wochen vor und 4 Wochen nach einer Kardioversion und andererseits 3 Wochen vor und 8 Wochen nach einer Pulmonalvenenisolation (PVI).1,2 Patienten mit erhöhtem thromboembolischem Risiko müssen auch nach einer erfolgreichen PVI ihre Antikoagulation ein Leben lang weiter nehmen.10
Definition eines subklinischen Vorhofflimmerns
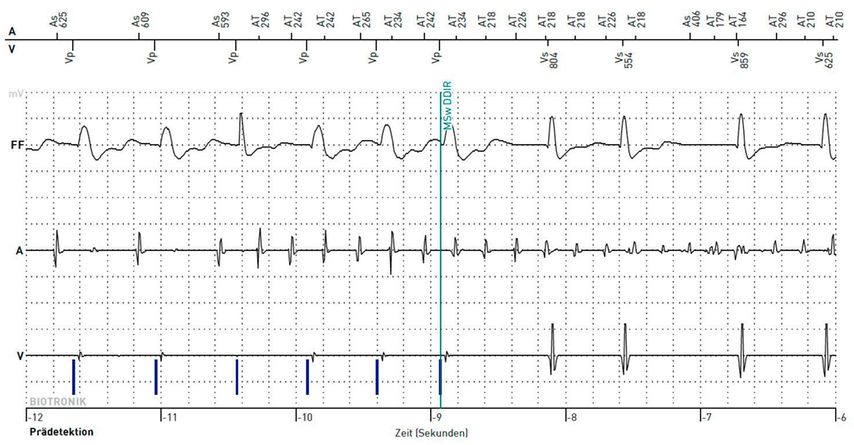
Im Unterschied zum klassischen oder klinischen VHF treten beim subklinischen keine Beschwerden auf und es wird in keinem 12-Kanal-EKG dokumentiert. Unter dem Begriff subklinisches VHF versteht man zumeist kurze, seltene atriale Rhythmusereignisse, die durch Geräte mit einer kontinuierlichen EKG-Überwachung (z.B.Loop-Rekorder, Schrittmacher und ICD mit Vorhofsonde) aufgezeichnet werden. Deshalb wird auch oft der Begriff „device“-detektiertes subklinisches VHF verwendet. Darunter werden „atrial high-rate episodes“ (AHRE) durch die ESC wie folgt definiert: „device“-detektierte atriale Tachykardien mit einer Frequenz höher als 170 Schläge pro Minute (Abb.1). Zur Diagnosesicherung müssen diese Episoden manuell durch einen Arzt analysiert werden.1,2 Die Begriffe subklinisches VHF und AHRE sind so gesehen keine Synonyme. Allerdings beschreiben sie letztendlich die gleiche Rhythmusstörung, nämlich kurze atriale Tachykardien, die als Vorhofflimmern gewertet werden.11
Abb. 1: Intrakardiale EKG-Aufzeichnung des Beginns einer AHRE mithilfe des 2-Kammer-AICD (automatischer implantierbarer Kardioverterdefibrillator)Rivacor 7 DR-T der Fa. Biotronik
Häufigkeit von subklinischem Vorhofflimmern
Die Prävalenz von subklinischem Vorhofflimmern variiert stark zwischen den einzelnen Publikationen. Sie ist abhängig vom Alter und von den Komorbiditäten der Patientensowie vom Diagnosealgorithmus des verwendeten EKG-Monitors. Im Mittel liegt die Prävalenz bei 10–30% der Patienten mit kardiovaskulären Erkrankungen.11 In einer Metaanalyse mit über 72000 Probanden konnte subklinisches VHF bei 28,1% der Patienten festgestellt werden. Diese waren älter, litten häufiger an Hypertension oder Herzinsuffizienz und hatten mehr Schlaganfälle in der Anamnese. Der CHA2DS2VA-Score lag in dieser Gruppe zusätzlich höher.12 Patienten mit einer Herzinsuffizienz mit normaler Ejektionsfraktion (HFpEF) haben eine doppelt so hohe Prävalenz für subklinisches VHF als Menschen ohne.13 In der ASSERT-Studie konnte bei 24,5% der Teilnehmer mit Schrittmacher oder ICD ein subklinisches Vorhofflimmern (definiert als AHRE mit über 190 Schlägen pro Minute und länger als 6 Minuten) in 2,5 Jahren gefunden werden.14
Progression von subklinischem zu klinischem Vorhofflimmern
Subklinisches VHF zeigt eine Progressionsrate von ca.6–9% pro Jahr.1 In der NOAH-AFNET-6-Studie entwickelten 18,2% der Probanden (8,7% pro Patientenjahr) innerhalb des Beobachtungszeitraums von 21 Monaten ein klinisches VHF (Diagnose mit 12-Kanal-EKG).15 Mehr als 50% der Patienten mit subklinischem VHF und einer hohen Flimmerlast (kumulativ mehr als 24 Stunden in 6 Monaten) entwickeln innerhalb von 5 Jahren ein klinisches VHF. Im Gegensatz dazu besteht bei niedriger Flimmerlast auch nur eine geringe Progressionstendenz.16 Subklinisches Vorhofflimmern zeigt eine deutlich höhere Tendenz zur Progression als klassisches paroxysmales VHF. Bei Patienten mit fehlenden Komorbiditäten kann dieses jahrzehntelang stabil bleiben. Die Rate der Progression in ein persistierendes VHF beträgt im Durchschnitt 5% pro Jahr.3
Schlaganfallrisiko bei subklinischem Vorhofflimmern
In der ASSERT-Studie wurde das thromboembolische Schlaganfallrisiko von Patienten mit subklinischem VHF (AHRE länger als 6 Minuten) ermittelt. Die Probanden mussten älter als 65 Jahre sein und an einer arteriellen Hypertension leiden. Weiters durfte vor Studieneintritt nie ein VHF oder ein Vorhofflattern dokumentiert worden sein. Mit einer jährlichen Schlaganfallrate von 1,7% unter den Teilnehmern mit einem subklinischen VHF war diese signifikant höher als bei Patienten ohne die genannte Rhythmusstörung. Das Insultrisiko stieg um 13%. Die Patienten hatten einen durchschnittlichen CHA2DS2VA-Score von 2,2.14 In einer großen Metaanalyse aus 11 Studien konnten diese Ergebnisse bestätigt werden. Auch hier betrug die jährliche Schlaganfallrate 1,9% mit einem 2,4-fach erhöhten Risiko im Vergleich zu Patienten ohne subklinisches VHF.17
In der ASSERT-Studie wurde die Vermutung geäußert, dass die Dauer der längsten aufgezeichneten VHF-Episode einen Einfluss auf das Schlaganfallrisiko habe. In einer weiteren Untersuchung konnte diese Vermutung bestätigt werden. Bei Patienten mit einer durchgehenden subklinischenVHF-Episode von mehr als 24 Stunden bestand eine jährliche Insultrate von 3,1%. Bei einer Dauer zwischen 6 Minuten und 24 Stunden konnte kein signifikanter Unterschied festgestellt werden.18 Nicht nur die Dauer der längsten einzelnen Flimmerepisode, sondern auch die Zunahme der gesamten subklinischen VHF-Last erhöhen das Schlaganfallrisiko. Patienten, die über einen Zeitraum von 6 Monaten insgesamt länger als 24 Stunden subklinisches VHF haben, zeigen ein signifikant erhöhtes Schlaganfallsrisiko im Vergleich zu Patienten mit einer niedrigeren Flimmerlast.16
Die oben bereits beschriebenen Studien konnten demonstrieren, dass mit steigender Dauer der subklinischen Vorhofflimmerepisoden das Schlaganfallrisiko ansteigt.
In einer Untersuchung von Kaplan etal. wurde der prognostische Wert des CHA2DS2VA-Scores bei subklinischem VHF unterschiedlicher Dauer in Bezug auf das thromboembolische Risiko untersucht. Ab einem CHA2DS2VA-Score von 2 betrug das jährliche Schlaganfallrisiko bei Episoden über 23,5 Stunden 1,5%. Bei kürzerer Dauer des Vorhofflimmerns (6 Minuten bis 23,5Stunden) lag bei gleichem Risikoscore die jährliche Insultrate bei 0,6%. Erst ab einem CHA2DS2VA-Score von 3–4 stieg das Risiko über die 1%-Marke (1,3% jährliche Schlaganfallrate).19
Orale Antikoagulation und subklinisches Vorhofflimmern
In den beschriebenen Beobachtungsstudien konnte das erhöhte Schlaganfallrisiko bei subklinischem VHF ohne Antikoagulation beschrieben werden. In zwei randomisiert-kontrollierten Doppelblindstudien aus den Jahren 2023 und 2024 wurde der Effekt von DOAK analysiert. ARTESiA verglich die Schlaganfallrate zwischen Acetylsalicylsäure (ASS) und Apixaban bei Patienten mit einem subklinischen VHF (Dauer 6 Minuten bis 24 Stundeh) über 3,5 Jahre. Apixaban konnte die jährliche Schlaganfallrate im Vergleich zu ASS signifikant senken (0,8% vs. 1,2%). Allerdings stieg auch die jährliche Blutungsrate in der Apixaban-Gruppe signifikant an (1,7% vs. 0,9%). Der Unterschied in der Häufigkeit von Blutungen war vor allem durch kleinere Blutungen, die konservativ behandelt werden konnten, getrieben. Signifikante Differenzen bei tödlichen oder intrakraniellen Blutungen gab es zwischen ASS und Apixaban nicht. Die Patienten hatten einen mittleren CHA2DS2VA-Score von 3,9. Die Vorhofflimmerlast im untersuchten Kollektiv war niedrig (1,5 Stunden im Durchschnitt).20
In einer Subgruppenanalyse des ARTESiA-Kollektivs konnte gezeigt werden, dass mit steigendem CHA2DS2VA-Score der positive Effekt von Apixaban zunahm. Ab einem Risikoscore über 4 betrug die absolute Risikoreduktion für einen Schlaganfall 4% („number needed to treat“ [NNT] 25) und das absolute Risiko für eine Blutung 1,7% („number needed to harm“ [NNH] 59). Im Gegensatz dazu entstand bei einem CHA2DS2VA-Score<4 kein Vorteil in der Behandlung mit Apixaban (NNT zur Schlaganfallprophylaxe 2500 und NNH für Blutungen 78).21 Noch mehr profitierten Patienten mit subklinischem VHF im ARTESiA-Kollektiv von Apixaban bei einem bereits abgelaufenen Schlaganfall/TIA in der Anamnese. Es kam zu einer absoluten Risikoreduktion von 6,2% (NNT: 16) bei einem moderaten Blutungsrisiko (NNH: 91).22
Die zweite große randomisiert-kontrollierte Doppelblindstudie war NOAH-AFNET-6. In dieser Arbeit wurde Edoxaban mit einem Placebo verglichen. Der primäre Endpunkt war eine Kombination aus kardiovaskulärem Tod und thromboembolischen Ereignissen. Die Studie musste nach 21 Monaten vorzeitig abgebrochen werden, aufgrund der fehlenden Effizienz von Edoxaban bei subklinischem VHF. Ein signifikanter Unterschied im primären Endpunkt konnte nicht festgestellt werden. Es kam zu signifikant mehr Blutungen im Edoxabanarm.15 In einer Subgruppenanalyse von NOAH-AFNET-6 konnten auch keine signifikanten Unterschiede in Bezug auf die Schlaganfallraten in Abhängigkeit von Alter, CHA2DS2VA-Score und Nierenfunktion festgestellt werden.23
In einer Metaanalyse der beiden randomisiert kontrollierten Studien von McIntyre etal. wurde gezeigt, dass DOAK in einer gepoolten Analyse sowohl das Schlaganfallrisiko signifikant senken konnten als auch das Risiko eines kombinierten Endpunkts aus kardiovaskulärem Tod, Insult, peripherer Embolie, Herzinfarkt und Lungenembolie. Eine Mortalitätssenkung durch DOAK war nicht möglich. Das Blutungsrisiko war erhöht.24
Umgang mit subklinischem Vorhofflimmern im medizinischen Alltag
Aus einer großen Menge an Studien wissen wir, dass das thromboembolische Risiko bei subklinischem VHF geringer ist als das beiklinischem. Vergleicht man ARTESiA (Apixaban vs. ASS bei subklinischem VHF) mit AVERROES (Apixaban vs. ASS bei klinischem VHF), so erkennt man, dass Apixaban in beiden Fällen das Schlaganfallrisiko senkt, aber der protektive Effekt bei klinischem VHF größer ist.20,25 Das Blutungsrisiko bei einer Antikoagulation bleibt allerdings gleich. Auch die Aussagekraft des CHA2DS2VA-Scores muss bei AHRE anders gewertet werden. Die amerikanischen VHF-Leitlinien aus dem Jahr 2023 empfehlen eine Antikoagulation mit einer 2A-Empfehlung ab einem jährlichen Schlaganfallrisiko von >1% und sogar mit einer 1A-Empfehlung ab 2%.
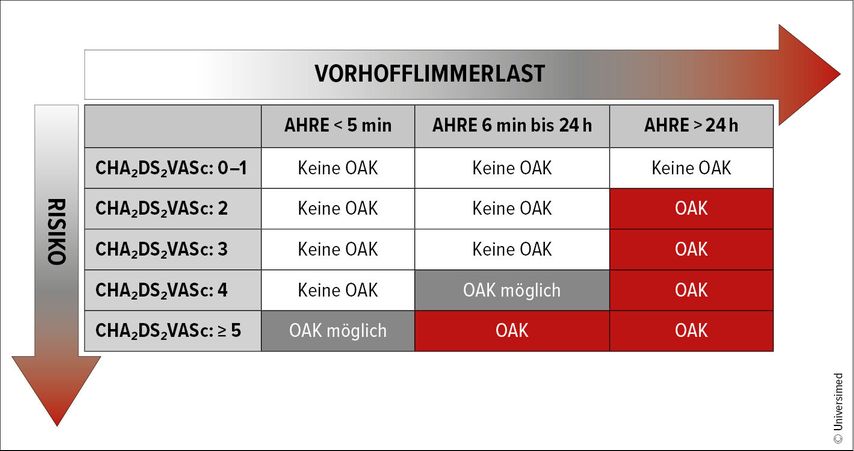
Wir empfehlen, diese 1%-Marke nach Abwägung des individuellen Blutungsrisikos als Grenze für den Beginn einer oralen Antikoagulation bei subklinischem VHF heranzuziehen (Abb.2). Errechnen lässt sich das Risiko aus der Dauer der AHRE und dem CHA2DS2VA-Score.19 Ein subklinisches VHF mit einer Dauer <5 Minuten bedarf laut aktuellen Leitlinien keiner generellen Antikoagulation. Einzige Ausnahme wäre ein sehr hohes individuelles Risikoprofil. Allerdings sollten diese Patienten engmaschig kontrolliert werden, um eine Progression frühzeitig zu erkennen. AHRE mit einer Dauer über 24 Stunden können mit gleichen CHA2DS2VA-Score-Grenzen wie die eines klinischen VHF behandelt werden.2 Deutlich komplizierter ist die Entscheidung bei Episoden mit einer Dauer zwischen 6 min und 24 h. Aus ARTESiA und ihren Subgruppenanalysen wissen wir, dass Patienten mit einem Schlaganfall/einer TIA in der Anamnese oder einem CHA2DS2VA-Score von mehr als 4 klar von einer Antikoagulation profitieren.20 Bei einem Wert von 4 muss individuell nach Patientenwunsch und Risikoprofil entschieden werden. Für 3 oder weniger Punkte konnte kein Behandlungsvorteil mit einer Antikoagulation beschrieben werden.21,22 Zuletzt ist anzumerken, dass die amerikanischen Leitlinien schon ab einem CHA2DS2VA-Score von 3 eine Antikoagulation bei AHRE zwischen 5 Minuten und 24 Stunden empfehlen. Allerdings entstand die Empfehlung vor der Veröffentlichung von ARTESiA.
Abb. 2: Empfehlung einer oralen Antikoagulation (OAK): Ab einer jährlichen Schlaganfallrate von einem Prozent wird eine OAK empfohlen. Da die Originalstudien den CHA2DS2VASc verwendeten, wird auch hier dieser statt des CHA2DS2VA verwendet. Die Angaben berücksichtigen nicht das individuelle Blutungsrisiko oder zusätzliche thromboembolische Risikofaktoren (auf Basis von ARTESiA und Subgruppenanalyse nach Lopes et al. sowie einer Datenanalyse von Kaplan et al.)20, 21, 19
Literatur:
1 Van Gelder IC et al.: 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2024; 45(36): 3314-414 2 Joglar JA et al.: 2023 ACC/AHA/ACCP/HRS Guideline for the diagnosis and management of atrial fibrillation: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines. J Am Coll Cardiol 2024; 149(1): e1-156 3 Becher N et al.: Atrial fibrillation burden: a new outcome predictor and therapeutic target. Eur Heart J 2024; 45(31): 2824-38 4 Friberg L et al.: Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish atrial fibrillation cohort study. Eur Heart J 2012; 33(12): 1500-10 5 Granger CB et al.: Apixaban versus Warfarin in patients with atrial fibrillation. NEJM 2011; 365(11): 981-92 6 Giugliano RP et al.: Edoxaban versus Warfarin in patients with atrial fibrillation. NEJM 2013; 369(22): 2093-104 7 Patel MR et al.: Rivaroxaban versus Warfarin in nonvalvular atrial fibrillation. NEJM 2011; 365(10): 883-91 8 Connolly SJ et al.: Dabigatran versus Warfarin in patients with atrial fibrillation. NEJM 2009; 61(12): 1139-51 9 Gorey S et al.: Anticoagulation or antiplatelet therapy for device-detected atrial fibrillation. NEJM 2025; 392(17): 1749-51.10 Tzeis S et al.: European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace 2024; 26(4): euae043 11 Toennis T et al.: The influence of atrial high-rate episodes on stroke and cardiovascular death: an update. Europace 2023; 25(7): euad166 12 Proietti M et al.: Epidemiology of subclinical atrial fibrillation in patients with cardiac implantable electronic devices: a systematic review and meta-regression. Eur J Intern Med 2022; 103: 84-94 13 Yang E et al.: Prevalence of subclinical atrial fibrillation in heart failure with preserved ejection fraction. JACC Heart Fail 2024; 12: 492-504 14 Healey JS et al.: Subclinical atrial fibrillation and the risk of stroke. NEJM 2011; 366(2): 120-9 15 Kirchhof P et al.: Anticoagulation with Edoxaban in patients with atrial high-rate episodes. NEJM 2023; 389(13): 1167-79 16 Park YJ et al.: Subclinical atrial fibrillation burden and adverse clinical outcomes in patients with permanent pacemakers. Stroke 2021; 52(4): 1299-308 17 Mahajan R et al.: Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. Eur Heart J 2018; 39(16): 1407-15 18 Van Gelder IC et al.: Duration of device-detected subclinical atrial fibrillation and occurrence of stroke in ASSERT. Eur Heart J 2017; 38(17): 1339-44 19 Kaplan RM et al.: Stroke risk as a function of atrial fibrillation duration and CHA2DS2-VASc score. Circulation 2019; 140(20): 1639-46 20 Healey JS et al.: Apixaban for stroke prevention in subclinical atrial fibrillation. NEJM 2024; 390(2): 107-17 21 Lopes RD et al.: Apixaban vs aspirin according to CHA2DS2-VASc score in subclinical atrial fibrillation: insights from ARTESiA. J Am Coll Cardiol 2024; 84(4): 354-6422 Shoamanesh A et al.: Apixaban versus aspirin for stroke prevention in people with subclinical atrial fibrillation and a history of stroke or transient ischaemic attack: subgroup analysis of the ARTESiA randomised controlled trial Lancet Neurol 2025;24(2): 140-51 23 Lip GYH et al.: Oral anticoagulation in device-detected atrial fibrillation: effects of age, sex, cardiovascular comorbidities, and kidney function on outcomes in the NOAH-AFNET 6 trial. Eur Heart J 2024; 45(19): 1733-37 24 McIntyre WF et al.: Direct oral anticoagulants for stroke prevention in patients with device-detected atrial fibrillation: a study-level meta-analysis of the NOAH-AFNET 6 and ARTESiA trials. Circulation 2024; 149(13): 981-8 25 Connolly SJ et al.: Apixaban in patients with atrial fibrillation. NEJM 2011; 364(9): 806-17
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Molekulare und zelluläre Veränderungen in der Pathophysiologie der Herzinsuffizienz
Herzinsuffizienz (HI) entsteht durch strukturelle und funktionelle Veränderungen des Herzens, die zu einer unzureichenden Pumpleistung führen. Zentral sind maladaptive Prozesse in ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...