Weltweit Prävalenz steigend: Erwachsene mit angeborenem Herzfehler
Autor:
Univ.-Prof. Dr. Ralf Geiger
Universitätsklinik für Pädiatrie III
Kardiologie, Pneumologie, Allergologie, zystische Fibrose
Medizinische Universität Innsbruck
E-Mail: ralf.geiger@tirol-kliniken.at
Steigende Zahlen von älteren Patient:innen bzw. Erwachsenen mit angeborenen Herzfehlern (EMAH) und die hohe Komplexität der AH erfordern darauf spezialisierte Versorgungsstrukturen und führen in der Betreuung zu einigen Herausforderungen.
Keypoints
-
Die Epidemiologie der angeborenen Herzfehler verändert sich: Die Population verlagert sich in das höhere Erwachsenenalter.
-
Bei komplexen AH ist bei Erwachsenen die detaillierte Kenntnis der Diagnose, vorangegangener Eingriffe und der aktuellen Anatomie mit der daraus resultierenden Hämodynamik essenziell.
-
Eine regelmäßige Nachsorge, besonders für Patient:innen mit komplexeren angeborenen Herzfehlern in spezialisierten EMAH-Zentren, ist wünschenswert.
-
Eine direkte Kommunikation und Kooperation zwischen lokalen und spezialisierten tertiären Zentren mit gegenseitiger Akzeptanz fördern dabei die Entwicklung von spezifischem Fachwissen.
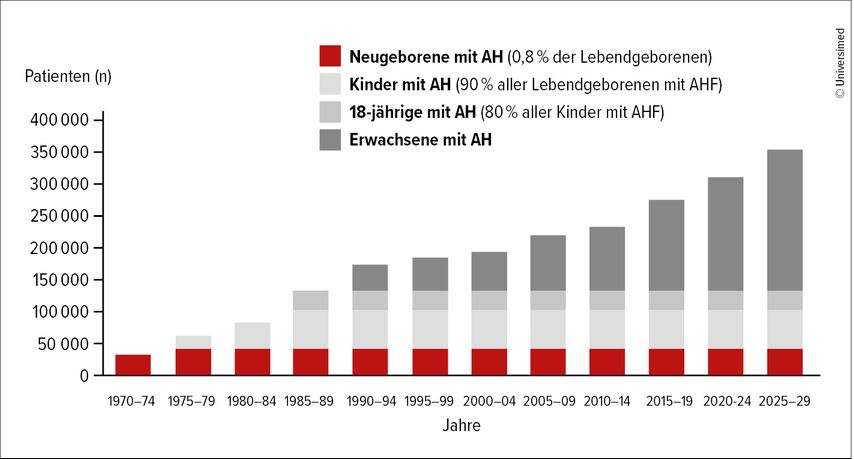
Die Epidemiologie der angeborenen Herzfehler hat sich gegenüber dem 20.Jahrhundert stark verändert. Aufgrund der hervorragenden chirurgischen Versorgung im Kindesalter und des medizinisch- technischen Fortschritts erreichen heutzutage >90% der Neugeborenen mit angeborenem Herzfehler (AH) das Erwachsenenalter. Für diese Patientenpopulation hat sich im deutschen Sprachraum der Begriff Erwachsene mit angeborenem Herzfehler (EMAH) etabliert. Die Prävalenz von EMAH-Patient:innen übersteigt bereits jetzt die der Kinder mit AH deutlich. In Deutschland sind 200000–350000 Patient:innen (Abb. 1) betroffen. Umgelegt auf Österreich sind das ca. 20000 bis 30000 Menschen, exakte Daten fehlen, da es kein nationales Register gibt. Circa 90% der Patient:innen mit leichten, 75% mit mittelschweren und 40% mit komplexen angeborenen Herzfehlern erreichen inzwischen ein Alter von >60 Jahren.1 Die größte relative Zunahme in der Population verzeichnet die Gruppe der >50-jährigen mit einer Verdoppelung im Zeitraum von 1990 bis 2017.2 Im Jahr 2030 werden ca. 11% der EMAH älter als 60 Jahre sein.3 Die Implementierung von EMAH-Programmen und die Ausbildung von Spezialisten haben jedoch weltweit mit dieser Entwicklung nicht Schritt gehalten.
Abb. 1: Zunahme des Anteils erwachsener Patient:innen mit angeborenen Herzfehlern in Deutschland (Quelle: Kompetenznetz Angeborene Herzfehler e.V., nationales Register für angeborene Herzfehler e.V.)
Angeborener Herzfehler: ein lebenslanger Begleiter
Inzwischen betrachtet man angeborene Herzfehler als einen lebenslangen chronischen Zustand („lifelong chronic condition“). Die Europäische Gesellschaft für Kardiologie (ESC) schlägt deshalb in ihren aktuellen Leitlinien ein abgestuftes EMAH-Versorgungskonzept vor: 1) Patient:innen, die ausschließlich in einem spezialisierten Zentrum von EMAH-Spezialist:innen betreut werden sollten, 2) Patient:innen, die von Kardiolog:innen für Erwachsene betreut werden können, 3) Patient:innen die von Internist:innen und Allgemeinmediziner:innen betreut werden können. Die Komplexität des AH ist hierbei ein wichtiges Einstufungskriterium und hängt auch von begleitenden Faktoren wie z.B. Lungenhochdruck, Restdefekten und Folgezuständen ab.4 Erwachsene mit AH haben bekanntermaßen ein gegenüber der Normalbevölkerung erhöhtes Risiko für Herzrhythmusstörungen, Endokarditis, pulmonale Hypertonie und Herzinsuffizienz.5 Die Inzidenz schwerwiegender unerwünschter kardiovaskulärer Ereignisse ist bei Patienten mit AH mit 18,2 Fällen pro 1000 Personenjahre 3,6-mal höher als bei Personen ohne AH.5
Kenntnis über EMAH-spezifische Komplikationen und Folgezustände
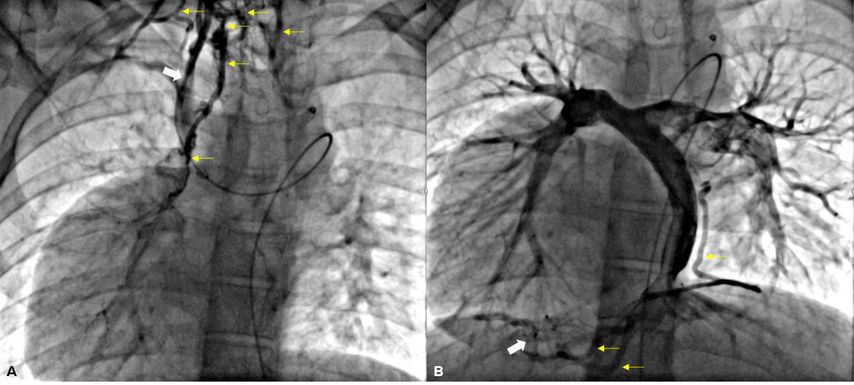
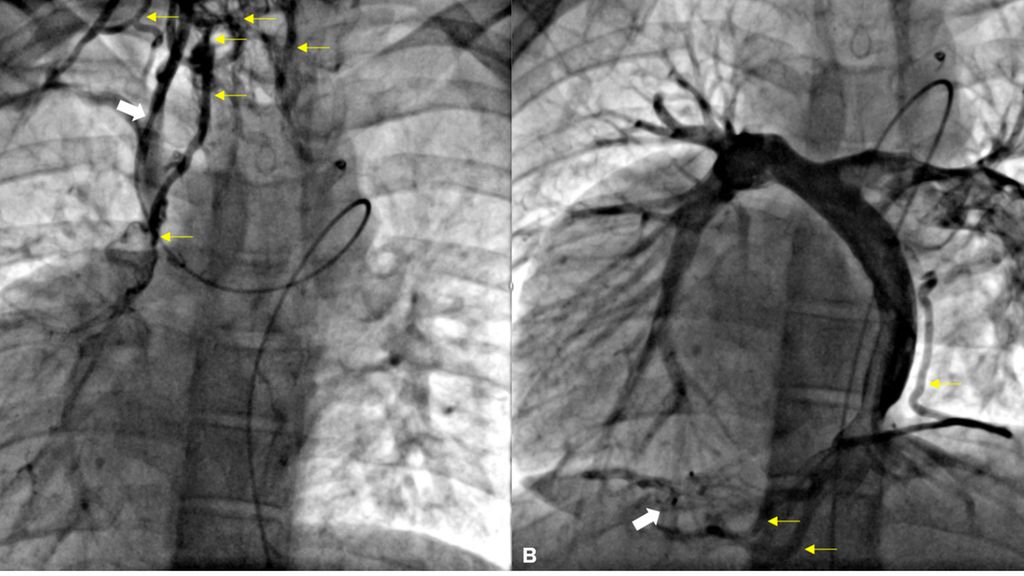
Die Betreuung von EMAH erfordert vor allem eine detaillierte Kenntnis der Anatomie des zugrundeliegenden Herzfehlers, der vorangegangenen Prozeduren und Eingriffe und ihrer Folgezustände, um die individuelle hämodynamische Situation exakt einschätzen zu können (Abb. 2). Ein hohes Maß an Antizipation und Vorausplanung ist deshalb essenziell für das Outcome bei medizinischen Interventionen – sei es medikamentös oder chirurgisch-interventionell. Das ist häufig sehr zeitaufwendig und Zeit ist ein limitierender Faktor im Gesundheitssystem. Oft präsentieren sich EMAH mit teils sehr charakteristischen altersspezifischen Diagnose- und Prozedur-bezogenen Folgezuständen und Komplikationen. Dazu gehören beispielsweise das Brady- bzw. Arrhythmiesyndrom nach Vorhofumlagerungsoperation, die Funktionsminderung des systemischen rechten Ventrikels in Kombination mit einer AV-Klappen-Insuffizienz, ein univentrikuläres Herz mit Fontan-assoziierter Leberfunktionsstörung, Fontanversagen, Eiweißverlust-Enteropathie. Rhythmusstörungen, insbesondere atriale Tachykardien (AT), tragen zu später Morbidität und Mortalität bei. Die veränderte Hämodynamik aufgrund der spezifischen Anatomie erfordert häufig ein rasches und zielgerichtetes Vorgehen, da auch supraventrikuläre Rhythmusstörungen nicht lange toleriert werden. Die Mehrzahl der Patient:innen mit AH hat eine Cavo-Trikuspidal(Mitral)-Isthmus/oder Inzisions-abhängige intraatriale „Reentry“-Tachykardie, die erfahrenen Spezialist:innen eine (empirische) Substratablation mit genau definierten Prozedurendpunkten ermöglicht, unabhängig von der Induzierbarkeit und der Komplexität des AH.6
Abb. 2: Venöse Angiografie bei 28-jährigem Patienten mit Heterotaxiesyndrom und zugrundeliegender Trikuspidalatresie Typ 1c, Dextrokardie; anterior-posteriore Projektion: A) Der Angiografiekatheter liegt in der Vena hemiazygos, die in die persistierende linke obere Hohlvene mündet. Über die (chirurgisch angelegte) linksseitige, obere cavopulmonale Anastomose erhält er Anschluss an die Pulmonalarterie und liegt mit der Spitze in der (chirurgisch angelegten) rechtsseitigen, oberen cavopulmonalen Anastomose (Pfeil). Es zeigen sich zahlreiche venovenöse Kollateralen (gelbe Pfeile in A und B). B) Der Angiografiekatheter liegt hier mit der Spitze im (chirurgisch angelegten) Tunnel, der die linksseitigen Lebervenen ebenfalls mit der Pulmonalarterie verbindet, die somit direkt in die Pulmonalarterie drainieren (Fontan-Kreislauf). Der Abfluss der rechtsseitigen Lebervenen in den Vorhof wurde zur Kreislauftrennung mittels Amplatzer-Occluder unterbunden (Pfeil). Die linke obere Hohlvene ist thrombotisch verschlossen
Komorbiditäten im Alter zunehmend
Die vorliegenden Studien zeigen bei EMAH-Patient:innen erhöhte Prävalenzen von arterieller Hypertonie (61%), Diabetes mellitus (22,9%) und chronischen Nierenerkrankungen (35,7%). Die alters- und geschlechtsstandardisierte Inzidenz des ischämischen Schlaganfalls ist bei EMAH-Patient:innen unter 55 Jahren im Vergleich zur Allgemeinbevölkerungum den Faktor 9 bis 12, die des hämorrhagischen Schlaganfalls um das 5 bis 6-Fache erhöht.7–9
Mehr „Awareness“ gefragt: Spezialisierte tertiäre EMAH-Versorgung verringert Mortalität
Publizierte Daten zeigen, dass eine spezialisierte tertiäre Versorgung die Gesamtmortalität bei EMAH verringert.10,11 Österreich ist in einer vergleichsweisen günstigen Situation mit derzeit vier etablierten EMAH-Zentren (Wien, Graz, Linz, Innsbruck), die teambasiert multidisziplinär mit Spezialist:innen der Kinderkardiologie, Erwachsenenkardiologie, Herzchirurgie, Kardioanästhesie, Gynäkologie und Geburtshilfe, Neonatologie und Intensivstationen agieren. Darüber hinaus gibt es mehrere Schwerpunktkrankenhäuser mit Kooperation zwischen Kinderkardiolog:innen mit EMAH–Expertise und Erwachsenenkardiolog:innen. In Österreich sind EMAH aufgrund der geografischen Gegebenheiten und der medizinischen Versorgungsstrukturen in aller Regel in strukturierten Nachsorgeprogrammen gut an die Zentren angebunden, sofern sie diese auch frequentieren. Aufgrund der relativen Zunahme der Zahl der EMAH–Patient:innen in der Allgemeinbevölkerung ist es dennoch wichtig, ein Bewusstsein für die Existenz und die spezifischen Bedürfnisse dieser Patientengruppe bei den Akteur:innen in den vorgeschalteten Strukturen zu schaffen.
Nachbesserungsbedarf bei Zusatzqualifikation
Deutschland und England sind gegenwärtig die einzigen Länder in Europa, in denen Kardiologie für EMAH als Zusatzqualifikation staatlich anerkannt ist und in denen überhaupt ein offiziell anerkanntes bzw. akkreditiertes Ausbildungsprogramm für spezialisierte AH–Kardiolog:innen existiert.12 Die Entwicklung von EMAH-Exzellenzzentren gilt dabei als wichtige Maßnahme zur Unterstützung einer qualitativ hochwertigen Versorgung von erwachsenen Patient:innen mit AH. Deutschland verfolgt dabei einen regionalisierten Ansatz mit 20 nationalen EMAH-Zentren für 83 Millionen Menschen. Die aktuellen Leitlinien besagen, dass alle EMAH-Patient:innen mindestens einmal eine spezialisierte Kardiologin/einen spezialisierten Kardiologen aufsuchen müssen und ein Großteil der Patient:innen eine regelmäßige Nachsorge und Behandlung durch entsprechend ausgebildete EMAH-Spezialist:innen benötigt.4 Aktuelle Daten aus Deutschland zeigen aber auch, dass eine strukturierte und formal akkreditierte hochwertige EMAH-Schulung nicht per se die Qualität der Versorgung verbessert. In Deutschland erhalten trotz zertifizierter EMAH-Anerkennung und spezialisierter Zentren nur etwa 50% der EMAH–Patient:innen eine angemessene kardiologische Versorgung.13
Fazit
Die Betreuung von EMAH mit einer gewissen Komplexität erfordert ein hohes Maß an Antizipation der behandelnden Ärzt:innen. Die Kooperation zwischen lokalen und spezialisierten tertiären Zentren mit dem dafür notwendigen Fachwissen stellt in der gegenwärtigen Situation in Österreich einen pragmatischen Weg für die qualitätsvolle medizinische Versorgung von EMAH-Patient:innen dar.
Literatur:
1 van der Bom T et al.: Contemporary survival of adults with congenital heart disease. Heart 2015; 101(24): 1989-95 2 GBD 2017 Congenital Heart Disease Collaborators: Global, regional, and national burden of congenital heart disease, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Child Adolesc Health 2020; 4(3): 185-200 3 Tutarel O et al.: Congenital heart disease beyond the age of 60: emergence of a new population with high resource utilization, high morbidity, and high mortality. Eur Heart J 2014; 35(11): 725-32 4 Baumgartner H et al.: 2020 ESC guidelines for the management of adult congenital heart disease. Eur Heart J 2021; 42(6): 563-645 5 Liu A et al.: Changing epidemiology of congenital heart disease: effect on outcomes and quality of care in adults. Nat Rev Cardiol 2023; 20(2): 126-37 6 Brouwer C et al.: Contemporary patients with congenital heart disease: uniform atrial tachycardia substrates allow for clear ablation endpoints with improved long-term outcome. Circ Arrhythm Electrophysiol 2021; 14(9): e009695 7 Lanz J et al.: Stroke in adults with congenital heart disease: incidence, cumulative risk, and predictors. Circulation 2015; 132(25): 2385-94 8 Kwiatek-Wrzosek A et al.: The burden of cardiovascular risk factors among seniors with congenital heart disease: a single tertiary center experience. Kardiol Pol 2021; 79(11): 1251-5 9 Goldstein SA et al.: Causes of death and cardiovascular comorbidities in adults with congenital heart disease. J Am Heart Assoc 2020; 9(14): e016400 10 Mylotte D et al.: Specialized adult congenital heart disease care: the impact of policy on mortality. Circulation 2014; 129(18): 1804-12 11 Cordina R et al.: Management errors in adults with congenital heart disease: prevalence, sources, and consequences. Eur Heart J 2018; 39(12): 982-9 12 McMahon CJ et al.: Adult congenital heart disease training in Europe: current status, disparities and potential solutions. Open Heart 2023; 10(2):e002558 13 Diller GP et al.: Lack of specialist care is associated with increased morbidity and mortality in adult congenital heart disease: a population-based study. Eur Heart J 2021; 42(41): 4241-8
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Funktionsstörung des Myokards: wenn die Entspannung des Herzens gestört ist
Die hypertropheobstruktive Kardiomyopathie (HOCM) ist dadurch charakterisiert, dass die Entspannung des Myokards funktionsgestört ist. Die Folge ist eine zunehmende Verdickung der ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...