VHF-Detektionsrate mit „Wearables“
Autorin:
Univ.-Prof. Dr. Marianne Gwechenberger
Universitätsklinik für Innere Medizin II
Klinische Abteilung für Kardiologie
Medizinische Universität Wien
Der technologische Fortschritt und die zunehmende Beliebtheit von „Wearables“, wie Smartwatches, führen vermehrt zu Diskussionen über den Stellenwert dieser Devices in der Detektionsrate betreffend Vorhofflimmern. Wie geeignet sind „Wearables“, um asymptomatisches paroxysmales Vorhofflimmern aufzudecken?
Keypoints
-
EHRA und DGK haben ein Posititionspapier zur aktuellen Datenlage von „Wearables“ bereitgestellt.
-
Besonders in der Covid-19-Pandemie hat die Beliebtheit der „Wearables“ zur Detektion von Arrhythmien zugenommen.
-
Die diagnostische Genauigkeit hängt vom verwendeten Algorithmus ab.
-
Die Sensitivität und Spezifität zur Detektion von „Wearables“ konnten in Studien bestätigt werden.
-
Daten zum Einfluss auf harte Endpunkte (Schlaganfallrate, Mortalität) fehlen noch.
Vorhofflimmern ist die häufigste Rhythmusstörung und mit einer erhöhten Morbidität und Mortalität verbunden. Es ist assoziiert mit Schlaganfall, Demenz, Herzinsuffizienz, thromboembolischen Ereignissen, Depression und Mortalität. Rund ein Drittel der Patienten ist asymptomatisch. Während symptomatische Patienten rasch medizinische Betreuung erhalten, präsentieren sich asymptomatische Patienten oft erst nach dem Auftreten schwerer Komplikationen, wie z.B. eines Schlaganfalls oder einer Herzinsuffizienz. Eine frühzeitige Detektion, mit der Möglichkeit einer frühzeitigen Intervention, kann dabei helfen, Komplikationen zu vermeiden bzw. zu reduzieren. Ein 12-Kanal-Ableitungs-EKG, mehrere Langzeit-EKGs über einen oder mehrere Tage sowie sogenannte „Eventrecorder“ zur Detektion und Überwachung von VHF stellen den Goldstandard dar, sind allerdings nicht immer verfügbar, und bei kurzen paroxysmalen VHF-Episoden kann es schwierig sein, diese zu dokumentieren. Der diagnostische Erfolg ist abhängig von der Dauer des Monitorings. Kardiale implantierbare elektronische Devices ermöglichen eine kontinuierliche Aufzeichnung, sollen hier aber nicht im Fokus stehen. „Wearables“ bieten eine neue Möglichkeit der Arrhythmiedetektion.
Leitlinienverankerung von „Wearables“
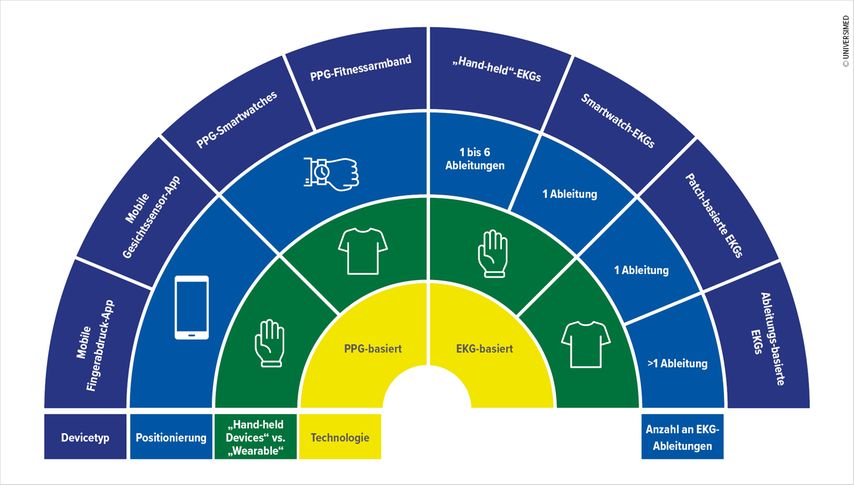
Sowohl die European Heart Rhythm Association (EHRA) als auch die Deutsche Gesellschaft für Kardiologie (DGK) haben ein Positionspapier zur aktuellen Datenlage für den Einsatz der „Wearables“ zur Detektion von Arrhythmien veröffentlicht.1,2 Prinzipiell gibt es Geräte, die bei Symptomen in der Hand gehalten („Hand-held Devices“) oder aber direkt am Körper („Wearables“ im engeren Sinn) getragen werden, was eine kontinuierlichere Aufzeichnung erlaubt.1,2 Sie ermöglichen die Detektion von Arrhythmien, aber auch aktives und passives Screening von Vorhofflimmern.1 Von den derzeit klinisch verfügbaren Geräten sind Smartwatches und Armbänder die am meisten verwendeten. Fingerringe und in der Kleidung angebrachte Devices sind sehr selten. Aufgeklebte Patches werden hingegen nur von 16% verwendet. Der Markt bietet eine Vielzahl an „Wearables“, die von jedem gekauft werden können (Abb. 1). Einige sind als Medizinprodukte zertifiziert, während viele nicht als solche lizensiert sind und als Lifestyleprodukte gelten.
Technologie und Funktion
Die „Wearables“ und „Hand-held Devices“ verwenden im Wesentlichen zwei unterschiedliche Technologien (Photoplethysmografie (PPG) und/oder EKG). Die Anwendung dieser Geräte zur Detektion von Arrhythmien hat insbesondere durch die Covid-19-Pandemie in den letzten Jahren explosionsartig zugenommen. Unabhängig davon, welche Methode verwendet wird, braucht es immer die Überprüfung durch einen Arzt.1,2
Die EKG-basierte Arrhythmiedetektion mittels „Wearables“ nutzt die Ableitung elektrischer Signale, um ein 1- oder Mehrkanal-EKG abzuleiten.1
Zu den EKG-basierten digitalen Geräten zählen die „Hand-held Devices“, EKG-Patches und Smartwatches. Erstere können eine oder mehrere EKG-Ableitungen aufnehmen. Die diagnostische Genauigkeit hängt vom verwendeten Algorithmus ab.2Die EKG-Patches sind leicht anzuwendende Klebeelektroden mit einer hohen Patientenakzeptanz. Sie haben eine höhere Detektionsrate als konventionelle Holter-EKGs und eine vergleichbare Detektionsrate nach zwei Wochen und einem Monat wie implantierbare „Loop Recorder“. Einige der Smartwatches können ein 30-sekündiges EKG aufzeichen.1,2
Die PPG kann mittels einer optischen Technik, die den peripheren Puls analysiert, Herzfrequenz und Arrhythmien monitieren.Sie basiert technisch auf der Absorption von Infrarotstrahlung durch Hämoglobin. Das Blutvolumen der Hautgefäße variiert zwischen Systole und Diastole. Dies führt zu Veränderungen der Lichtabsorption der Haut. In PPG-Geräten illuminiert eine Lichtquelle die Haut und eine Kamera detektiert die pulssynchronen Änderungen der Lichtabsorption, generiert eine periphere Pulswelle und leitet daraus die Herzfrequenz ab. Durch spezielle Algorithmen werden Arrhythmien detektiert. Zur Diagnosesicherung wird gemäß den Leitlinien eine EKG-Dokumentation gefordert.
Studienlage der PPG
Zahlreiche Studien haben sich mit der Detektion des Vorhofflimmerns mittels PPG beschäftigt. Dabei fand sich eine gute Übereinstimmung hinsichtlich Sensitivität und Spezifität mit dem konventionellen EKG. Eine rezente Studie hat die Performance von Smartwatches, die alle ein 1-Kanal-EKG aufzeichnen, und dem „Alive Kardiomobile“ („Hand-held Device“) untersucht. Diese zeigte eine relativ hohe Anzahl an nicht verwertbaren EKGs (zwischen 17 und 26%), je nachdem, welches „Wearable“ untersucht wurde.3 Wenn man diese Messungen in eine „Intention to diagnose“-Analyse mit einbezieht, sinken die Sensitivität und Spezifität dramatisch.
VHF-Detektionsrate in Konsumentenstudien
Die Detektionsrate von VHF ist vom untersuchten Kollektiv abhängig. Es liegen drei große Anwender- oder Konsumentenstudien vor, d.h., es wurden Menschen rekrutiert, die bereits ein Gerät erworben haben. In der AppleHeartStudy verwendete man einen PPG-Sensor an der Rückseite der Apple Watch. Es wurden mehr als 419000 Patienten inkludiert, mit einem mittleren Alter von 41 Jahren. Dabei wurde eine Prävalenz von VHF-verdächtigen PPG-Aufzeichnungen in 0,52% gefunden. Diese Personen wurden zu einer weiteren Abklärung eingeladen. Bei Konsumenten, bei denen der Herzrhythmus gleichzeitig von der Apple Watch und einem EKG-Monitor aufgezeichnet wurde, betrug der positive prädiktive Wert 84%. Allerdings nahm nur ein sehr geringer Anteil der Personen mit verdächtigen PPG-Aufzeichnungen die empfohlene weiterführende Diagnostik in Anspruch. Darüber hinaus war das Probandenkollektiv sehr jung und Patienten >65 Jahre waren deutlich unterrepräsentiert.4 Die MAFA-II-Studie zeigt ähnliche Resultate.5
In der Fitbit-Studie wurden 455000 Freiwillige rekrutiert. Die Smartwatch von Fitbit arbeitet ebenfalls mit PPG, verwendet jedoch einen neuen Algorithmus. Die Aufzeichnung funktioniert nur in Ruhe und benötigt 30 Minuten, mit dem Ziel, Fehlalarme zu verhindern. Bei rund 1% der Teilnehmer wurde der V.a. VHF gestellt. Auch in dieser Studie nahm nur die Minderheit der Patienten eine weitere Abklärung in Anspruch, sodass letztendlich bei diesen 32% im EKG tatsächlich ein VHF diagnostiziert wurde.6
Diese drei Konsumentenstudien wurden bei einem relativ jungen Kollektiv durchgeführt, dadurch war die Detektionsrate insgesamt gering.
In der „Smart in OAC“-AFNet-Studie wurden Patienten >65 Jahre (mittleres Alter 71+5 Jahre) eingeschlossen. Primär wurde in der Studie das Auftreten von Vorhofrhythmusstörungenuntersucht, definiert als Episoden mit völlig unregelmäßigem PPG-Signal mit einer Dauer von mindestens sechs Minuten. Atriale Arrhythmien wurden bei 5% innerhalb von 4 Wochen bzw. bei 6% innerhalb von 8 Wochen mittels „Wearables“ gefunden.7 Damit konnte gezeigt werden, dass sich auf Alltagselektronik basierende Diagnostik auch für ältere Patienten eignet.
Derzeit ist es noch unklar, ob dieses Konsumenten-basierte VHF-Screening die Schlaganfallrate oder die Mortalität reduziert. Es könnte aber die frühe Diagnose von VHF erleichtern.
Wer soll gescreent werden?
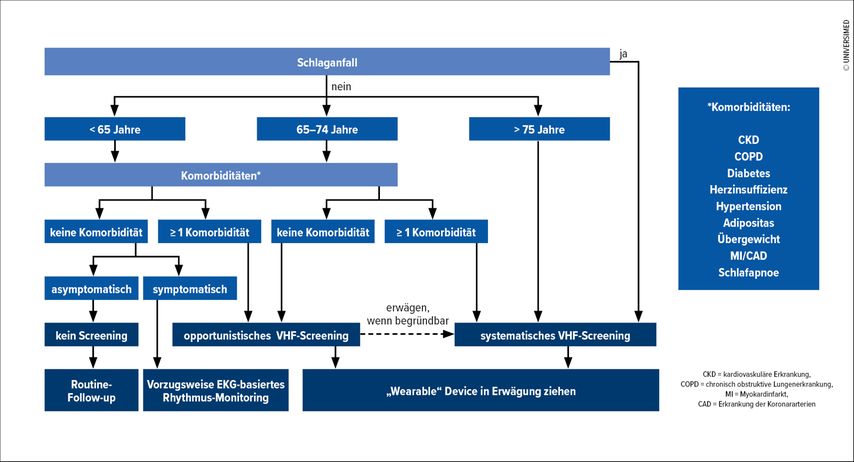
Man unterscheidet opportunistisches von systematischem Screening. Das Screening kann in unterschiedlichen Kollektiven wie z.B. der Gesamtbevölkerung oder aber in definierten Risikogruppen durchgeführt werden. Im Leitfaden der EHRA wird von einem pauschalen Screening abgeraten (Abb. 2).1 Auch in der VHF-Leitlinie der European Society of Cardiology (ESC) wird ein opportunistisches Screening bei über 65-Jährigen mit Klasse I, Level B empfohlen. Bei Patienten über 75 oder mit einem hohen Risiko für einen Schlaganfall soll ein systematisches Screening durchgeführt werden (Klasse IIa, Level B). Natürlich wird bei einem opportunistischen Screening die Detektionsrate eher gering sein, dafür werden aber Patienten mit einem hohen Schlaganfallrisiko identifiziert. Bei Konsumentenscreenings mit viel häufigerer Testung steigt die Detektionsrate hingegen, aber das Schlaganfallrisiko ist geringer.
Derzeit sind die klinische Bedeutung und Konsequenz von im Screening detektierten, asymptomatischen VHF nicht ganz klar. Während in der STROKESTOP-Studieein kleiner Benefit hinsichtlich des kombinierten Endpunktes von Mortalität, Schlaganfall und schwerer Blutung zu sehen war, verlief die LOOP-Studie negativ.8,9Es wurde zwar dreimal so häufig Vorhofflimmern detektiert und entsprechend häufiger eine Therapie mitoralen Antikoagulanzien (OAK) eingeleitet, jedoch fand sich kein signifikanter Unterschied hinsichtlich der primären Endpunkte Schlaganfall und systemische Embolie. Die Autoren stellen die Frage, ob jedes Vorhofflimmern OAK bedarf. Auch ab welcher Dauer des Vorhofflimmerns eine orale Antikoagulation erfolgen soll, ist nur schlecht untersucht. Zwei randomisierte Studien wurden rezent durchgeführt, bei denen Patienten mit einer atrialen Hochfrequenzepisode (>6min Dauer) im Speicher von implantierbaren kardialen Devices in OAK-Therapie und keine OAK-Therapie randomisiert wurden. Die Ergebnisse sind zwar noch ausständig, allerdings wurde eine Studie (NOAH AF) vorzeitig beendet. Derzeit ist noch nicht bekannt, ob vermehrte Blutungen zum Studienabbruch geführt haben.
Wenn VHF diagnostiziert wird, sollten das von den Leitlinien vorgegebene integrierte Management und das ABC-Schema angewendet werden. Dies schließt angemessene Antikoagulation, Symptomkontrolle, Frequenz- oder Rhythmusmanagement und Risikofaktorenmodifikation,um Komplikationen zu vermeiden, mit ein.
Zusammenfassung
Die Anwendung von „Wearables“ und „Hand-held Devices“ hat stark zugenommen. Während die Sensitivität und Spezifität der Detektion von VHF in mehreren Studien bestätigt werden konnten, fehlen Daten hinsichtlich harter Endpunkte, wie Tod oder Schlaganfall. Weitere diesbezügliche Studien sind erforderlich.
Literatur:
1 Veltmann C et al.: Wearable-basierte Detektion von Arrhythmien. Positionspapier der Deutschen Gesellschaft für Kardiologie. Kardiologe 2021; 15: 341-53 2 Svennberg E: How to use digital devices to detect and manage arrhythmias: An EHRA practical guide. Europace 2022; 24: 979-1005 3 Mannhart D et al.: Clinical validation of 5 direct-to-consumer wearable smart devices to detect atrial fibrillation: BASEL wearable study. JACC Clin Electrophysiol 2023; 9(2): 232-42 4 Guo Y et al.: Mobile photoplethysmographictechnology to detect atrial fibrillation. J Am Coll Cardiol 2019; 74: 2365-75 5 Perez MV et al.: Large-scale assessment of a smartwatch to identify atrial fibrillation. N Engl J Med 2019; 381: 1909-17 6 Lubitz SA et al.: Detection of atrial fibrillation in a large population using wearable devices: The Fitbit heart study. Circulation 2022; 146(19): 1415-24 7 Fabritz L et al.: Wearable-based detection of atrial arrhythmias in older adults. The fully digital European Smart in OAC – AFNET 9 case finding study. Eur Heart J Digital Health 2022; 3(4): 610-25 8 Svennberg E et al.: Clinical outcome in systematic screenin for atrial fibrillation (STROKESTOP): A multicenter, parallel group, unmasked, randomised controll trial. Lancet 2021; 398: 1498-506 9 Svedsen JH et al.: Implantable loop recorder detection of atrial fibrillation to prevent stroke (the LOOP Study): A randomized trial. Lancet 2021; 398(10310): 1507-16
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Neue Wege in der Diagnostik des Vorhofflimmerns
Vorhofflimmern ist die häufigste Rhythmusstörung unserer Zeit. Die Folgen reichen von eingeschränkter Lebensqualität und Belastbarkeit bis zu schwerwiegenden Komplikationen wie ...