Update Vorhofflimmern – das Wichtigste der neuen ESC-Guidelines
Autoren:
Univ.-Prof. Dr. Daniel Scherr
Dr. Ursula Rohrer
Dr. Martin Manninger-Wünscher, PhD
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin
Medizinische Universität Graz
E-Mail: daniel.scherr@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die neuen ESC-Guidelines zum Vorhofflimmern (VHF/VHFA) haben zahlreiche Neuerungen in der Diagnostik und Therapie dieser Patienten gebracht. Die wichtigsten Punkte der Guidelines sollen im Folgenden praxisnah diskutiert werden.
Keypoints
-
Die drei Therapieprinzipien bei Vorhofflimmern: „A“ – Antikoagulation; „B“ – bessere Symptomkontrolle (also Frequenz- oder Rhythmuskontrolle); „C“ – cardiovaskuläre Risikofaktoren managen
-
Die Entscheidung zwischen Rhythmus- und Frequenzkontrolle hängt vor allem ab von Symptomen, Patienten-spezifischen Risikofaktoren, Dauer des Vorhofflimmerns.
-
Im Rahmen der Rhythmuskontrolle wird der Stellenwert der Ablation betont.
CC-ABC – Grundprinzipien der VHF-Therapie
Die Prävalenz des Vorhofflimmerns, der häufigsten anhaltenden Herzrhythmusstörung, liegt derzeit in den westlichen Industrienationen bei 1,5–2%. In Österreich leiden schätzungsweise 150000 bis 200000 Patienten an VHF. Patienten mit VHF haben im Vergleich zur Durchschnittsbevölkerung ein fünffach erhöhtes Schlaganfallrisiko, eine erhöhte Hospitalisierungsrate, eine zwei- bis dreifach erhöhte Mortalitätsrate und eine eingeschränkte Lebensqualität. Das lebenslange Risiko für einen 55-jährigen Menschen, im Laufe seines weiteren Lebens Vorhofflimmern zu entwickeln, liegt bei 33%. Aufgrund der hohen Prävalenz von VHF bei älteren Patienten ergibt sich die Empfehlung zum opportunistischen Screening von VHF bei Patienten >65 Jahre und möglicherweise zum systematischen Screening bei Patienten >75 Jahre.
Die aktuell publizierten Guidelines der ESC zur Diagnostik und Therapie von VHF1 stellen „CC“ ins Zentrum der Diagnostik und „ABC“ in das der Therapie (Abb. 1). Bei „CC“ steht das erste „C“ für „confirm AF“, also VHF diagnostizieren. Dazu genügt die Aufzeichnung von VHF in einem 12-Kanal-EKG oder in einem Rhythmusstreifen ≥30sec, welche aber für die Diagnose von VHF essenziell sind. Die Diagnose kann somit auch mit jenen „wearables“ gestellt werden, die ein EKG über 30sec mit eindeutiger Ableitung der Vorhofaktivität darstellen können.
Bei Patienten nach kryptogenem Insult sollte ein Loop Recorder zur Detektion von okkultem VHF implantiert werden (IIa-Empfehlung). Bei Schrittmacher-Patienten mit atrialen Hochfrequenzkontrollen im Device-Speicher ist ein weiteres EKG-Monitoring zur Detektion von VHF erforderlich.
Das zweite „C“ steht für „characterise AF“. Dazu sollen Symptome und Krankheitsschwere von VHF nach dem 4S-Schema charakterisiert werden. Die Einschätzung des Schlaganfallrisikos erfolgt mit dem CHA2DS2-VASc-Score, die Symptomintensität mit dem EHRA-Score, die Art des VHF bzw. die VHF-Dauer, die Komorbiditäten und der Echobefund führen zu einer exakten Einschätzung des VHF.
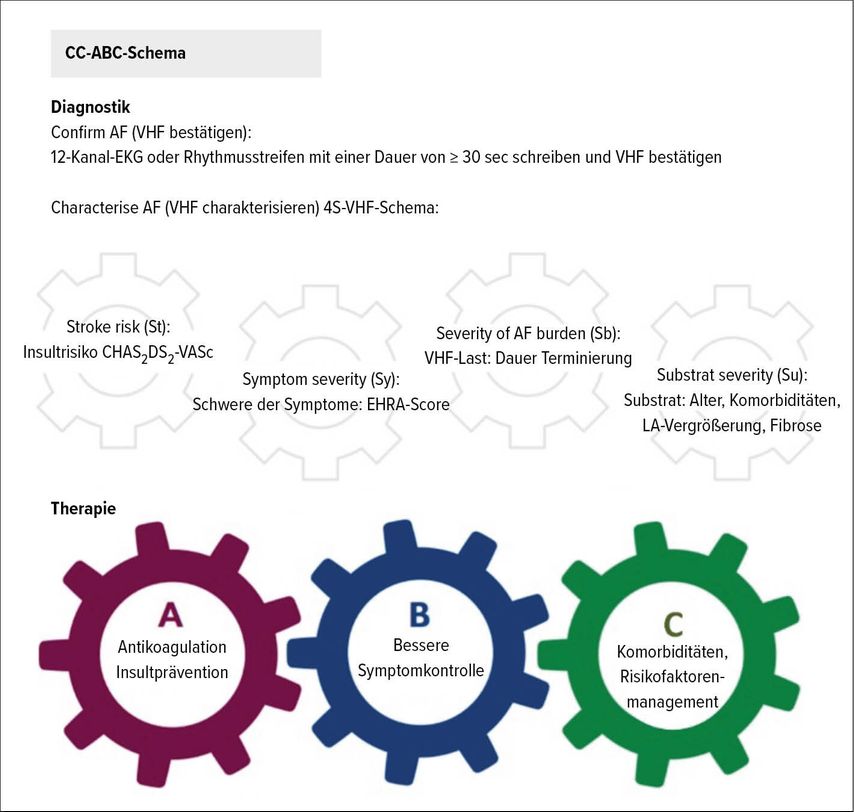
Abb. 1: CC-ABC-Schema der ESC-Guidelines zur Diagnostik und Therapie von Vorhofflimmern
„A“ – Antikoagulation
An der zentralen Rolle der oralen Antikoagulation (OAK) hat sich nichts geändert (Abb. 2):
Jeder Patient mit VHF muss hinsichtlich der Notwendigkeit einer OAK untersucht werden. Patienten mit einer mechanischen Herzklappe oder einer relevanten Mitralstenose sollen einen Vitamin-K-Antagonisten (VKA) bekommen. Alle anderen Patienten sollen mit dem CHA2DS2-VASc-Score evaluiert werden, und nur Patienten gänzlich ohne Risikofaktoren bekommen keine OAK. Alle anderen Patienten sollen (IIa-Empfehlung bei CHA2DS2-VASc 1 bei Männern oder CHA2DS2-VASc 2 bei Frauen, Klasse-I-Empfehlung bei höheren CHA2DS2-VASc-Scores) antikoaguliert werden, und zwar präferenziell mit einem NOAK. Modifizierbare Risikofaktoren sind stetig zu berücksichtigen. Bei Hochrisikosituation wie z.B. nach Hirnblutung kann der Vorhofohr-Verschluss eine Therapiealternative darstellen (IIb-Empfehlung).
Wenig geändert hat sich bei der OAK während/nach Kardioversion von VHF: Nach wie vor ist eine Kardioversion möglich, wenn
der Patient mindestens 3 Wochen durchgehend antikoaguliert war,
alternativ eine transösophageale Echokardiografie zum Thrombenausschluss durchgeführt wurde oder
ohne zumindest eine der beiden vorher genannten Maßnahmen nur wenn der Patient nachweislich <48h im VHF war.
Parallel mit der Kardioversion ist mit einer OAK zu beginnen. Bei Patienten mit CHA2DS2-VASc 1 (bei Männern) oder CHA2DS2-VASc 2 (bei Frauen) ist die OAK lebenslang fortzuführen, bei Patienten ohne Risikofaktoren für 4 Wochen nach Kardioversion. Bei Patienten ohne Risikofaktoren (CHA2DS2-VASc 0 bei Männern oder CHA2DS2-VASc 1 bei Frauen) und einer VHF-Dauer <24h kann auf eine OAK gänzlich verzichtet werden.
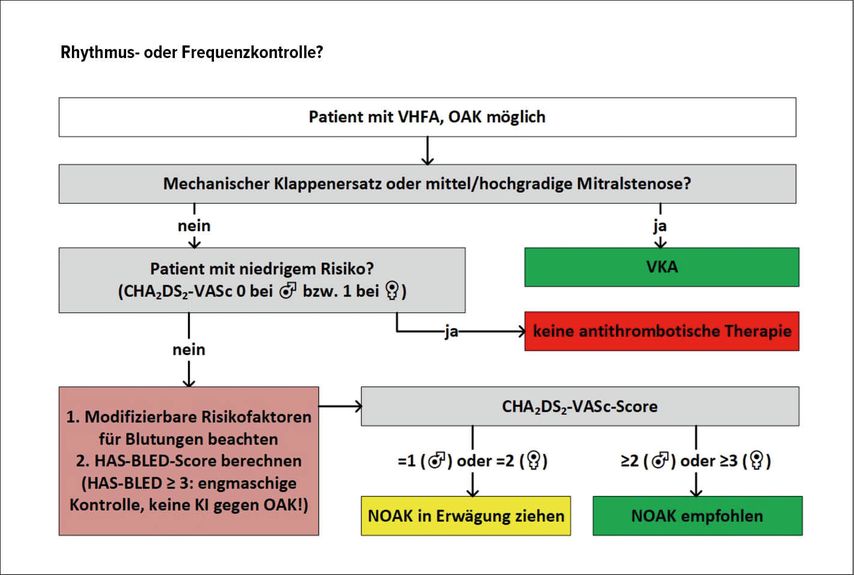
Abb. 2:Nach wie vor muss jeder Patient mit VHF hinsichtlich der Notwendigkeit einer OAK evaluiert werden
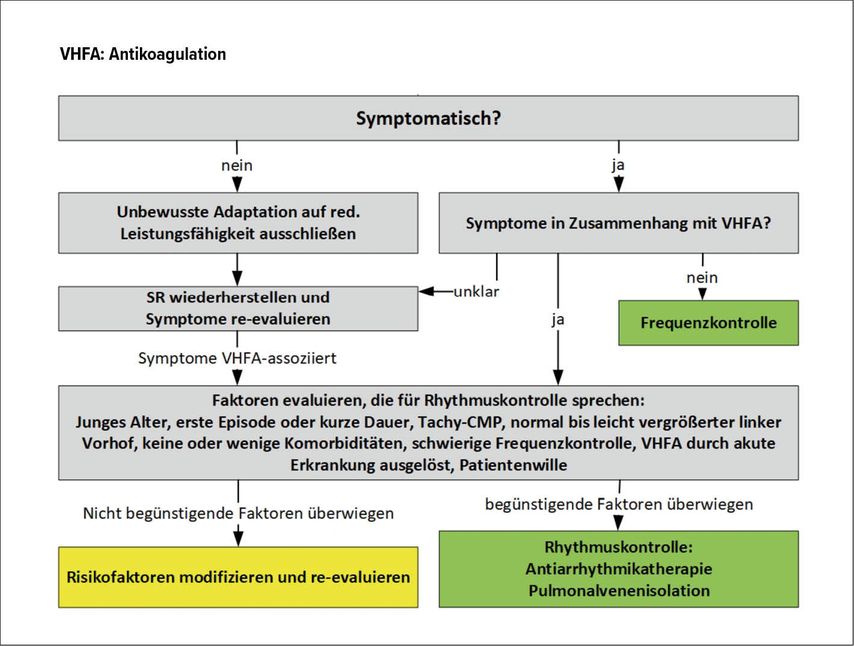
Abb. 3:Bei symptomatischen VHF-Patienten sollte entschieden werden, ob der Sinusrhythmus angestrebt wird (Rhythmuskontrolle) oder der Patient im VHF verbleibt (Frequenzkontrolle)
„B“ – bessere Symptomkontrolle
Die Evaluierung jedes Patienten mit VHF hinsichtlich dieser entscheidenden Frage ist in Abbildung 3 dargestellt.
Am Beginn steht die Frage nach den Symptomen und deren Zusammenhang mit dem VHF. Liegen gar keine oder nur wenige VHF-assoziierte Symptome vor, so ist der Frequenzkontrolle der Vorzug zu geben. Eine Ausnahme stellen Patienten in einem sehr frühen Stadium der Erkrankung dar (Zeitraum seit VHF-Erstdiagnose <1 Jahr). Ist man sich des Zusammenhangs der vorliegenden Symptome mit dem VHF nicht sicher, so kann man den Patienten in den Sinusrhythmus kardiovertieren und die Situation neu beurteilen.
Bei symptomatischen VHF-Patienten sollte anhand der in Abbildung 3 aufgelisteten Faktoren entschieden werden, ob der Sinusrhythmus angestrebt wird (Rhythmuskontrolle) oder der Patient im VHF verbleibt (Frequenzkontrolle). Bei keinem Patienten werden alle Faktoren für die eine oder die andere Therapieform sprechen, aber in Summe aller Faktoren kommen Arzt und Patient zu einer klinischen Entscheidung. Besonders bedeutend sind die Faktoren der VHF-Dauer <1 Jahr sowie das Vorliegen einer Tachymyopathie. Bei beiden Patientengruppen ist durch Rhythmuskontrolle potenziell eine Verringerung der Mortalitätsrate erzielbar, neben einer Verbesserung der Symptome.
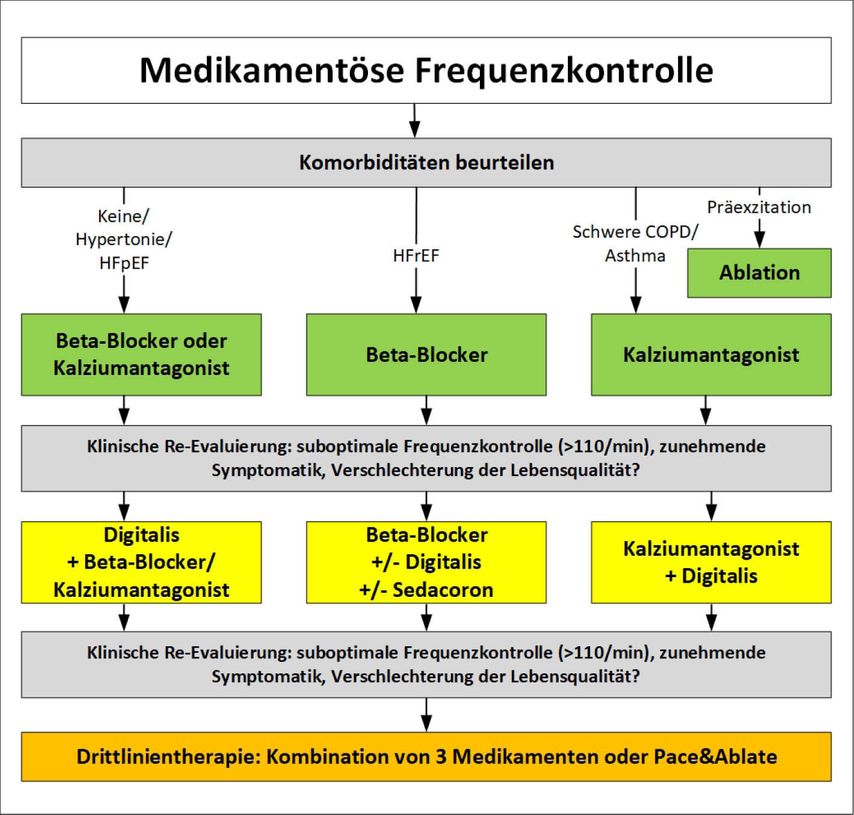
Abb. 4: Die Stufentherapie, wenn eine Frequenzkontrolle angestrebt wird
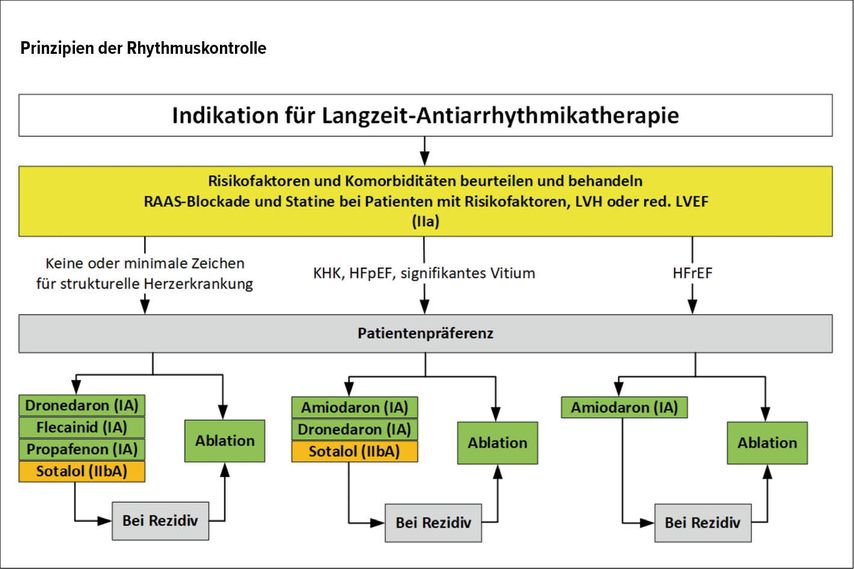
Abb. 5:Medikamentös-antiarrhythmische Therapie zur symptomatischen Therapie
Grundprinzipien der Frequenzkontrolle
Diese sind in Abbildung 3 dargestellt. Die Frequenzkontrolle stellt bei allen Patienten eine Hintergrundtherapie dar. Sie sollte bei asymptomatischen Patienten wie auch bei jenen mit gescheiterter Rhythmuskontrolle oder im Falle eines zu hohen Risikos einer Rhythmuskontrolle forciert werden. Liegen trotz einer ausreichenden Herzfrequenzkontrolle weiter VHF-assoziierte Symptome oder eine weitere Verschlechterung der LV-Funktion oder keine ausreichende biventrikuläre Stimulation bei CRT-Patienten vor, so soll die Herzfrequenz noch weiter und aggressiver medikamentös gesenkt werden. Tests wie ein Holter-EKG zur Detektion von Pausen oder die Ergometrie zur Beurteilung des Frequenzprofils bei Belastung sind praxisrelevante Verfahren.
Medikamentöse Frequenzkontrolle – wie?
Bei der Mehrzahl aller Patienten wird der Frequenzkontrolle der Vorzug gegeben werden. Die Stufentherapie im Rahmen der Frequenzkontrolle ist in Abbildung 4 dargestellt. Ziel ist eine mittlere Herzfrequenz von 80–110/min. Abgesehen von den selteneren bradykarden, potenziell Herzschrittmacher-pflichtigen VHF-Patienten benötigen die meisten VHF-Patienten eine medikamentöse Frequenzkontrolle. Die First-Line-Therapie sollte auch aus einem Betablocker oder einem Kalziumantagonisten bestehen. Rezente Studiendaten zeigen, dass gerade bei älteren Patienten Digitalis als First-Line-Therapie sinnvoll sein kann, auch wenn das noch nicht Eingang in die ESC-Guildelines gefunden hat. In diesen ist Digitalis eine etablierte Second-Line-Therapie. Sollte sich trotz dieser Kombinationstherapie keine zufriedenstellende Frequenzkontrolle einstellen, so sind „pace and ablate“ (Schrittmacherimplantation und Ablation des AV-Knotens) und in Ausnahmefällen Amiodaron als Drittlinientherapie weitere Optionen. Ziel sind die Symptomfreiheit des Patienten und die Frequenzregularisierung auf 80–110/min. In seltenen Fällen, bei nicht erreichter Frequenzkontrolle, sollte das Gesamtkonzept nochmals evaluiert werden und in Einzelfällen doch eine Rhythmuskontrolle versucht werden (abhängig von Komorbiditäten und Risikofaktoren).
Prinzipien der Rhythmuskontrolle
Bei Patienten, bei denen die Rhythmuskontrolle, also die Wiederherstellung und/oder Erhalt des Sinusrhythmus, angestrebt wird, sind jedenfalls Risikofaktoren und v.a. kardiovaskuläre Risikofaktoren zu behandeln, um den Erhalt des Sinusrhythmus nachweislich zu unterstützen. Bei allen Patienten besteht im Rahmen der Langzeit-Rhythmuskontrolle prinzipiell die Möglichkeit einer medikamentösen Therapie oder einer Katheterablation.
Die medikamentös-antiarrhythmische Therapie, allein zur symptomatischen Therapie indiziert, sollte in Abhängigkeit der kardialen Grunderkrankung gewählt werden (Abb. 5). Aufgrund der bescheidenen Langzeiterfolge der Antiarrhythmika mit Langzeitraten an Sinusrhythmus von 30–40% sind Antiarrhythmika primär nach Sicherheitserwägungen zu wählen. Bei Patienten ohne kardiale Erkrankungen stehen Klasse-I-Antiarrhythmika (Propafenon, Flecainid) oder Klasse-III-Antiarrhythmika (Dronedaron) zur Verfügung. Sotalol wurde aufgrund potenziell proarrhythmischer Nebenwirkung auf eine Klasse-IIb-Empfehlung eingeschränkt. Bei Patienten mit schweren kardialen Erkrankungen wie einer systolischen Herzinsuffizienz steht als Antiarrhythmikum einzig Amiodaron zur Verfügung.
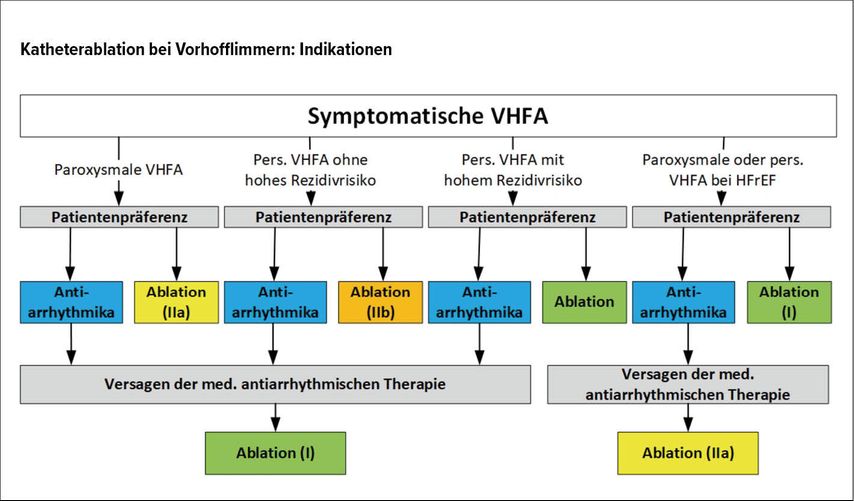
Abb. 6:Die Katheterablation ist nun eine etablierte First-Line-Therapie bei Patienten mit symptomatisch-paroxysmalem VHF, speziell bei geringen kardiovaskulären Komorbiditäten
Stellenwert der Katheterablation
Abbildung 6 zeigt die gestiegene Bedeutung der Katheterablation zur Behandlung von Vorhofflimmern, die sich aufgrund vieler positiver Studiendaten zur symptomatischen Wirkung und bei ausgewählten Patientengruppen auch zur Reduktion der Mortalitätsrate ergeben hat. Die Katheterablation ist mittlerweile eine etablierte First-Line-Therapie bei Patienten mit symptomatisch-paroxysmalem VHF, speziell bei geringen kardiovaskulären Komorbiditäten (Klasse-IIa-Empfehlung). Diese Empfehlung ergibt sich u.a. aus der mittlerweile in vielen Studien gezeigten Erfolgsrate von 80% bei diesen Patienten. Die Guidelines sind eindeutig zurückhaltender mit der Katheterablation als First-Line-Therapie bei Patienten mit persistierendem VHF (Klasse-IIb-Empfehlung).
Bei Patienten mit systolischer Herzinsuffizienz und symptomatischem VHF zeigte sich in Studien neben einer Symptomverbesserung auch eine Reduktion der Mortalitätsrate, daher Klasse-I-Empfehlung für eine Ablation als First-Line-Therapie.
Als Zweitlinientherapie zum Erhalt des Sinusrhythmus nach Versagen einer antiarrhythmischen Therapie bleibt die Klasse-I-Empfehlung für die Ablation unverändert.
„C“ – cardiovaskuläre Risikofaktoren managen
Neben den zentralen Themen einer adäquaten (meist notwendigen) Antikoagulation und der Frequenz- oder Rhythmuskontrolle betonen die neuen Guidelines die unbedingt erforderliche begleitende Behandlung von Komorbiditäten wie Diabetes mellitus, Hypertonie oder Adipositas.
Literatur:
1 Hindricks G et al. for the ESC Document Group: 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC). Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2012; 42(5): 373-498
Autoren:
Univ.-Prof. Dr. Daniel Scherr
Dr. Ursula Rohrer
Dr. Martin Manninger-Wünscher, PhD
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin
Medizinische Universität Graz
E-Mail: daniel.scherr@medunigraz.at
Das könnte Sie auch interessieren:
Funktionsstörung des Myokards: wenn die Entspannung des Herzens gestört ist
Die hypertropheobstruktive Kardiomyopathie (HOCM) ist dadurch charakterisiert, dass die Entspannung des Myokards funktionsgestört ist. Die Folge ist eine zunehmende Verdickung der ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...