Spezifische Medikation bei kardialer ATTR-Amyloidose: systematischer Review und Metaanalyse
Autoren:
Dr. Maximilian Autherith
Priv.-Doz. Dr. Christian Nitsche,PhD
Klinik für Innere Medizin II, Abteilung für Kardiologie
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die vorliegende Metaanalyse1 ist die erste Arbeit, welche randomisiert-kontrollierte klinische Studien zu Amyloid-spezifischer Therapie bei kardialer Transthyretin-Amyloidose mit Kardiomyopathie (ATTR-CM) harmonisiert und wichtige klinische Outcome-Parameter über alle Studien hinweg untersucht. ATTR-spezifische Therapie führt unabhängig von der gewählten Medikation und dem Krankheitsstadium bereits nach 12 Monaten zu Verbesserungen von Lebensqualität, Leistungsfähigkeit und kardialen Biomarkern. Mit fortgeführter Therapie resultiert dies nach ca. 2,5 Jahren in einer 42%igen Reduktion der Zahl der kardiovaskulären Events und einer 28%igen Reduktionder Mortalität.
Keypoints
-
Randomisiert-kontrollierte Studien, die die Effektivität ATTR-spezifischer Therapie untersuchten, inkludierten Patienten mit signifikant unterschiedlichen Baseline-Charakteristika. Dies verkompliziert einen direkten Effektivitätsvergleich der verwendeten Arzneimittel.
-
Unabhängig vom verwendeten Agens resultiert ATTR-spezifische Therapie bereits nach 12 Monaten in einer Verbesserung von Lebensqualität, Leistungsfähigkeit und kardialen Biomarkern. Dies mündet bei Therapieadhärenz nach 2,5 Jahren in einer 42%igen Reduktion der Zahl kardiovaskulärer Events und einer 28%igen Mortalitätsreduktion.
Die kardiale Transthyretin-Amyloidose (ATTR-CM) ist eine progrediente und fatal verlaufende Erkrankung, die durch die Ablagerung fehlgefalteter Transthyretin-Proteine im Myokard verursacht wird. Für viele Jahrzehnte gab es keine zielgerichtete Therapie für die Behandlung der ATTR-CM. In der jüngeren Vergangenheit wurden erstmals zielgerichtete Therapien entwickelt, die an unterschiedlichen Schritten der TTR-Kaskade angreifen und die Bildung fehlgefalteter TTR-Proteine verhindern. Insbesondere die TTR-Stabilisatoren (Tafamidis und Acoramidis) und die TTR-Synthesehemmer (Patisiran und Vutrisiran) wurden bereits in großen randomisiert-kontrollierten klinischen Studien untersucht und konnten sich zum Teil bereits in der Behandlung der ATTR-CM etablieren.2–5 Die raschen rezenten Entwicklungen im Bereich der ATTR-CM (bessere und frühere Diagnosestellung) sowie die unterschiedlichen Ein- und Ausschlusskriterien, primären und sekundären Endpunkte und Nachbeobachtungszeiten verkomplizieren den direkten Vergleich der in diesen Studien untersuchten Pharmakotherapien.
Erste Metaanalyse über alle randomisiert-kontrollierten klinischen Studien
Die aktuelle Metaanalyse ist die erste, die alle randomisiert-kontrollierten klinischen Studien harmonisiert und über die Auswirkungen Amyloid-spezifischer Therapie informiert. Als Studienendpunkte dieser Metaanalyse wurden wichtige klinische Outcome-Parameter wie Mortalität, kardiovaskuläre Ereignisse, 6-Minuten-Gehtest, KCCQ-Punktewert und NT-proBNP definiert und nach 12 sowie nach 30 Monaten Therapie untersucht.1
Im Rahmen des systematischen Reviews wurden alle Studien berücksichtigt, die Amyloid-spezifische Therapien bei Patienten mit ATTR-CM hinsichtlich der vordefinierten Outcome-Parameter untersuchten. Insgesamt wurden vier Originalarbeiten (ATTR-ACT, ATTRibute, APOLLO-B und HELIOS-B)2–5 sowie zwei sekundäre Analysen der entsprechenden Studien6,7 und damit insgesamt 2086 Patienten (Durchschnittsalter: 76 Jahre, 91% männlich, 85% wtATTR-CM) in die Metaanalyse eingeschlossen. Über alle Studien hinweg war der Großteil der Patienten in NYHA-Klasse 2 (73%) und in der Klassifikation des National Amyloidosis Centre (NAC) im Stadium 1. Die NT-proBNP-Werte lagen im Median bei 2445pg/ml und die eGFR-Werte bei 63ml/min/1,73m2.1
Unterschiede der Patienten-charakteristika führen auch zu unterschiedlichen Outcomes
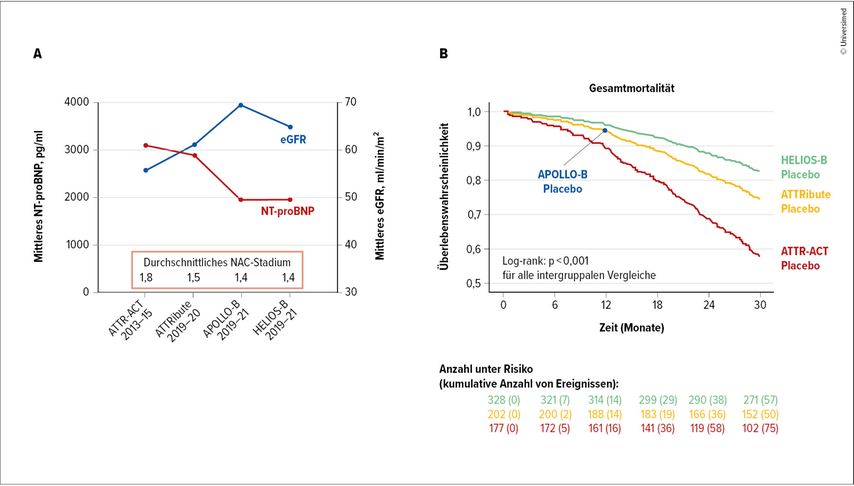
Die Baseline-Charakteristika der Patienten unterschieden sich signifikant zwischen den Studien. Patienten in der ATTR-ACT-Studie befanden sich zum Zeitpunkt des Studieneinschlusses in einem weiter fortgeschrittenen Stadium der Erkrankung mit schlechterer kardialer Funktion (NT-proBNP 3062pg/ml in ATTR-ACT im Vergleich zu 1911pg/ml in HELIOS-B) und schlechterer Nierenfunktion (eGFR 56ml/min/1,73m2 in ATTR-ACT im Vergleich zu 69ml/min/1,73m2 in APOLLO-B) im Vergleich zu rezenter durchgeführten Studien. Diese signifikanten Unterschiede der Baseline-Charakteristika dürften auch die Hauptursache der großen Mortalitäts- und Morbiditätsunterschiede zwischen den Studien sein (Abb. 1A).
Diese werden insbesondere durch die signifikanten Mortalitätsunterschiede (42,4% in ATTR-ACT vs. 25,7% in ATTRibute vs. 17,4% in HELIOS-B, Chi2- und Log-Rank-Test <0,001) und die signifikanten Unterschiede bezüglich kardiovaskulärer Ereignisse (60,5% in ATTR-ACT vs. 43,1% in ATTRibute vs. 27,7% in HELIOS-B, Chi2 <0,001) in den Placebogruppen der respektiven Studien nach 30 Monaten Nachbeobachtungszeit illustriert (Abb. 1B).1
Abb. 1: Unterschiede in den Baseline-Charakteristika zwischen den Studien (Panel A) und Unterschiede in der Mortalität zwischen den Placebogruppen der Studie (Panel B). (modifiziert/übersetzt nach Autherith M et al. 2025)1
Mortalität reduziert
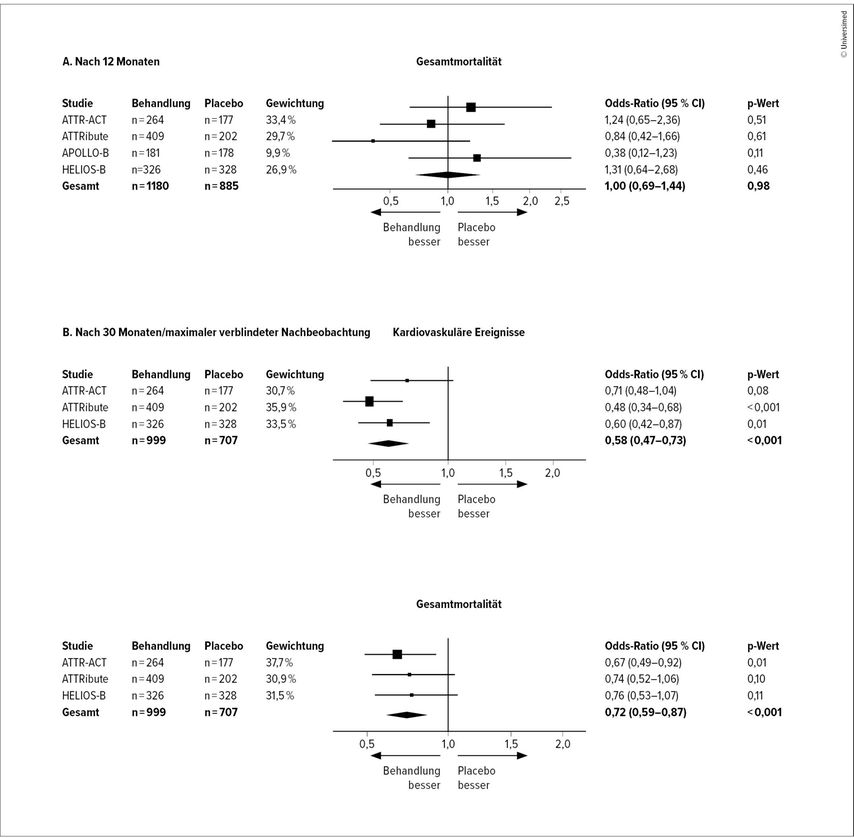
Mortalitätsdaten nach 12 Monaten waren für alle vier Studien verfügbar. Langfristige Auswirkungen von ATTR-spezifischer Therapie wurden in ATTR-ACT, ATTRibute und HELIOS-B untersucht. Bei APOLLO-B endete die Nachbeobachtungszeit nach 12 Monaten. Über alle Studien hinweg zeigte sich nach 12-monatiger Therapie kein positiver Effekt von ATTR-spezifischer Therapie im Vergleich zu Placebo (OR 1,00; 95% CI: 0,69 bis 1,44; p=0,98; I2<0,1%). Mit längerer Therapiedauer zeigte sich am Ende der verblindeten Periode der Studien ein signifikanter Vorteil von ATTR-spezifischer Therapie hinsichtlich Mortalität und kardiovaskulärer Ereignisse, im Sinne einer 28%igen respektive einer 42%igen Risikoreduktion im Vergleich zu Placebo.
Folglich resultierte eine ATTR-spezifische Therapie bei Patienten mit ATTR-CM im Vergleich zu Placebo in einer Prävention von 2,5 Todesfällen und 5,4 kardiovaskulären Ereignissen pro 100 Patientenjahre (Abb. 2).1
Abb. 2: Forest Plots zeigen die Unterschiede in Mortalität und kardiovaskulären Events nach 12 Monaten (Panel A) und nach 30 Monaten bzw. maximalem Follow-up (Panel B) über die unterschiedlichen Studien hinweg (modifiziert/übersetzt nach Autherith M et al. 2025)1
Lebensqualität verbessert
Bereits nach 12 Monaten zeigten sich die positiven Auswirkungen von ATTR-spezifischer Therapie in den Bereichen Lebensqualität, Leistungsfähigkeit und kardiale Biomarker.
Im Detail führte ATTR-spezifische Therapie bereits nach 12 Monaten zu ersten Verbesserungen des 6-Minuten-Gehtests, des KCCQ-Punktewerts und der NT-proBNP-Werte im Vergleich zu Placebo. Mit fortgeführter Therapie über 30 Monate persistierten diese Effekte und verstärkten sich sogar.1
Direkter Vergleich der ATTR-spezifischen Medikation nicht möglich
Aufgrund der beschriebenen Unterschiede der eingeschlossenen Patienten ist ein direkter Vergleich der Effektgrößen der vier untersuchten ATTR-spezifischen Medikamente (Tafamidis, Acoramidis, Patisiran, Vutrisiran) nicht möglich. Als Hauptursache für die Mortalitätsunterschiede in den entsprechenden Placebogruppen sind die fundamentalen Verbesserungen im Bereich der Diagnostik und Behandlung der ATTR-CM über die letzten Jahre zu nennen. Zudem dürfte eine begleitende Therapie mit Tafamidis (sowohl für Interventions- als auch Kontrollgruppe) die Ergebnisse der ATTRibute-, APOLLO-B- und HELIOS-B-Studie beeinflusst haben. Dementsprechend dürfte in Zukunft insbesondere die Fragestellung nach Kombinationstherapie bestehend aus TTR-Stabilisator (Tafamidis oder Acoramidis) und TTR-Synthesehemmer (Patisiran oder Vutrisiran) eine immer wichtigere Rolle spielen.
Fazit
Zusammenfassend lässt sich also schlussfolgern, dass ATTR-spezifische Therapie im Vergleich zu Placebo unabhängig vom verwendeten Agens bereits nach einem Jahr zu positiven Effekten hinsichtlich Lebensqualität, Leistungsfähigkeit und kardialer Biomarker führt. Diese Effekte persistieren und verstärken sich nicht nur, sondern führen nach längerer Therapiedauer auch zu signifikanten Reduktionen der kardiovaskulären Ereignisse und der Gesamtmortalität.
Literatur:
1 Autherith M et al.: Amyloid-specific medication in transthyretin amyloid cardiomyopathy: a systematic review and meta-analysis of cardiovascular outcome trials. J Card Fail 2025; doi: 10.1016/j.cardfail.2025.08.002 2 Maurer MS et al.: Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med 2018; 379(11): 1007-16 3 Gillmore JD et al.: Efficacy and safety of acoramidis in transthyretin amyloid cardiomyopathy. N Engl J Med 2024; 390(2): 132-42 4 Maurer MS et al.: Patisiran Treatment in patients with transthyretin cardiac amyloidosis. N Engl J Med 2023; 389(17): 1553-65 5 Fontana M et al.: Vutrisiran in patients with transthyretin amyloidosis with cardiomyopathy. N Engl J Med 2025; 392(1): 33-44 6 Judge DP et al.: Long-term efficacy and safety of acoramidis in ATTR-CM: Initial report from the open-label extension of the ATTRibute-CM trial. Circulation 2024; 151(9): 601-11 7 Damy T et al.: Long-term all-cause and cardiovascular-related mortality in patients with ATTR-CM treated with continuous tafamidis vs placebo to tafamidis by NAC stage at baseline. Eur Heart J 2024; 45(Supple_1), präsentiert am ESC Congress 2024 von Fontana M
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Stellenwert der nuklearmedizinischen Bildgebung zur Überwachung des Therapieverlaufs bei kardialer Amyloidose
Nuklearmedizinische Bildgebungsverfahren mit Amyloid-affinen Tracern haben sich als nichtinvasiver Goldstandard für die Diagnostik der Transthyretin-Amyloid-Kardiomyopathie (ATTR-CM) ...