Neuroprotektion bei kardiochirurgischen Eingriffen
Autoren:
Dr. med. Thomas Bauer
Dr. med. Fabio Barattiero
Prof. Dr. Dr. med. Gabor Erdös
Korrespondierender Autor:
Prof. Dr. Dr. med. Gabor Erdös
Leitender Arzt, Bereichsleiter Herz-Gefäss-Anästhesie, Notfallanästhesie und Weisse Zone
Universitätsspital, Inselspital Bern
E-Mail: gabor.erdoes@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Herzchirurgische Eingriffe haben ein hohes perioperatives Risiko für neurologische Komplikationen und damit assoziiert eine erhöhte Morbidität und Mortalität. Durch den Einsatz verschiedener Verfahren zur kontinuierlichen intraoperativen neurologischen Überwachung (Konzept des multimodalen Neuromonitorings) kann die Häufigkeit schwerer Komplikationen reduziert werden, und durch die frühzeitige Diagnose können entsprechende therapeutische Massnahmen ergriffen werden.
Keypoints
-
Ziele des intraoperativen multimodalen Neuromonitorings bei kardiochirurgischen Eingriffen: frühzeitige Detektion von zerebralen Ischämien, Überwachung von kardiochirurgischen Interventionen, Ergreifen von neuroprotektiven Massnahmen.
-
Die Ätiologie von neurologischen Ereignissen im Rahmen von kardiochirurgischen Eingriffen ist multifaktoriell und die klinische Manifestation heterogen.
-
Die «Fast track»-Strategie könnte einen potenziellen Benefit für das neurologische Outcome haben. Vor allem aber ermöglicht sie eine zeitnahe postoperative neurologische Beurteilung, um ggf. therapeutische Schritte einzuleiten.
-
Die Prähabilitation ist ein relativ neues Gebiet im Rahmen der präoperativen Vorbereitung, von dem man sich einen potenziellen Benefit für das Outcome von Patienten der Herzchirurgie erhofft.
Trotz des Fortschrittes in der Medizin werden neurologische Komplikationen nach kardiochirurgischen Eingriffen weiterhin relativ häufig beobachtet. Dies ist ein ernst zu nehmendes Problem, da zerebrovaskuläre Ereignisse im perioperativen Verlauf einen relevanten Einfluss auf die Morbidität und Mortalität haben. So konnte in mehreren Studien gezeigt werden, dass das Auftreten von zerebralen Ischämien sowohl die Dauer des Intensivaufenthaltes mit anschliessend längerer Hospitalisation als auch die Spitalmortalität und das Langzeitüberleben negativ beeinflusst.1–3 Zudem sind zerebrale Insulte ein führender Grund für langfristige Behinderungen, welche eine spezielle Rehabilitation und Pflege der betroffenen Patienten erfordern. Dies wiederum stellt eine finanzielle Belastung für das Gesundheitswesen dar.3
Abkürzungen
AEP: akustisch evozierte Potenziale
BIS: bispektraler Index
CSFD: zerebrospinale Flüssigkeitsdrainage
EEG: Elektroenzephalogramm
ICP: intrakranieller Druck
MEP: motorisch evozierte Potenziale
NIRS: Nahinfrarotspektroskopie
POCD: «postoperative cognitive dysfunction»
rSO2: regionale zerebrale Gewebeoxygenierung
SBI: «silent brain infarcts»
SjvO2: venöse Sauerstoffsättigung im Bulbus jugularis
SSEP: somatosensorisch evozierte Potenziale
TCD: transkranielle Dopplersonografie
Die Inzidenz von klinisch manifesten zerebrovaskulären Insulten liegt je nach Art des Eingriffs zwischen 1,2 und 9,7%.3–5 Aufgrund des engen therapeutischen Fensters für eine mechanische Thrombektomie der zerebralen Gefässe ist eine frühzeitige Diagnose erstrebenswert. Da die meisten kardiochirurgischen Eingriffe aber unter Allgemeinanästhesie stattfinden, ist die Diagnostik deutlich erschwert. Neben diesen offensichtlichen neurologischen Ereignissen werden im Rahmen von kardiochirurgischen Eingriffen auch eine hohe Anzahl sogenannter «silent brain infarcts» (SBI) beobachtet. Dabei handelt es sich um radiologisch nachgewiesene Insulte ohne klinisches Korrelat. Indja et al. konnten in einem systematischen Review und einer Metaanalyse zeigen, dass SBI mit einer Prävalenz von 0,14–0,71 auftreten.6 Bei mehr als 50% der Patienten konnten solche Läsionen postoperativ sogar in beiden Gehirnhemisphären nachgewiesen werden.4,7
Des Weiteren ist in der Herzchirurgie eine relativ hohe Prävalenz von postoperativem Delir zu beobachten. Je nach Studie wird davon ausgegangen, dass dabei zwischen 17 und 61% der Patienten eine solche akute qualitative Bewusstseinsstörung entwickeln.8,9 Insbesondere die hypoaktive Form, die über 40% aller Fälle ausmacht, wird dabei oftmals nicht erkannt.9 Als modifizierbare Risikofaktoren, wurden unter anderem das Vorliegen einer präoperativen Depression, Diabetes mellitus und arterielle Hypertonie identifiziert.10
In den letzten Jahren wurde intensive Forschung betrieben, um durch Anpassung des intraoperativen Managements die Inzidenz eines Delirs zu reduzieren. Die aktuelle Studienlage zeichnet aber ein heterogenes Bild und wegweisende Studien sind ausstehend.
Ein vielversprechender pharmakologischer Ansatz ist Dexmedetomidin, ein selektiver α2-adreneger Rezeptoragonist. Die aktuellen «Guidelines for Perioperative Care in Cardiac Surgery» von 2019 empfehlen Dexmedetomidin für Patienten der Kardiochirurgie, da es unter anderem die Delirinzidenz reduziert.11 Diese Behauptung wurde von Turan et al. in einer 2020 publizierten multizentrischen Studie angezweifelt. Die Autoren untersuchten Dexmedetomidin im Rahmen von aortokoronaren Bypassoperationen und fanden keinen signifikanten Unterschied zur Placebogruppe.12 Auch andere Studien fanden keine Signifikanz.13,14 Demgegenüber steht eine Reihe von kürzlich publizierten Studien an Patienten der Herzchirurgie, die allesamt eine Reduktion in der Delirinzidenz beobachtet haben.15–20 Zukünftige Studien sind notwendig, um auf diesem Gebiet mehr Klarheit zu schaffen.
Ein weiterer intraoperativer Optimierungsansatz zur Delirprophylaxe stellt die Messung der Hirnstromaktivität mittels prozessiertem Elektroenzephalogramm (pEEG) dar. Durch Vermeidung einer zu tiefen Narkose, die sich in Form einer sogenannten Burst-Suppression im Neuromonitoring bemerkbar macht, konnte die Delirwahrscheinlichkeit signifikant gesenkt werden.21,22
Perioperatives Neuromonitoring
Das perioperative Neuromonitoring dient der frühzeitigen Erkennung zerebraler Dysfunktionen, bedingt durch insuffiziente Sauerstoffversorgung oder Perfusion. Dadurch erhofft man sich eine Senkung sowohl der Morbidität als auch der Mortalität. Die Studienlage hierfür ist aktuell schwach.23
Mithilfe des Neuromonitorings kann/können:
-
die zerebrale Perfusion in einem bestimmten Areal überwacht werden (TCD, NIRS, CSFD),
-
die zerebrale Oxygenation überwacht werden (NIRS, SjvO2),
-
ein embolisches Ereignis diagnostiziert werden (NIRS, EEG, TCD),
-
die Narkosetiefe individuell gesteuert werden (EEG),
-
nicht konvulsive Krampfanfälle frühzeitig erkannt werden (EEG) und
-
die Funktionalität peripherer Nerven überwacht werden (MEP, SSEP).24
Damit eine adäquate Therapie eingeleitet werden kann, ist es unerlässlich, dass die zugrunde liegende Ursache der Minderperfusion identifiziert wird. Perioperative neurologische Verschlechterungen sind aber oftmals multifaktoriell, und die frühzeitige Diagnostik ist vor allem bei allgemeinanästhesierten Patienten schwierig. Als häufigste intraoperative Ursachen einer neurologischen Verschlechterung nach herzchirurgischen Eingriffen werden (Mikro-)Embolien oder Ischämien, zerebrale Hyperthermie, arterielle Hypotension oder hämodynamische Instabilität, Sepsis, Anämie, Hyperglykämie und Vorhofflimmern genannt. Auch genetische Faktoren wurden identifiziert. Diverse genetische Polymorphismen, vor allem bei Proteinen der Immunabwehr, scheinen dabei das Risiko für postoperative neurologische Komplikationen zu erhöhen. Relevant dürften vor allem das C-reaktive Protein, Interleukin-6, P-Selektin und Apolipoprotein E-e4 sein.25 Die Datenlage ist aber noch nicht eindeutig und es existieren zurzeit noch keine gezielten therapeutischen Strategien.
Pagnesi et al. konnten bei Transkatheter-Eingriffen in bis zu 86% der Fälle zerebrale Läsionen in der postoperativen Magnetresonanzbildgebung (MRI) feststellen. Die meisten davon hatten kein klinisches Korrelat.4 Im Rahmen einer histopathologischen Analyse des in CEP(«cerebral embolic protection»)-Filtern aufgefangenen Materials konnte dieselbe Arbeitsgruppe die häufigsten Emboliequellen identifizieren. Dabei fanden sich bei 86% der Patienten akute Thromben und nicht polarisierbare basophile Fremdkörper. Vermutlich bildeten sich die akuten Thromben im Rahmen der Intervention (z.B. Führungskatheter). Weiterhin wurden Klappen- bzw. Vorhofsmaterial (64%), chronisch organisierte Thromben (29%) und Myokardgewebe (14%) in den Filtern nachgewiesen.4 In Bezug auf die Frage, ob fortan alle Patienten einen CEP-Filter erhalten sollten, ist die bisherige Datenlage noch kontrovers, allerdings mit einer positiven Tendenz.26 Zukünftige Studien werden diesbezüglich Klarheit schaffen.
Neben den intraoperativen Ereignissen, welche zu einer neurologischen Verschlechterung führen können, darf nicht vergessen werden, dass die meisten Patienten bereits präoperativ Risikofaktoren aufweisen. Hierzu zählen vor allem hohes Alter, Arteriosklerose, arterielle Hypertonie, Diabetes mellitus, Verengungen der hirnzuführenden Gefässe, periphere arterielle Verschlusskrankheit und Depression. Diese führen unabhängig von den intraoperativen Ursachen zu einer erhöhten Inzidenz von POCD («postoperative cognitive dysfunction»). Mit zunehmendem Alter der Gesellschaft und insbesondere der herzchirurgischen Population hat diese Problematik in den letzten Jahren weiter an Bedeutung gewonnen.27–29
Das Ziel der verschiedenen Neuromonitoringverfahren (Tab. 1) ist es, eine zerebrale Dysfunktion möglichst nicht invasiv, rasch und mit hoher Sensitivität zu erfassen, um anschliessend therapeutische Schritte einzuleiten. Im Folgenden werden die häufigsten Neuromonitoringverfahren genauer beleuchtet.
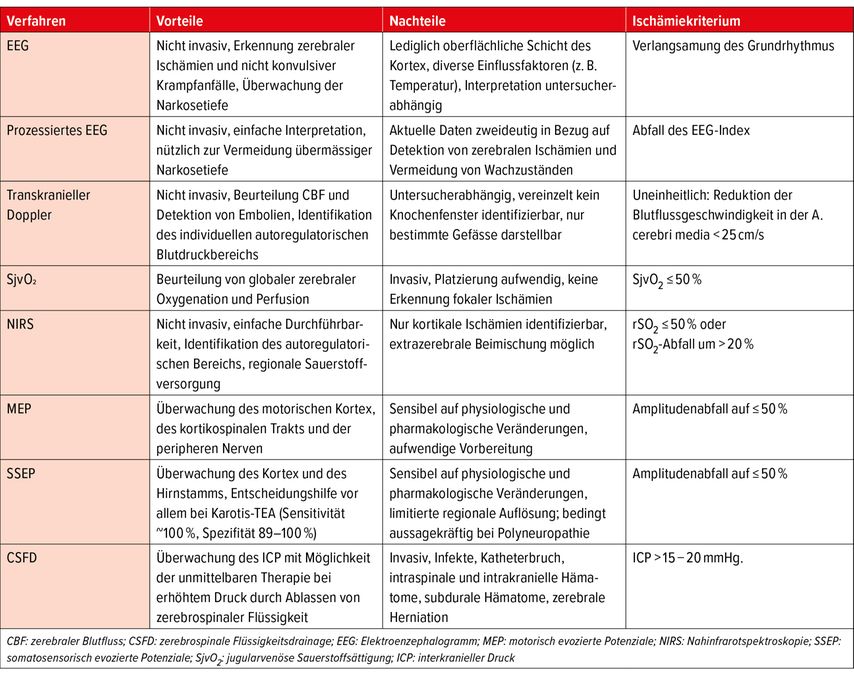
Tab. 1: Übersicht über die verschiedenen Neuromonitoringverfahren (modifiziert nach Ref. 24, 31, 48, 60, 61)
Elektroenzephalogramm (EEG)
Die Elektroenzephalografie misst die summierten kortikalen Potenzialschwankungen oberflächlicher Gehirnareale und stellt diese grafisch in Form eines Elektroenzephalogramms dar. Die abgeleiteten Signale repräsentieren die synaptische Aktivität kortikaler Neuronen, weshalb Pathologien in den tieferen Geweben nur unzureichend wiedergegeben werden.30,31 Neben dieser räumlichen Limitation kann die Messung intraoperativ aber auch durch diverse andere Einflussfaktoren, wie zum Beispiel Alter, Hypothermie, Hypotension, Pharmaka und Hypo- oder Hyperkapnie negativ beeinflusst werden.32
Mithilfe des EEGs können
-
die Narkosetiefe überwacht,
-
ein nicht konvulsiver epileptischer Anfall identifiziert und
-
zerebrale Ischämien diagnostiziertwerden.
Dies geschieht anhand der Interpretation des Roh-EEG und dessen Frequenzspektrum. Sauerstoffmangel im Gehirn, unabhängig von der zugrunde liegenden Ursache, verursacht eine plötzliche ipsilaterale Verlangsamung im EEG, in Form einer Amplitudenabnahme im hohen Frequenzbereich (Alpha 8–12Hz; Beta 12–20Hz) und Zunahme im tiefen Frequenzbereich (Theta 4–8Hz; Delta 1–4Hz).24 Bei unveränderter Narkotikadosierung besitzt das EEG eine gute Spezifität für die perioperative Ischämiediagnostik.31,32
Während in der Neurologie das Multikanal-EEG mit mindestens 8 Kanälen üblich ist, verwenden handelsübliche perioperative Geräte für gewöhnlich nur 1–2 Kanäle (z.B. Narcotrend®). Diese sind nicht nur einfacher zu platzieren, nutzerfreundlicher im operativen Bereich und relativ einfach zu interpretieren, sondern erlauben auch eine relativ gute Beurteilung der gesamten Hirnleistung.34
Prozessierte EEG-Parameter (pEEG)
Da für ungeübte Kliniker die Interpretation des Roh-EEG oftmals eine Herausforderung darstellt, hat das pEEG mit seiner vereinfachten Darstellung in Form einer numerischen Skala in den vergangenen Jahren zunehmend an Popularität gewonnen. Die Summation der elektrischen Potenziale wird in einen Zahlenwert zwischen 0 und 100 umgewandelt, wobei Null keine elektrische Aktivität bedeutet und 100 beim wachen Patienten mit offenen Augen beobachtet wird. Die geläufigste Variante des pEGG ist der bispektrale Index (BIS).
Ursprünglich erhoffte man sich, mithilfe des pEEG intraoperative Wachzustände zu reduzieren. Die Datenlage zeigt sich allerdings heterogen. In Hinblick auf intraoperative Wachzustände ist die BIS-gesteuerte Narkose der endtidalen Gaskonzentration nicht überlegen. Hingegen haben einzelne Studien positive Resultate im Zusammenhang mit einer totalen intravenösen Anästhesie mit Propofol gezeigt. Auch wurden signifikant kürzere Narkoseausleitungsphasen sowie geringere Inzidenzen von Delir beobachtet.35–39 In Bezug auf die Sensitivität für die Detektion von zerebralen Ischämien zeigt sich die Datenlage ebenfalls nicht eindeutig.40,41 Aus diesem Grund kann basierend auf der aktuellen Literatur das BIS-Monitoring zur intraoperativen Ischämiediagnostik nicht empfohlen werden.31
Transkranielle Dopplersonografie (TCD)
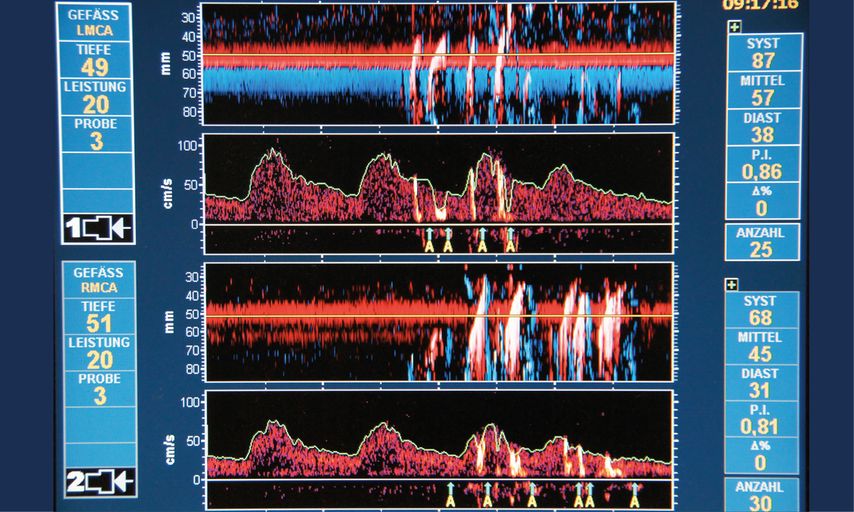
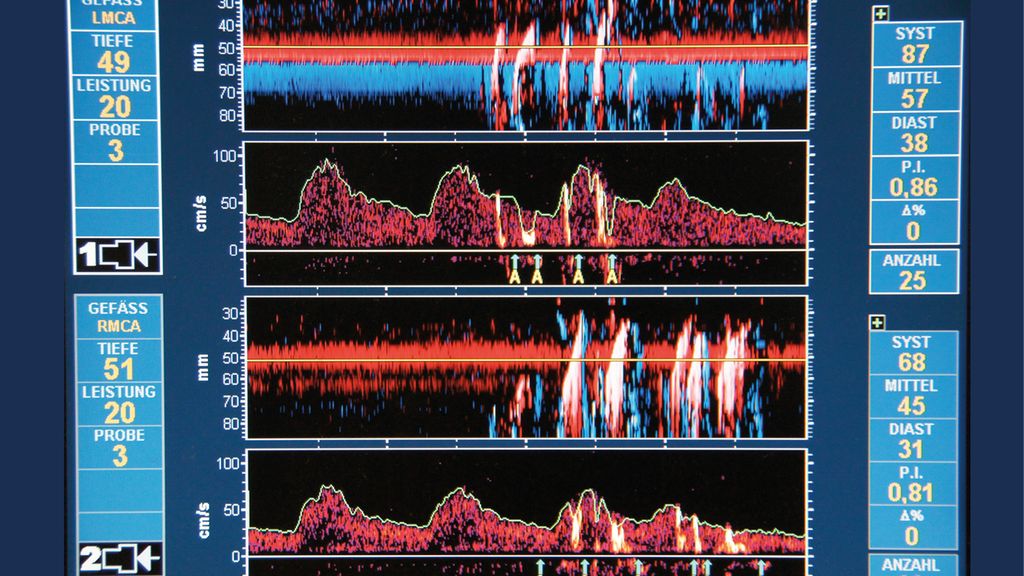
Die transkranielle Dopplersonografie ist ein nicht invasives Verfahren zur kontinuierlichen Messung der zerebralen Blutflussgeschwindigkeit in den basalen Hirngefässen. Dabei werden über das transtemporale Schallfenster vorrangig die Aa. cerebri mediae aufgesucht (alternativ können auch die Aa. cerebri anteriores und posteriores identifiziert werden) und es werden Veränderungen der Durchblutung (anhand der Blutflussgeschwindigkeit) bzw. das Auftreten von Intensitätsanstiegen als Korrelat von embolischen Signalen («high intensity transient signals») detektiert. Das diagnostische Spektrum der TCD ermöglicht die frühzeitige Diagnostik von embolischen Ischämien, Vasospasmen, einer zerebralen Hyperämie – nach z.B. erfolgreicher Rekanalisation der A. carotis interna– und eines Anstiegs des intrakraniellen Drucks (ICP). Zudem kann mithilfe der TCD der individuelle Bereich der zerebralen Autoregulation identifiziert werden.24,42 Während herzchirurgischer Eingriffe kann diese Technik auch Informationen in Bezug auf die Blutflussrichtung bei hypothermem Kreislaufstillstand mit retro- und antegrader zerebraler Perfusion geben und im Falle eines plötzlichen Abfalles des Blutflusses eine Perfusionskanülendislokation oder Gefässdissektion frühzeitig erkennen lassen. Limitiert wird dieses Verfahren unter anderem durch die vorausgesetzte fachliche Expertise zur Erfassung von genauen Messwerten sowie die gelegentlich vorkommende Nicht-Auffindbarkeit eines adäquaten Schallfensters. Prinzipiell wäre die TCD zur Ischämiediagnostik geeignet. Im Vergleich zur NIRS ist sie intraoperativ aber deutlich weniger praktikabel und sehr stark untersucherabhängig.31,43–47
Abb. 1: Zerebrale Emboliedetektion mittels transkranieller Dopplersonographie
Venöse Sauerstoffsättigung im Bulbus jugularis (SjvO2)
Die SjvO2 erlaubt es abzuschätzen, ob das Verhältnis zwischen dem globalen zerebralen Blutfluss und dem zerebralen Metabolismus im Gleichgewicht ist. Hierfür wird ein Katheter retrograd über die V.jugularis interna bis in den Bulbus jugularis an der Schädelbasis vorgeschoben. Bei gesunden Patienten werden Normalwerte von 55–75% gemessen. Ein Abfall auf <50% ist hinweisend für eine zerebrale Ischämie.48 Aufgrund der interindividuellen anatomischen Variabilität kann einerseits die Platzierung der Sonde schwierig sein, andererseits kann es durch extrakranielle Blutbeimischung zu einer Verfälschung der gemessenen Werte kommen. Von einigen Autoren wird daher die kontinuierliche Trendmessung gegenüber den absoluten Werten bevorzugt.49
Im Unterschied zu anderen diagnostischen Modalitäten zur Messung der zerebralen Oxygenierung, wie zum Beispiel die Nahinfrarotspektroskopie (NIRS), misst die SjvO2 die globale zerebrale Sauerstoffsättigung. Dadurch können unvorhergesehene Abfälle der Oxygenierung und des zerebalen Blutflusses frühzeitig erkannt werden und damit einhergehende postoperative kognitive Störungen verhindert werden. Kadoi et al. untersuchten die SjvO2 im Rahmen kardiopulmonaler Bypassoperationen und fanden ein erhöhtes Risiko für Sättigungsabfälle (SjvO2 <50%) bei älteren Patienten über dem 70. Lebensjahr, die wiederum mit kurzzeitigen kognitiven Dysfunktionen verbunden waren.50
Während die SjvO2 zwar Aussagen zur globalen Oxygenation und Perfusion erlaubt, ist die Methode weniger sensitiv gegenüber regionalen Veränderungen. Ein normaler Wert kann folglich eine regionale zerebrale Ischämie nicht ausschliessen. Ein weiterer Nachteil ergibt sich, im Unterschied zur NIRS, durch die Invasivität, welche weitere Risiken wie Thrombosen und Blutungen mit sich bringt.31,51
Nahinfrarotspektroskopie (NIRS)
Die NIRS ist ein nicht invasives Verfahren zur kontinuierlichen Messung der regionalen zerebralen Gewebeoxygenierung (rSO2) mithilfe frontal aufgeklebter Elektroden. Diese emittieren und empfangen Licht im nahinfraroten Bereich und berechnen anhand des Absorptionsspektrums den Anteil an oxygeniertem und deoxygeniertem Hämoglobin. Das Licht durchläuft auf seinem Weg von der Lichtquelle zum Empfänger sowohl extrazerebrales als auch zerebrales Gewebe. Eine hohe extrazerebrale Sauerstoffsättigung kann daher eine niedrige zerebrale Sättigung, wie sie bei Ischämien auftritt, maskieren. Moderne Geräte sind so konzipiert, dass sie diese extrazerebrale Kontamination möglichst geringhalten.48 Die normale präoperative rSO2 von herzchirurgischen Patienten liegt im Median bei 62% (56–67%). Die rSO2-Werte reflektieren dabei die Schwere der kardiopulmonalen Dysfunktion, und folglich sind tiefe Ausgangswerte mit einer schlechten Prognose assoziiert.52 Eine regionale zerebrale Sauerstoffsättigung unter 50% bzw. weniger als 20% des Ausgangswertes, insbesondere wenn sie einseitig auftreten, sind hochgradig verdächtig für eine ipsilaterale Ischämie und gehen mit einer erhöhten Morbidität und Mortalität einher.24,48 Die aktuelle Datenlage ist jedoch kontrovers in Bezug auf die Dauer, die eine solche Entsättigung beschwerdefrei toleriert werden kann. Fest steht aber: Je länger eine schlechte zerebrale Oxygenation vorliegt, desto ausgeprägter sind die postoperativen kognitiven Defizite.53
Im Rahmen kardiochirurgischer Eingriffe mit extrakorporalem Kreislauf, hilft die NIRS zudem zerebrale Minderperfusionen durch eine Fehllage der arteriellen und venösen Kanülen zu identifizieren und jene Patienten ausfindig zu machen, bei denen eine bilaterale Gehirnperfusion benötigt wird. Erkennbar wird dies durch einseitige rSO2-Abfälle.48
In einer Stellungnahme der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI), der Schweizer Cardiovascular and Thoracic Anaesthesia Group der Schweizerischen Gesellschaft für Anästhesiologie und Reanimation (SGAR), und der Deutschen Gesellschaft für Thorax-, Herz- und Gefässchirurgie (DGTHG) wurde 2014 ein Algorithmus zum Vorgehen bei intraoperativen rSO2-Abfällen vorgestellt,48 der ursprünglich auf einem Algorithmus von Denault et al. basierte.54
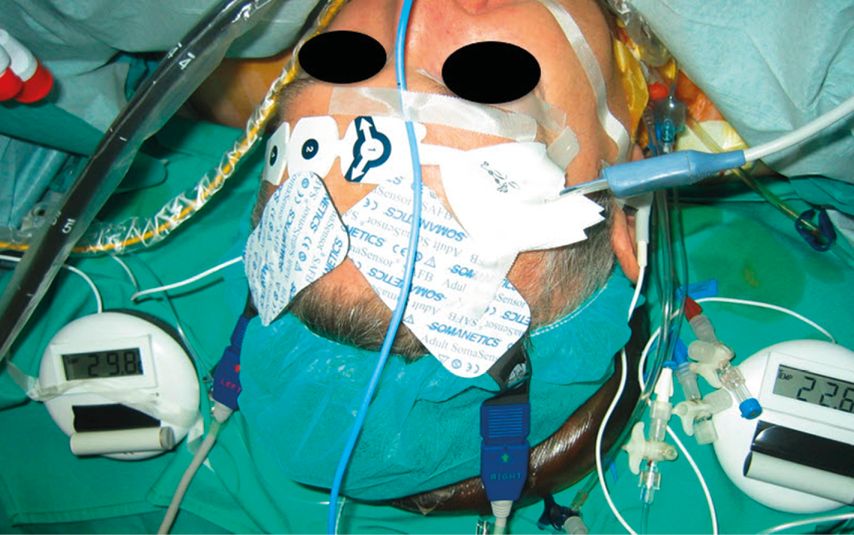
Abb. 2: Multimodales Neuromonitoring eines Patienten (mit NIRS und pEEG) während einer Operation am Aortenbogen im hypothermen Kreislaufstillstand
Evozierte Potenziale (EP)
Evozierte Potenziale sind eine nicht invasive Technik zur kontinuierlichen Überwachung gefährdeter Nervenstrukturen. Im Unterschied zum EEG, welches kortikale Potenziale misst, können mithilfe der EP die Veränderungen sowohl an zentralen als auch peripheren Bahnen auf exogene Stimuli untersucht werden.
Unterschieden wird zwischen motorischen (MEP), somatosensorischen (SSEP) und akustischen evozierten Potenzialen (AEP) sowie der Elektromyografie (EMG). In der Kardioanästhesie spielen EP heutzutage nur noch eine untergeordnete Rolle. In spezifischen Situationen werden aber weiterhin SSEP und MEP empfohlen.48
Die SSEP haben unter anderem einen Stellenwert bei der Erkennung von akuten zerebralen Ischämien im Rahmen der Karotischirurgie. Kommt es nach dem Abklemmen der A. carotis communis zu einer Amplitudenminderung in den SSEP, deutet dies auf eine insuffiziente kontralaterale Perfusion mit beginnender zerebraler Hypoxie hin. Diese frühzeitigen Informationen helfen dem operierenden Team bei der Frage, ob der Patient zur Optimierung der Perfusion von einem intraluminalen Shunt profitieren würde. Dies wiederum hat einen positiven Einfluss auf das postoperative neurologische Outcome.48,55 Für die Messung der SSEP wird ein peripherer Nerv (N. medianus oder N. tibialis) elektrisch stimuliert und die evozierte Reizantwort über dem sensorischen Kortex abgeleitet.56 Durch Summation und Mittelung vieler Einzelpotenziale können Störpotenziale bereinigt werden. So wie auch die anderen Neuromonitoringverfahren sind auch die EP sensibel gegenüber äusseren Einflüssen. Nur unter stabiler Hämodynamik und Dosierung der Anästhetika kann eine Zunahme der Latenz und Abnahme der Amplitude korrekt erkannt werden und so der Verdacht auf eine zerebrale Ischämie oder Nervenverletzung gestellt werden. Eine Amplitudenminderung von 50% ist dabei verdächtig auf ein neurologisches Ereignis.24,48,57 Während die NIRS nur die Oxygenation der oberflächlichen Gehirnareale darstellen kann, kann durch die SSEP neben dem Kortex auch der Hirnstamm überwacht werden.
Motorisch evozierte Potenziale werden heutzutage nur noch bei Operationen an der thorakalen Aorta descendens eingesetzt und dienen der frühzeitigen Erkennung spinaler Ischämien. Bei diesem Verfahren wird der motorische Kortex stimuliert und im entsprechenden Kennmuskel die elektromuskuläre Antwort abgeleitet. Damit wird sowohl die Funktion des motorischen Kortex als auch der efferenten Leitungsbahnen überwacht. Relevant ist dies im Rahmen der Aortenchirurgie, wenn auf Höhe Th12, oberhalb des Abgangs der A. radicularis magna abgeklemmt werden muss. Die kaudal davon gelegenen Vorderstrangbahnen des Rückenmarks sind nämlich relativ schlecht kollateralisiert und daher besonders vulnerabel für Perfusionsdefizite. Mithilfe von MEP und SSEP kann das Paraplegierisiko nach Chirurgie der Aorta descendens signifikant reduziert werden.48,56,58
Zerebrospinale Flüssigkeitsdrainage (CSFD)
Ein weiteres Neuromonitoringverfahren stellt die Überwachung des intrakraniellen Drucks (ICP) mithilfe einer zerebrospinalen Drainage während thorakaler Aortenchirurgie dar. Aufgrund spinaler Durchblutungsstörungen im Rahmen aortaler Eingriffe besteht ein erhöhtes Risiko für spinale Ischämie mit nachfolgenden neurologischen Ausfällen. Entsprechend einer Metaanalyse von 2018 liegt die Inzidenz für Rückenmarksischämien bei 7% (IQR 1,3–9,6%).59 Das Risiko für eine permanente Paraplegie liegt bei ca. 2,9%.60 Ursächlich ist dafür eine Druckerhöhung im Spinalkanal bedingt durch eine Steigerung des zerebralen Blutflusses und des zentralvenösen Drucks nach Abklemmen der thorakalen Aorta. Zudem verursacht die lokale Ischämie eine Störung der Blut-Hirn-Schranke, was wiederum ein reperfusionsbedingtes Gewebeödem zur Folge haben kann. Der ansteigende ICP kann Druckschäden im Bereich des gesamten Rückenmarks verursachen und die komprimierte Mikrozirkulation negativ beeinflussen.61 Mithilfe der CSFD liegt ein kontinuierliches Monitoringverfahren zur Verfügung, mit dem, ab einem kritischen ICP von 10mmHg, gleichzeitig zerebrospinale Flüssigkeit abgelassen werden kann. Gemäss aktueller Literatur reduziert die CSFD dadurch signifikant das Risiko für bleibende neurologische Komplikationen.59–63 In einer Metaanalyse von 2016 wurde eine relative Risikoreduktion von 58% für Paraplegie bei offenen thorakalen Aortenoperationen beobachtet.64
«Fast track»-Chirurgie
Eine Besonderheit in der Kardiochirurgie in Bezug auf das Neuromonitoring stellt die «Fast track»-Strategie dar. Das Prinzip beruht auf der Überlegung, dass unkomplizierte Patienten, die ein entsprechendes «Fast track»-Protokoll erfüllen, frühzeitig extubiert werden, um
-
die Dauer der künstlichen Beatmung,
-
die Dauer des Intensivaufenthaltes,
-
die Dauer des Krankenhausaufenthaltesund folglich
-
die Kosten für das Gesundheitssystem zu reduzieren,
ohne dabei die Qualität der medizinischen Behandlung negativ zu beeinflussen.
Wenn die entsprechenden medizinischen Voraussetzungen gegeben sind, versucht man heutzutage, nach intraoperativer niedrig dosierter Opioid-basierter Allgemeinanästhesie (vorzugsweise kombiniert mit einem Regionalanästhesieverfahren) noch im Operationstrakt den Patienten zu extubieren und anschliessend auf eine qualifizierte Station (z.B. Intermediate Care) ausserhalb der Intensivmedizin zur Weiterbetreuung zu verlegen.65 Vor allem die frühzeitige Beendigung der künstlichen Beatmung sowie die Reduktion von Betreuungstagen auf einer intensivmedizinischen Station reduzieren nachweislich das Risiko für eine postoperative kognitive Dysfunktion.66,67 Zudem kann ein Patient nach zeitnaher Extubation auch rasch neurologisch beurteilt werden und gegebenenfalls eine entsprechende Therapie frühzeitig eingeleitet werden. Diverse Studien konnten mittlerweile die Sicherheit und die Effektivität des «fast track» bei ausgewählten Patienten belegen.65,68,69
Zusammenfassung und Ausblick
Im Rahmen von herzchirurgischen Eingriffen kann es zu neurologischen Komplikationen kommen, die signifikante Auswirkungen auf die Morbidität und Mortalität der Patienten haben. Die verschiedenen Neuromonitoringverfahren verfolgen das Ziel, intraoperative (kardiochirurgische) Massnahmen zu überwachen und intraoperative (neurologische) Komplikationen zu vermeiden bzw. frühzeitig zu erkennen. In Zukunft wird sich die Forschung im Bereich der Herzanästhesie zweifelsohne noch intensiver mit dem Thema Neuromonitoring beschäftigen, um das Outcome dieser vulnerablen Patientenpopulation zu verbessern. Eine Domaine in diesem Zusammenhang ist die Prähabilitation. Sie zielt darauf ab, durch Optimierung der präoperativ zur Verfügung stehenden Reserven die psychische und physische Ausgangslage der Patienten zu verbessern.70 Eine kürzlich publizierte Studie konnte positive Effekte auf die Lungenkapazität und Lebensqualität bei Elektivpatienten für aortokoronare Bypassoperationen zeigen.71 Zukünftige Studien sind erforderlich, um das optimale Trainingsprogramm für dieses hochkomplexe Patientenkollektiv zu identifizieren und in weiterer Folge einen tatsächlichen Nutzen auf den neurologischen Verlauf zu zeigen.
Literatur:
1 Tarakji KG et al.: JAMA 2011; 305: 381-90 2 Sutter R et al.: Crit Care Med 2018; 46: 1506-13 3 Salazar JD et al.: Ann Thorac Surg 2001; 72: 1195-201 4 Pagnesi M et al.: JACC Cardiovasc Interv 2018; 11: 517-28 5 Stortecky S, Windecker S: Circulation 2012; 126: 2921-4 6 Indja B et al.: J Am Heart Assoc 2019; 8: 1-18 7 Gottesman RF et al.: Stroke 2006; 37: 2306-11 8 Rudolph JL et al.: J Am Geriatr Soc 2005; 53: 462-6 9 Janssen TL et al.: Clin Interv Aging 2019; 14: 1095-117 10 Greaves D et al.: J Am Hear Assoc Cardiovasc Cerebrovasc Dis 2020; 9: e017275 11 Engelman DT et al.: JAMA Surg 2019; 154: 755-66 12 Turan A et al.: Lancet 2020; 396: 177-85 13 Deiner S et al.: JAMA Surg 2017; 152: e171505 14 Shi C et al.: Clin Interv Aging 2019; 14-571 15 Hamouda T et al.: Cardiothorac Surg 2020; 28: 1-6 16 Xiong X et al.: Front Med 2021; 8: 645975 17 van Norden J et al.: Anaesthesia 2021; 76: 1342-51 18 Ming Set al.: Ann Palliat Med 2020; 9: 264-267 19 Likhvantsev VV et al.: J Cardiothorac Vasc Anesth 2021; 35: 449-57 20 Li C-J et al.: Br J Surg 2020; 107: 123-32 21 Pedemonte JC et al.: Anesthesiology 2020; 133: 280-92 22 Soehle M et al.: BMC Anesthesiol 2015; 15: 61 23 Thiele RH et al.: Anesth Analg 2020; 131: 1444-55 24 Engelhard K: Anasthesiol und Intensivmed 2021; 62: 410-6 25 Lomivorotov VV et al.: J Cardiothorac Vasc Anesth 2022; 36: 567-76 26 Armijo G et al.: Front Cardiovasc Med 2018; 5: 1-14 27 Roach GW et al.: N Engl J Med 1996; 335: 1857-64 28 Patel N et al.: J Neurol Sci 2020; 416: 117006 29 Holmgaard F et al.: Br J Anaesth 2019; 123: 196 30 Sun Y et al.: Front Med 2020; 7: 251 31 Lewis C et al.: J Cardiothorac Vasc Anesth 2018; 32: 2313-22 32 Wallenborn J: Anästh Intensivmed 2012; 53: 151-67 33 Chang R et al.: Clin Neurophysiol 2020; 131: 1508-16 34 Johnstone SJ et al.: Clin EEG Neurosci 2012; 43: 112-20 35 Lewis SR et al.: Cochrane Database Syst Rev 2019; 9: CD003843 36 Myles PS et al.: Lancet 2004; 363: 1757-63 37 Gao WW et al.: Curr Med Sci 2018; 38: 349-53 38 Shukla U et al.: Anesth Essays Res 2020; 14: 600-4 39 Schuller PJ et al.: Br J Anaesth 2015; 115: i95-103 40 Deogaonkar A et al.: Br J Anaesth 2005; 94: 800-4 41 Bonhomme V et al.: J Neurosurg Anesthesiol 2007; 19: 49-55 42 Hogue CW et al.: Semin Thorac Cardiovasc Surg 2021; 33: 429-38 43 Ghazy T et al.: Heart Surg Forum 2017; 20: E85-E88 44 Rilinger JF et al.: J Stroke Cerebrovasc Dis 2017; 26: 2336-45 45 Ince J et al.: J Neurol Sci 2020; 419: 117164 46 Moritz S et al.: Anesthesiology 2007; 107: 563-9 47 Cho JW, Jang JS: Korean J Thorac Cardiovasc Surg 2017; 50: 448-52 48 Brandes I et al.: Anästh Intensivmed 2014; 55: 2-19 49 Filippi R et al.: Neurosurg Rev 2000; 23: 94-7 50 Kadoi Y et al.: J Am Coll Cardiol 2001; 38: 1450-5 51 Zhong W et al.: Healthcare 2021; 9: 1104 52 Heringlake M et al.: Anesthesiology 2011; 114: 58-69 53 Slater JP et al.: Ann Thorac Surg 2009; 87: 36-45 54 Denault A et al.: Semin Cardiothorac Vasc Anesth 2007; 11: 274-81 55 Leopardi M et al.: Ann Vasc Surg 2019; 61: 178-84 56 Michels P et al.: Anaesthesist 2017; 66: 645-59 57 Inoue T et al.: J Neurosurg 2013; 118: 1023-9 58 Liu LY et al.: J Card Surg 2016; 31: 383-9 59 Rong LQ et al.: Br J Anaesth 2018; 120: 904-13 60 Coselli JS et al.: J Thorac Cardiovasc Surg 2016; 151: 1323-38 61 Gawenda M et al.: Dtsch Arztebl 2005; 102: 201-13 62 Estrera AL et al.: Ann Thorac Surg 2009; 88: 9-15 63 Abdelbaky M et al.: JTCVS Tech 2021; 6: 1-8 64 Khan NR et al.: J Neurosurg Spine 2016; 25: 383-93 65 Wong WT et al.: Cochrane Database Syst Rev 2016; 9: CD003587 66 Belrose JC, Noppens RR: BMC Anesthesiol 2019; 19: 241 67 Kotfis K et al.: Anaesthesiol Intensive Ther 2018; 50: 128-40 68 Bainbridge D, Cheng D: Eur Hear J Suppl 2017; 19(suppl_A): A3-7 69 Ender J et al.: Anesthesiology 2008; 109: 61-6 70 McCann M et al.: J Cardiothorac Vasc Anesth 2019; 33: 2255-65 71 Steinmetz C et al.: Clin Rehabil 2020; 34: 1256-67
Das könnte Sie auch interessieren:
Funktionsstörung des Myokards: wenn die Entspannung des Herzens gestört ist
Die hypertropheobstruktive Kardiomyopathie (HOCM) ist dadurch charakterisiert, dass die Entspannung des Myokards funktionsgestört ist. Die Folge ist eine zunehmende Verdickung der ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...