LVEF – Relevanz bei Therapieauswahl und Risikostratifizierung?
Autor:
Univ.-Prof. Dr. Gerhard Pölzl, FESC, FHFA
Universitätsklinik für Innere Medizin III Kardiologie & Angiologie, Interdisziplinäres Herzinsuffizienzzentrum Tirol, IHZ Expertisezentrum für seltene Herzmuskelerkrankungen, Medizinische Universität Innsbruck
E-Mail: gerhard.poelzl@tirol-kliniken.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zweifellos stellt das Management des komplexen Syndroms der Herzinsuffizienz (HI) eine Herausforderung für den behandelnden Arzt dar. Einfache und klare Einteilungen sind dabei didaktisch hilfreich und erleichtern die klinische Arbeit.
Diagnose, Risikostratifizierung und Therapieentscheidungen werden zu einem wesentlichen Teil an der linksventrikulären Auswurffraktion (LVEF) festgemacht. Die phänotypische Einteilung in Herzinsuffizienz mit reduzierter EF (HFrEF), Herzinsuffizienz mit erhaltener EF (HFpEF) und, seit Neuestem, Herzinsuffizienz mit gering reduzierter EF (HFmrEF) sind Teil der universellen Definition der Herzinsuffizienz1 und ein Eckpfeiler der aktuellen Leitlinien.2 Die LVEF-basierte Taxonomie und die damit verbundene Vorstellung, dass es sich hier um voneinander unabhängige Erkrankungsentitäten handelt, geraten allerdings zunehmend ins Wanken.3–5 Die Kritik reicht von der Unzulänglichkeit und der Unschärfe in der Festlegung der LVEF an sich bis zu der Vielzahl an Risikofaktoren und Umständen, welche den Krankheitsverlauf beeinflussen können.
Pathophysiologie
Die EF ist der prozentuelle Anteil des Schlagvolumens (SV) am enddiastolischen Volumen (EDV). Einschätzung und Beurteilung des physiologisch und klinisch relevanten SV sind daher ohne die Kenntnis des EDV nicht möglich. Bei identischer EF ist das SV bei großem EDV höher als bei kleinem EDV. Die EF wird zudem von Vor- und Nachlast bestimmt und kann daher nur in Kenntnis dieser Größen als indirektes Maß der Kontraktilität herangezogen werden. Die LVEF ist also vielmehr ein Maß für das LV-Remodeling als für die Kontraktilität.
Pathologische Hypertrophie und Fibrose, die bei den meisten Patienten mit HI vorliegen, sind sowohl mit einer Einschränkung der Kontraktilität als auch der Relaxation verbunden. Man kann also nicht automatisch davon ausgehen, dass eine niedrige EF mit ausschließlich systolischer und eine höhere EF mit ausschließlich diastolischer Dysfunktion verbunden ist.
Unschärfe der Messung
Die numerische Festlegung der EF ist mit substanzieller Unschärfe verbunden. Der ermittelte Wert ist abhängig von der eingesetzten Bildgebung und, im Falle der Echokardiografie, von der Schallqualität und nicht zuletzt vom Untersucher.
Willkürlicher Grenzwert
Die LVEF-basierte Taxonomie ist Grundlage für medikamentöse und Device-Therapie, wobei die empfohlenen Grenzwerte auf Studiendaten beruhen. Der mehr oder weniger willkürlich festgelegte Cut-off von 35% bzw. 40% geht auf die ersten ACEi-Studien zurück und wurde dabei bewusst niedrig gewählt, um so eine ausreichend hohe Zahl an Endpunkten für die Erreichung einer statistischen Signifikanz sicherzustellen.
Änderung über die Zeit
Erwähnenswert ist, dass sich die LVEF bei vielen Patienten dynamisch über die Zeit verändert. Es ist sowohl eine Transition von einer höheren zu einer niedrigeren EF als auch umgekehrt möglich. Auch bei Patienten mit vorwiegend rechtsventrikulärer Pathologie erweist sich die EF-basierte Kategorisierung als unzureichend.
Kein Rückschluss zwischen EF und zugrunde liegender Erkrankung
Schließlich halten sich die der HI zugrunde liegenden Erkrankungen nicht an die willkürlichen Grenzwerte, sodass weder von der EF auf die Erkrankung noch von der Erkrankung auf die EF Rückschlüsse möglich sind.
Therapiewahl
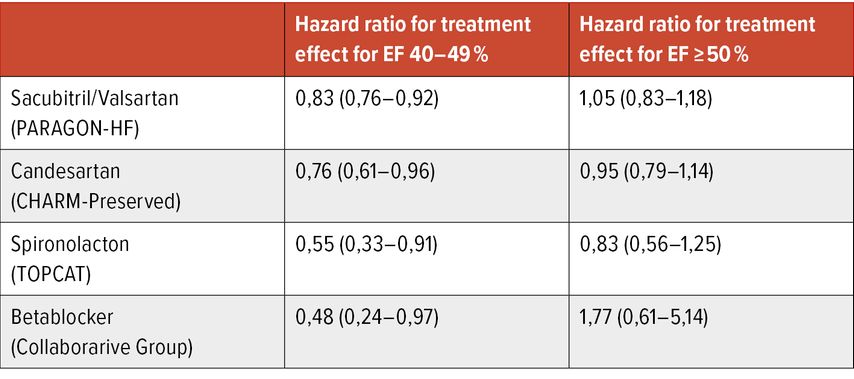
Studien der letzten Jahre haben gezeigt, dass sich auch die medikamentöse Therapie nicht an die EF-Taxonomie hält. Sowohl für ARNI (PARAGON-HF), ARBs (CHARM-Preserved), MRAs (TOPCAT) als auch für Betablocker (Collaborative Group) konnte ein positiver Behandlungseffekt zumindest bei Patienten mit HFmrEF gezeigt werden (Tab. 1). Für den SGLT2-Hemmer Empaglifozin liegen ausreichende Studienbelege für einen positiven Behandlungseffekt bei HFrEF, HFmrEF und HFpEF vor.
Risikostratifizierung nach EF und zugrunde liegender Pathologie
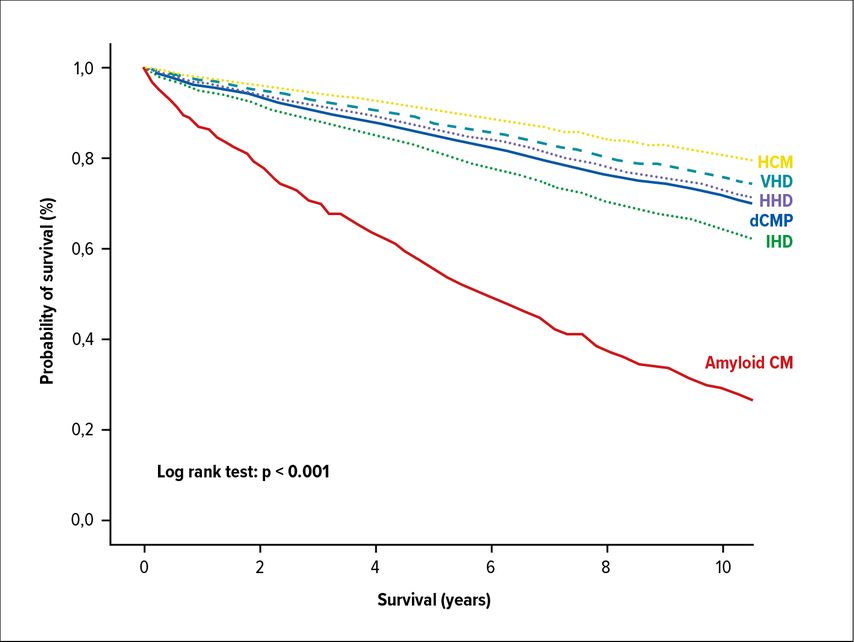
Was nun die Risikostratifizierung betrifft, besteht ein klarer Zusammenhang zwischen EF und Mortalität.6 Allerdings zeigt sich ein ebenso klarer Zusammenhang zwischen der zugrunde liegenden Ätiologie und der Mortalität. Bestimmte Erkrankungen wie etwa die kardiale Amyloidose oder auch die koronare Herzerkrankung weisen einen wesentlich ungünstigeren Verlauf auf als beispielsweise die sarkomerische hypertrophe Kardiomyopathie (HCM) (Abb. 1).6
Abb. 1: Zusammenhang zwischen HI-Ätiologie und Mortalität (HCM, hypertrophe CMP; VHD, valvuläre Herzerkrankung; HHD, hypertensive Herzerkrankung; dCMP, dilatitive CMP; IHD, ischämische Herzerkrankung; Amyloid CM, kardiale Amyloidose). Aus [6]: Open-access-Publikation, Copyright © 2020 The Authors ESC Heart Failure published by John Wiley & Sons Ltd on behalf of the European Society of Cardiology
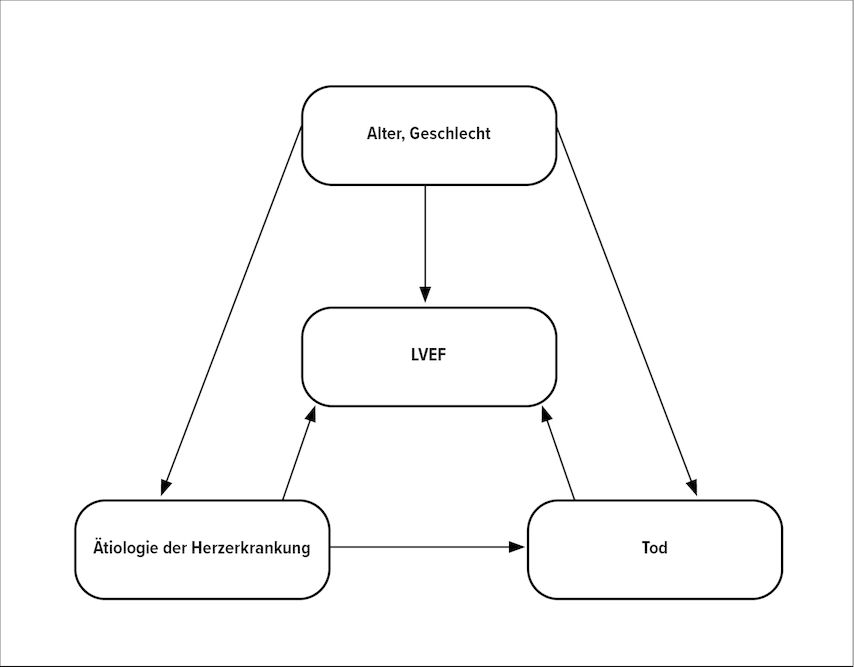
In einem aktuellen Studienprojekt sind wir der Frage nachgegangen, ob bei bekannter Ätiologie die EF tatsächlich noch eine zusätzliche Information bei der Risikostratifizierung liefert (Abb. 2). Dabei zeigte sich, dass die kardiale Amyloidose (CA) und die sehr häufige ischämische Herzerkrankung (IHD) mit einer ungünstigeren Prognose als andere Ätiologien assoziiert sind. Diese Unterschiede sind durch Unterschiede in der EF nicht erklärbar: Bei IHD konnten 85% des Effekts auf die Mortalität durch die Ätiologie erklärt werden, bei der CA waren das 100%. Bei dCMP, HCM, hypertensiver (HHD) und valvulärer Herzerkrankung (VHD) war der Anteil des indirekten Effekts der EF auf die Prognose nicht signifikant. Somit spielt die Kenntnis der zugrunde liegenden Ätiologie eine entscheidende Rolle in der Risikostratifizierung bei Herzinsuffizienz. Dies gilt ebenso für Therapieentscheidungen: Neben der interventionellen oder chirurgischen Revaskularisation bzw. Korrektur bei IHD bzw. VHD sind seit Kurzem mit Tafamidis bei der CA und Mavacamten bei der HCM Ätiologie-spezifische Behandlungen verfügbar. Das ist auch für andere Ätiologien in absehbarer Zukunft zu erwarten.
Fazit für die Praxis
Die LVEF als der „heilige Gral“ im Management der Herzinsuffizienz gerät zunehmend ins Wanken. Das heißt nicht, dass die Beurteilung der LVEF nicht sinnvoll ist. Aber: Die exakte Abklärung der zugrunde liegenden Ätiologie ist sowohl für die Risikostratifizierung als auch für die Festlegung der Therapie ebenso wichtig.
Quelle:
Der Artikel ist erschienen in: wmw-skriptum 2022; 19(1): 8-10. Abdruck mit freundlicher Genehmigung
Literatur:
1 Bozkurt B et al.: Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure: Endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association. Eur J Heart Fail 2021; 23(3): 352-80 2 McDonagh TA et al.: ESC Scientific Document Group 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42(36): 3599-726 3 Konstam MA, Abboud FM: Ejection fraction: misunderstood and overrated (changing the paradigm in categorizing heart failure). Circulation 2021; 135(8): 717-19 4 Marwick TH: Ejection fraction pros and cons: JACC state-of-the-art review. J Am Coll Cardiol 2018; 72(19): 2360-79 5 Triposkiadis F et al.: The continuous heart failure spectrum: moving beyond an ejection fraction classification. Eur Heart J 2019; 40(26): 2155-63 6 Kocher F et al.: Heart failure from ATTRwt amyloid cardiomyopathy is associated with poor prognosis. ESC Heart Fail 2020; 7(6): 3919-28
Das könnte Sie auch interessieren:
Funktionsstörung des Myokards: wenn die Entspannung des Herzens gestört ist
Die hypertropheobstruktive Kardiomyopathie (HOCM) ist dadurch charakterisiert, dass die Entspannung des Myokards funktionsgestört ist. Die Folge ist eine zunehmende Verdickung der ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...