Kardioembolischer Schlaganfall – State of the Art
Schweizer Herz- und Gefässzentrum,
Universitätsklinik für Kardiologie
Universitätsspital Bern
Inselspital
Leitender Arzt Invasive Kardiologie
Universitätsklinik für Kardiologie
Universitätsspital Bern,
Inselspital
3010 Bern
E-Mail: stefan.stortecky@insel.ch
Weltweit werden pro Jahr mehr als 17 Millionen Menschen mit einem Schlaganfall behandelt. Während die Inzidenz von Schlaganfällen innerhalb der letzten zweieinhalb Dekaden markant angestiegen ist (bis zu 1,8-fach zwischen 1990 und 2013), war über die Zeit ein Rückgang der schlaganfallbedingten Mortalität zu verzeichnen.1 Dennoch ist der ischämische Schlaganfall mit einer Häufigkeit von 11,8 % aller Todesursachen weiterhin die zweithäufigste Todesursache nach der ischämischen Herzerkrankung (14,8 % aller Todesfälle). Zudem gehört der ischämische Schlaganfall zu den häufigsten Ursachen für eine anhaltende Behinderung mit Pflegebedürftigkeit. Die Gesamtzahl der «Lebensjahre mit Behinderung» resp. der Verlust an Lebensjahren in unversehrter Gesundheit («disability-adjusted life years», DALY) wird pro Jahr mit 102 Millionen Lebensjahren weltweit beziffert.
Keypoints
- In den Vereinigten Staaten wird im Durchschnitt alle 40 Sekunden ein Schlaganfall diagnostiziert und alle 4 Minuten stirbt ein Patient daran.
- Der ischämische Schlaganfall ist weltweit die zweithäufigste Todesursache und gehört zu den häufigsten Ursachen für eine bleibende Behinderung mit andauernder Pflegebedürftigkeit.
- Zu den häufigsten Risikofaktoren für einen kardioembolischen Schlaganfall zählt man das Vorhofflimmern, ein persistierendes Foramen ovale, einen frischen akuten Myokardinfarkt, die systolische Herzinsuffizienz sowie Herzklappenerkrankungen.
- Die Optimierung der Diagnostik und Therapie des kardioembolischen Schlaganfalls hat zu einer Reduktion von Mortalität und Morbidität geführt.
- Durch den demografischen Wandel und die zunehmende Alterung der Bevölkerung ist in der nächsten Dekade ein Anstieg der globalen Schlaganfallinzidenz zu erwarten.
Dank der Verbesserung von Prävention, Diagnostik und Behandlung des akuten Schlaganfalls ist ein Rückgang der Mortalität und der DALY zu beobachten. Zudem hat die Einführung integrierter Behandlungskonzepte in spezialisierten «Stroke Units» zu einer frühzeitigen und effizienten, zielgerichteten Behandlung dieser Patienten geführt. Während die Optimierung der Behandlungskonzepte zu einer Verbesserung der Behandlungsqualität mit Reduktion von Morbidität und Mortalität führte, verzeichnet man dennoch einen Anstieg der globalen Schlaganfallinzidenz.2 Für das Jahr 2030 wird eine Gesamtzahl von 12 Millionen Todesfällen und mehr als 200 Millionen DALY aufgrund eines zerebrovaskulären Insults prognostiziert. Eine Entwicklung, die vor allem auf die demografischen Veränderungen und die zunehmende Alterung der Bevölkerung zurückzuführen ist. Während aktuell noch vornehmlich ältere Menschen von einem Schlaganfall betroffen sind – in industrialisierten Ländern lag der Altersdurchschnitt im Jahr 2010 bei 74,5 Jahren –, beobachtet man steigende Fallzahlen auch bei Menschen zwischen 20 und 64 Jahren. Die zunehmende Prävalenz von kardiovaskulären Risikofaktoren, wie Diabetes mellitus und Adipositas, trägt zu dieser Entwicklung bei und unterstreicht die Notwendigkeit effizienter Präventionsstrategien.
Kardioembolischer Schlaganfall
Bis zu 87 % aller Schlaganfälle sind ischämischer Genese und werden zumeist durch eine Mikro- oder Makroangiopathie oder auch eine kardiale Embolie verursacht.3 Zudem ist in der Liste der möglichen Ursachen auch der kryptogene Schlaganfall, dessen Ätiologie nicht näher definierbar ist, prominent vertreten. Annähernd ein Drittel aller ischämischen Schlaganfälle wird auf eine kardioembolische Genese zurückgeführt, welche im Vergleich zu anderen Ursachen mit einer erhöhten Mortalitätsrate, einem erhöhten Risiko für ein Rezidiv und dem Risiko für eine anhaltende schwere Behinderung verbunden ist.4, 5 Die Klinik der Kardioembolie ist durch einen plötzlichen Beginn der Symptome mit sofortigem Auftreten eines maximalen neurologischen Defizits gekennzeichnet. Häufig sind dabei kortikale Anteile des Gehirns und mehrere Stromgebiete betroffen. Im Gegensatz hierzu stehen die lakunären Infarkte in subkortikalen Bereichen, welche durch Mikroangiopathien verursacht werden. Bildmorphologisch kommt der kardioembolische Schlaganfall oft durch einen kompletten Gefässabbruch ohne vorgeschaltete arteriosklerotische Veränderungen oder Einengung des betroffenen Gefässes zur Darstellung.6 Auch eine hämorrhagische Transformation ist bei emboliebedingten Schlaganfällen nicht selten.
Risikofaktoren
Vorhofflimmern
Vorhofflimmern (VHF) ist die häufigste klinisch relevante Herzrhythmusstörung und betrifft etwa 33 Millionen Menschen weltweit. In den Industrienationen wird bei jedem Vierten im Verlauf seines Lebens ein VHF diagnostiziert. Wenn man das klinisch stumme und das nicht diagnostizierte VHF miteinschliesst, ist schätzungsweise sogar jeder Dritte betroffen. 7 Bei VHF ist das Risiko für einen Schlaganfall um das 3- bis 5-Fache erhöht. 8 Die Erkrankung weist eine altersabhängige Verteilung mit einer deutlichen Zunahme im hohen Lebensalter auf, sodass man aufgrund des demografischen Wandels in den kommenden Jahrzehnten mit einer Verdreifachung der Zahl an Schlaganfällen im Zusammenhang mit VHF rechnet. Das Risiko für einen Schlaganfall ist unabhängig von der Dauer des VHF (chronisch, permanent oder paroxysmal). Bei nur einer einzigen dokumentierten Episode von =6 Minuten Dauer ist das Risiko für einen Schlaganfall um das 2,5-Fache erhöht.9 Ähnliches lässt sich bei sekundärem VHF beobachten, das perioperativ/-interventionell oder im Rahmen einer akuten Erkrankung wie einer Lungenembolie oder Sepsis auftritt. Lange wurde dieses als temporär im Rahmen der Behandlung und als nicht signifikant für das Schlaganfallrisiko eingestuft. Studienresultate bescheinigen dem sekundären VHF jedoch ein nahezu identisches Risiko wie den spontanen VHF-Episoden.10 Die Mechanismen, welche bei VHF zu einem Schlaganfall führen, sind wahrscheinlich komplexer als bisher angenommen. Das Erklärungsmodell einer Thrombenbildung durch Blutstase bei insuffizienter Vorhofkontraktion scheint nicht auszureichen, da hier unter anderem auch atriale Abnormitäten wie endotheliale Dysfunktion, Fibrose, atriale Dilatation und mechanische Dysfunktion im Bereich des linken Vorhofsohrs eine Rolle spielen.11 Das VHF kann zu einer Vergrösserung des linken Vorhofes führen und die linksatriale Dilatation selbst wurde auch als unabhängiger Risikofaktor für einen Schlaganfall identifiziert.
Persistierendes Foramen ovale
Lange wurde über eine Assoziation zwischen persistierendem Foramen ovale (PFO) und kryptogenem Schlaganfall diskutiert, der direkte Zusammenhang konnte aber erst kürzlich durch Studien mit interventionellem PFO-Verschluss bestätigt werden.12 Das Foramen ovale ist eine türartige Verbindung zwischen dem rechten und linken Vorhof und ermöglicht die fetale Zirkulation und die direkte Blutpassage auf die linke Herzseite unter Umgehung der fetalen Lunge. Durch die Veränderung der intrakardialen Druckverhältnisse kurz nach der Geburt kommt es zu einem Verschluss dieser natürlichen Verbindung und einer direkten Umleitung des venösen Blutflusses durch die entfalteten Lungen. Bei Ausbleiben eines kompletten Verschlusses des Foramen ovale bis zum Ende des ersten Lebensjahrs spricht man von einem persistierenden Foramen ovale (PFO). Ein solches ist häufig und wird bei mehr als einem Viertel der Gesamtbevölkerung vorgefunden.13 In den meisten Fällen bleibt das PFO unentdeckt, im Falle eines kryptogenen Schlaganfalls sollte es jedoch aktiv gesucht werden.14 Mittels Fallberichten konnte die Hypothese eines migrierenden Embolus als paradoxe Embolie durch das PFO bestätigt werden und in Beobachtungsstudien wurden klinische und echokardiografische Risikokonstellationen identifiziert. Der RoPE(«risk of paradoxical embolism»)-Score fasst die wichtigsten Parameter in einem Algorithmus zusammen und hilft bei der Abschätzung der Wahrscheinlichkeit des PFO als Ursache des kryptogenen Schlaganfalls (Tab. 1).15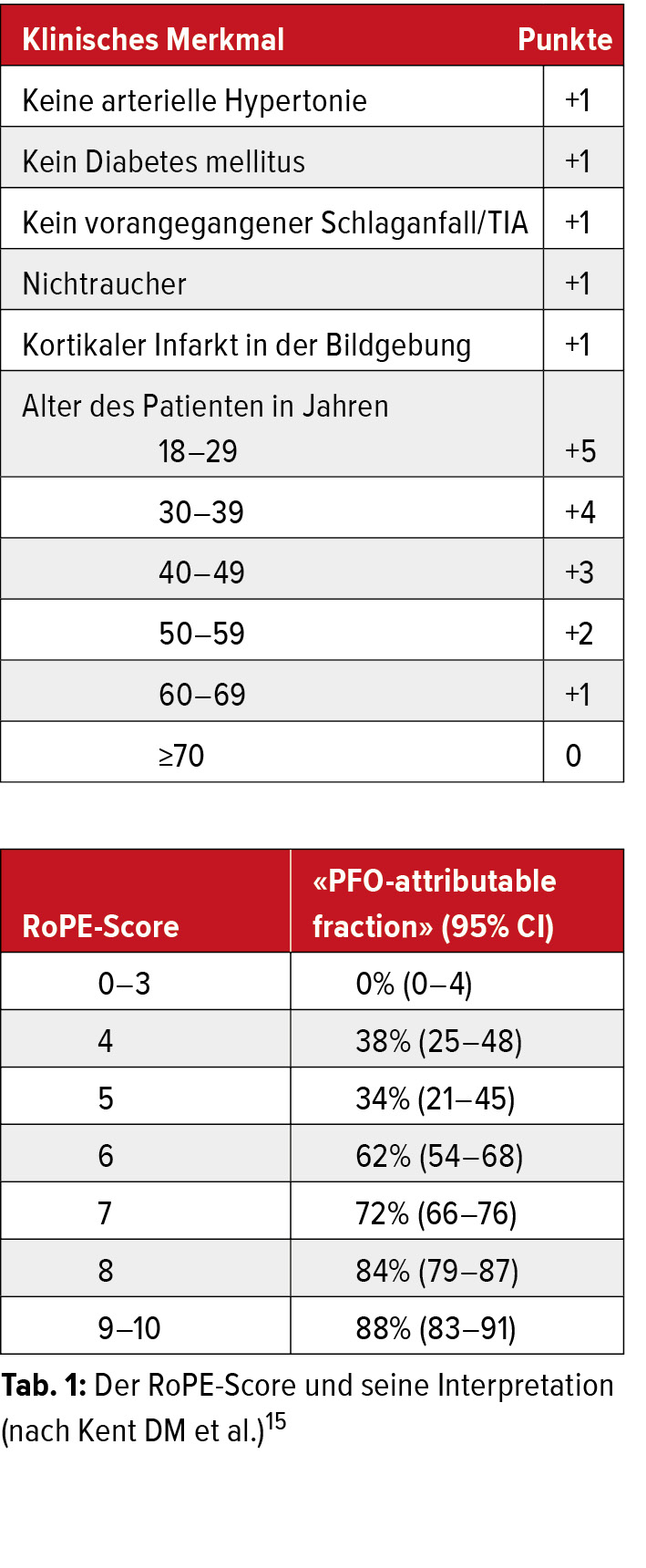
Akutes Koronarsyndrom
Speziell in den ersten Tagen nach einem akuten Koronarsyndrom sind die betroffenen Patienten einem erhöhten Risiko für einen Schlaganfall ausgesetzt. 16 Dies wird am ehesten auf eine intrakardiale Thrombenbildung in betroffenen Myokardarealen zurückgeführt.17 Auch ischämisch getriggerte Phasen von VHF tragen zu einem erhöhten Schlaganfallrisiko bei. Besonders betroffen sind Patienten nach einem akuten Myokardinfarkt mit relevantem Myokardschaden (NSTEMI oder STEMI) und Einschränkung der systolischen linksventrikulären Funktion. Hier ist das Risiko bis zu viermal höher im Vergleich zu einem akuten Koronarsyndrom ohne nachweisbare Schädigung, wie einer instabilen Angina pectoris.18 Prädisponierende Faktoren für einen Schlaganfall nach Myokardinfarkt umfassen fortgeschrittenes Alter, weibliches Geschlecht, das Vorliegen eines Diabetes mellitus oder einen früheren Schlaganfall in der Vorgeschichte.18 Insgesamt beobachtet man in den letzten zwei Jahrzehnten einen Rückgang der Schlaganfälle nach Myokardinfarkt. Diese Reduktion lässt sich durch die Verbesserung der Behandlungsstrategien beim akuten Myokardinfarkt mit rascher koronarer Reperfusion und somit insgesamt kleinerem Myokardschaden erklären. Die perkutane Koronarintervention konnte dabei als unabhängiger Faktor für die Reduktion der Schlaganfallzahlen nach Myokardinfarkt identifiziert werden.19
Intrakardiale Thromben
Auch intrakardiale Thromben anderer Genese können die Ursache für einen kardioembolischen Schlaganfall sein. Dabei sind die Ursachen für die Entstehung eines Thrombus vielfältig und reichen von strukturellen Herzerkrankungen wie primär dilatativer Kardiomyopathie, linksventrikulären Aneurysmen und Klappenvitien über Device-assoziierte Thromben bis hin zu Systemerkrankungen, wie der Amyloidose oder einem metastasierten Tumorleiden. Unabhängig von der zugrundeliegenden Ursache ist jedoch die Herzinsuffizienz ein treibender Faktor für einen Schlaganfall und betroffene Patienten haben ein bis zu dreifach erhöhtes Risiko.20
Klappenerkrankungen
Klappenerkrankungen sind häufig und bei etwa 12,5 % der älteren Bevölkerung (=75 Jahre) zu finden. Während Patienten mit degenerativer Herzklappenerkrankung per se ein deutlich erhöhtes Spontanrisiko für einen Schlaganfall haben, findet sich dieses auch nach Herzklappenersatz. Patienten mit mechanischem Herzklappenersatz sind hiervon besonders betroffen, Patienten mit Bioprothesen jedoch nicht ausgeschlossen. Die infektiöse Endokarditis (IE) stellt unter den Klappenerkrankungen einen Sonderfall dar, da sie mit einem überdurchschnittlich hohen Schlaganfallrisiko verbunden ist – etwa 25 % aller Patienten mit einer IE erleiden einen Schlaganfall.21 Das Risiko ist fünf Monate vor und nach der Diagnosestellung hoch und kann im ersten Monat bis auf das 20-Fache ansteigen.22
Diagnostik
Zu den Standarduntersuchungen nach einem Schlaganfall gehören neben der zerebralen Bildgebung mit Computertomografie und Magnetresonanztomografie eine vaskuläre Beurteilung mit Untersuchung der extrakraniellen, hirnversorgenden Gefässe und eine umfassende kardiale Diagnostik. Während in der transthorakalen Echokardiografie grosse ventrikuläre Thromben oder Klappenvegetationen ausgeschlossen werden können, wird zur detaillierteren Abklärung die Durchführung einer transösophagealen Echokardiografie (TEE) empfohlen. Nur mit dieser Bildgebung können residuelle Thromben im linken Vorhofohr («left atrial appendage », LAA) und ursächliche Klappenvegetationen oder adhärente Fibroelastome ausgeschlossen werden. Zudem ermöglicht die TEE eine hochauflösende Darstellung des interatrialen Septums zur Beurteilung eines möglichen PFO und potenziell vorhandener flottierender Plaques im Bereich des herznahen aszendierenden Aortenbogens als weiterer möglicher Ursache für eine Kardioembolie.23 Sollten während der echokardiografischen Diagnostik eine Einschränkung der linksventrikulären Funktion oder pathologische Regionalitäten beobachtet werden, ist eine weitergehende Ischämiediagnostik, eine Herzkatheteruntersuchung oder auch eine strukturelle Beurteilung des Myokards mittels kardialer Magnetresonanztomografie notwendig.
Zur Komplettierung der kardialen Diagnostik ist eine Rhythmusdiagnostik unumgänglich. Für die Erkennung eines paroxysmalen VHF wird ein verlängertes Monitoring des Herzrhythmus empfohlen. Häufig erfolgen noch während der initialen Hospitalisation ein Holter-EKG und die Überwachung des Herzrhythmus über 24 Stunden. Damit kann bei initial unklarer Genese des Schlaganfalls bereits bei 2–3 % der Patienten ein ursächliches VHF entdeckt werden. Bei längerer Überwachung und kardialem Rhythmusmonitoring über 30 Tage steigt die Anzahl der detektierten Fälle auf bis zu 16 % bei Patienten mit vermutetem kryptogenem Schlaganfall. Dies kann durch die wiederholte Durchführung eines R-Tests (7-Tage-Langzeit-EKG) bewerkstelligt werden. Nach Implantation eines Ereignis-Rekorders («implantable cardiac monitor», ICM) erhöht sich die Nachweisrate eines VHF nach kryptogenem Schlaganfall bis auf 30 % .24
Therapeutische Möglichkeiten und Sekundärprävention des Schlaganfalls
Die präzise Diagnostik und Identifizierung der dem Schlaganfall zugrundeliegenden Risikofaktoren sind Voraussetzung für eine adäquate Behandlung und die Prävention eines erneuten Ereignisses.
Therapeutische Antikoagulation
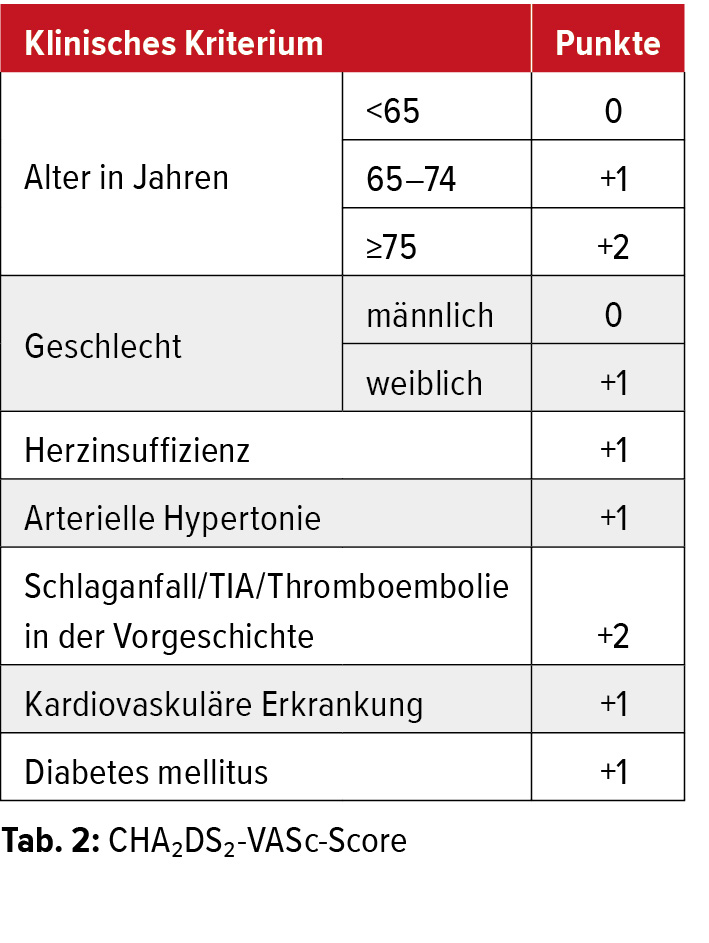
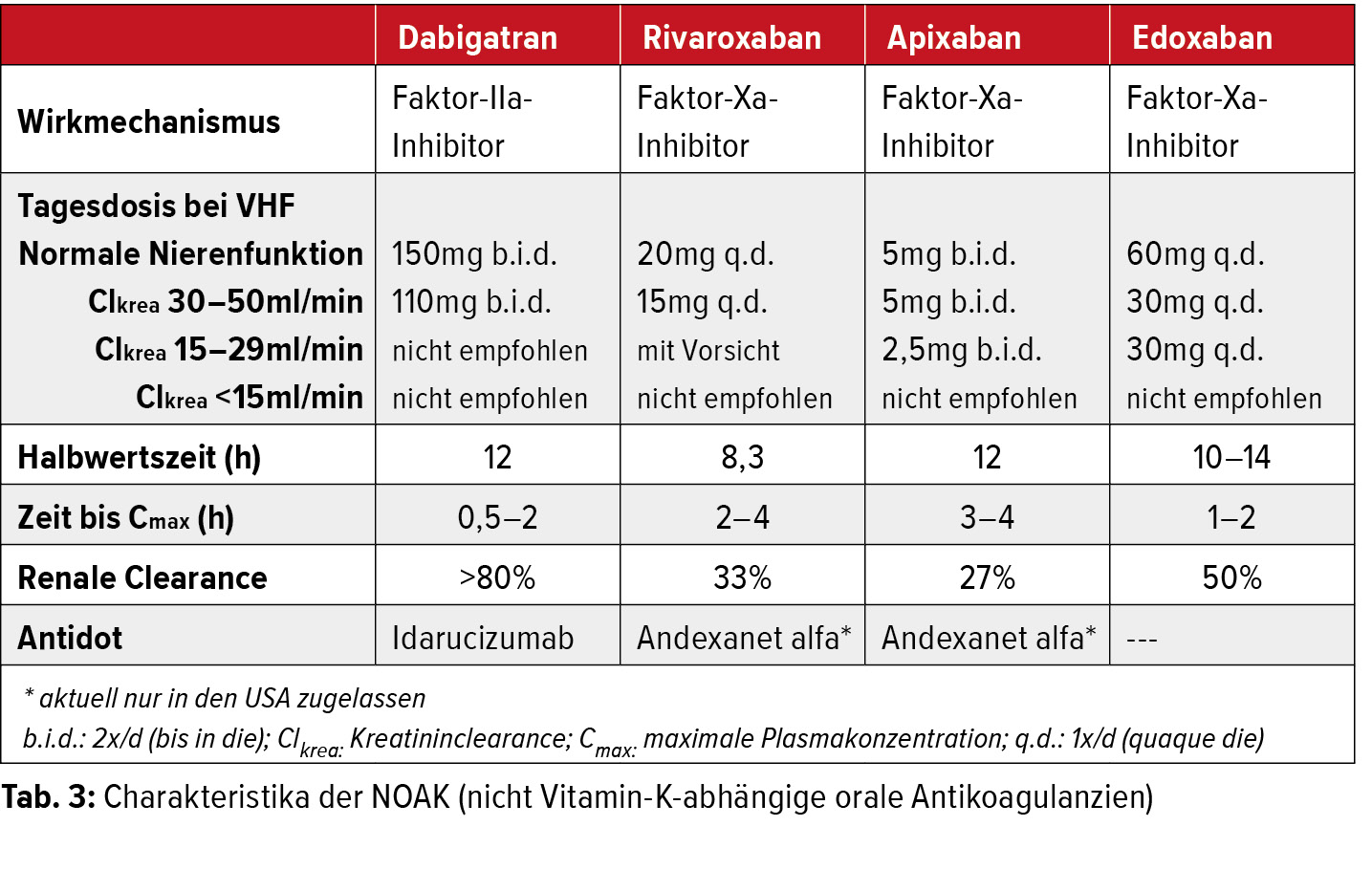
Die therapeutische Antikoagulation ist die Hauptsäule der Prävention des kardioembolischen Schlaganfalls. Bei nachgewiesenem VHF erfolgt die Indikationsstellung für eine Antikoagulation mittels des CHA2DS2-VASc-Scores (Tab. 2). Laut den aktuellen Richtlinien der Europäischen Gesellschaft für Kardiologie (ESC) sollte bereits ab einem Score von =2 Punkten eine Antikoagulation in Betracht gezogen werden. Der richtige Zeitpunkt für den Beginn einer therapeutischen Antikoagulation sollte gemeinsam mit den Kollegen der Neurologie und unter Berücksichtigung des individuellen Blutungsrisikos abgestimmt werden.25 Während durch eine suffiziente Antikoagulation ein Schlaganfallrezidiv effizient vermieden werden kann (relative Risikoreduktion von 62 % bei absoluter Risikoreduktion von 8,4 % pro Jahr in der Sekundärprophylaxe), ist die alleinige plättchenhemmende Therapie keine ausreichende Behandlung. Durch den alleinigen Einsatz niedrig dosierter Acetylsalicylsäure wird lediglich eine Risikoreduktion von 22 % erreicht, welche auch durch Kombination mit dem P2Y12-Inhibitor Clopidogrel nur marginal ansteigt.26 Erfolgte die Antikoagulation früher ausschliesslich mit Vitamin- K-Antagonisten (z.B. Marcoumar®), werden diese heute nur noch in Ausnahmefällen bei Patienten mit einer mechanischen Herzklappe und bei schwerer Niereninsuffizienz verwendet. Neuere orale Antikoagulanzien (nicht Vitamin-K-abhängige orale Antikoagulanzien, NOAK) haben sich in randomisierten Studien als ebenbürtig in der Prävention des Schlaganfalls bei Patienten mit VHF erwiesen und werden vor allem aufgrund ihres günstigen Nebenwirkungsprofils als Mittel der Wahl eingesetzt (Tab. 3). NOAK haben den Vorteil, dass keine regelmässigen Laborkontrollen benötigt werden, dass sie weniger störanfällig in Bezug auf Nahrungsgewohnheiten und Komedikation sind und eine grössere therapeutische Breite bei weniger inter- und intraindividueller Variabilität aufweisen. Andererseits sind sie jedoch teurer und erfordern aufgrund der meist zweimal täglich erfolgenden Einnahme eine gute Compliance der Patienten. Unverträglichkeiten oder ein erhöhtes Blutungsrisiko sind häufig genannte Gegenargumente für eine therapeutische Antikoagulation bei Patienten mit VHF.
Interventionelle Massnahmen
Eine mechanische Alternative zur Antikoagulation ist der interventionelle Verschluss des linken Vorhofohrs mit einem speziellen LAA-Okkluder. Dabei wird das Vorhofohr als häufiger Entstehungsort für atriale Thromben bei Patienten mit VHF mittels eines eigens konzipierten LAASchirms verschlossen. Obwohl in randomisierten Studien die Effektivität und Sicherheit dieser Methode nachgewiesen worden sind,27 sind die europäischen Richtlinien zur Behandlung des VHF hier zurückhaltend und geben lediglich eine vorsichtige Empfehlung für den LAA-Verschluss (IIb-Empfehlung) bei Patienten mit einer Kontraindikation für eine orale Langzeitantikoagulation.25
Der interventionelle PFO-Verschluss war lange Zeit Gegenstand angeregter Diskussionen. Mehrere randomisierte Studien waren in der Vergangenheit nicht in der Lage, eine signifikante Überlegenheit des PFO-Verschlusses gegenüber der medikamentösen Therapie (Antikoagulation oder Plättchenhemmung) zu zeigen. Bedingt durch eine niedrige Rezidivrate (0,98 % pro Jahr) waren diese Studien zum Teil inadäquat gepowert, weshalb eine statistische Überlegenheit des PFO-Verschlusses nur in Metaanalysen gezeigt werden konnte.12 Neben dem zunehmenden Beobachtungszeitraum für die damaligen Studienteilnehmer konnten hier neuere Studien Klarheit bringen und den Nutzen des PFO-Schirmverschlusses und dessen Überlegenheit gegenüber einer alleinigen medikamentösen Therapie in der Sekundärprophylaxe eines erneuten Hirnschlages auch statistisch nachweisen.28
1 Feigin VL et al.: Update on the global burden of ischemic and hemorrhagic stroke in 1990-2013: the GBD 2013 study. Neuroepidemiology 2015; 45: 161-76 2 Feigin VL et al.: Global and regional burden of stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet 2014; 383: 245-54 3 Roger VL et al.: Heart disease and stroke statistics--2011 update: a report from the American Heart Association. Circulation 2011; 123: e18-e209 4 Jones SB et al.: Poststroke outcomes vary by pathogenic stroke subtype in the Atherosclerosis Risk in Communities Study. Stroke 2013; 44: 2307-10 5 Sandercock P et al.: Atrial fibrillation and stroke: prevalence in different types of stroke and influence on early and long term prognosis (Oxfordshire community stroke project). BMJ 1992; 305: 1460-5 6 Timsit SG et al.: Early clinical differentiation of cerebral infarction from severe atherosclerotic stenosis and cardioembolism. Stroke 1992; 23: 486-91 7 Chugh SS et al.: Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation 2014; 129: 837-47 8 Wolf PA et al.: Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22: 983-8 9 Healey JS et al.: Subclinical atrial fibrillation and the risk of stroke. N Engl J Med 2012; 366: 120-9 10 Gialdini G et al.: Perioperative atrial fibrillation and the longterm risk of ischemic stroke. JAMA 2014; 312: 616-22 11 Vaziri SM et al.: Echocardiographic predictors of nonrheumatic atrial fibrillation. The Framingham Heart Study. Circulation 1994; 89: 724-30 12 Stortecky S et al.: Percutaneous closure of patent foramen ovale in patients with cryptogenic embolism: a network meta-analysis. Eur Heart J 2015; 36: 120-8 13 Windecker S et al.: Paradoxical embolism. J Am Coll Cardiol 2014; 64: 403-15 14 Alsheikh- Ali AA et al.: Patent foramen ovale in cryptogenic stroke: incidental or pathogenic? Stroke 2009; 40: 2349- 55 15 Kent DM et al.: An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. Neurology 2013; 81: 619-25 16 Mooe T et al.: Ischemic stroke after acute myocardial infarction. A populationbased study. Stroke 1997; 28: 762-7 17 Kupper AJ et al.: Left ventricular thrombus incidence and behavior studied by serial two-dimensional echocardiography in acute anterior myocardial infarction: left ventricular wall motion, systemic embolism and oral anticoagulation. J Am Coll Cardiol 1989; 13: 1514-20 18 Yaghi S et al.: Ischemic stroke risk after acute coronary syndrome. J Am Heart Assoc 2016; 5: pii: e002590 19 Ulvenstam A et al.: Incidence, trends, and predictors of ischemic stroke 1 year after an acute myocardial infarction. Stroke 2014; 45: 3263-8 20 Witt BJ et al.: Ischemic stroke after heart failure: a community-based study. Am Heart J 2006; 152: 102-9 21 Garcia-Cabrera E et al.: Neurological complications of infective endocarditis: risk factors, outcome, and impact of cardiac surgery: a multicenter observational study. Circulation 2013; 127: 2272-84 22 Merkler AE et al.: Temporal relationship between infective endocarditis and stroke. Neurology 2015; 85: 512-6 23 Pearson AC et al.: Superiority of transesophageal echocardiography in detecting cardiac source of embolism in patients with cerebral ischemia of uncertain etiology. J Am Coll Cardiol 1991; 17: 66-72 24 Sanna T et al.: Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014; 370: 2478-86 25 Kirchhof P et al.: 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37: 2893-962 26 Connolly SJ et al.: Net clinical benefit of adding clopidogrel to aspirin therapy in patients with atrial fibrillation for whom vitamin K antagonists are unsuitable. Ann Intern Med 2011; 155: 579-86 27 Reddy VY et al.: Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: a randomized clinical trial. JAMA 2014; 312: 1988-98 28 Mas JL et al.: Patent foramen ovale closure or anticoagulation vs. antiplatelets after stroke. N Engl J Med 2017; 377: 1011-21
Das könnte Sie auch interessieren:
Funktionsstörung des Myokards: wenn die Entspannung des Herzens gestört ist
Die hypertropheobstruktive Kardiomyopathie (HOCM) ist dadurch charakterisiert, dass die Entspannung des Myokards funktionsgestört ist. Die Folge ist eine zunehmende Verdickung der ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...