Neue Antibiotika gegen multiresistente Erreger
Autor:
PD Dr. med. Michael Osthoff
Leitender Arzt
Abteilung für Innere Medizin
Universitätsspital Basel
Spitalstrasse 21, 4031 Basel
E-Mail: michael.osthoff@usb.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Antibiotikaresistenzen stellen ein immer grösseres Problem dar. Neue Antibiotika mit zum Teil neuartigem Wirkmechanismus sind ein Teil der Lösung dieses Problems.
Keypoints
-
Neue Antibiotika gegen resistente Erreger sind auch in der Schweiz verfügbar.
-
Es empfiehlt sich, diese in der Regel nur bei Nachweis (oder hohem Verdacht) eines resistenten Erregers einzusetzen und dabei die Verabreichung im Sinne einer ausreichend hohen Dosierung und verlängerten Infusion zu optimieren.
-
Ceftarolin: Aktivität gegen MRSA (Kombinationstherapie) und Penicillin-resistente Pneumokokken
-
Ceftolozan/Tazobactam: in erhöhter Dosierung v.a. bei multiresistenten P.-aeruginosa-Infektionen wirksam
-
Ceftazidim/Avibactam und Meropenem/Vaborbactam: Aktivität gegenüber vielen, auch Carbapenemase-produzierenden, multiresistenten aeroben Gram-negativen Bakterien
-
Cefiderocol: neuer Wirkmechanismus, aktiv gegen fast alle multiresistenten, aeroben Gram-negativen Erreger; Ergebnisse zukünftiger Studien bleiben abzuwarten.
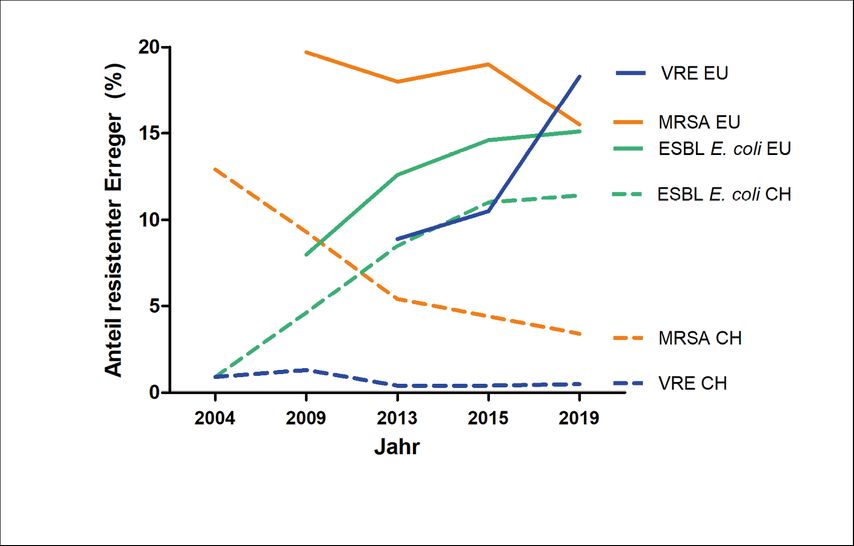
Weltweit sind Bakterien, die gegen gängige Antibiotika resistent sind, auf dem Vormarsch. Nicht selten verursachen diese Erreger bei ohnehin schon schwer kranken Patienten Infektionen, die mit herkömmlichen Antibiotika kaum oder nicht mehr behandelbar sind. Infektionen mit resistenten Erregern sind mit einer deutlich erhöhten Morbidität und Mortalität assoziiert. In Europa versterben jährlich bis zu 33000 Menschen direkt an den Folgen einer Infektion mit Antibiotika-resistenten Erregern.1 Ohne Massnahmen werden im Jahr 2050 mehr Menschen an Infektionen mit Antibiotika-resistenten Erregern versterben als an Krebserkrankungen. Dies trifft v.a. auf Infektionen mit multiresistenten Gram-negativen Bakterien zu, wie z.B. Carbapenem-resistenten Enterobacterales, Pseudomonas aeruginosa oder Acinetobacter baumannii. Auch wenn die Rate an resistenten Erregern in der Schweiz im europäischen Vergleich niedrig ist (Abb. 1), ist das Problem allgegenwärtig: sei es bei der fehlenden oralen Therapieoption bei einem an sich banalen Harnwegsinfekt (HWI) oder bei einer fast nicht mehr oder nur mit potenziell toxischen Antibiotika (z.B. Colistin) zu behandelnden Infektion mit multiresistenten Gram-negativen Bakterien bei einem aus dem Ausland repatriierten Patienten.
Abb. 1: Anteil Antibiotika-resistenter Erreger in der Schweiz und in der Europäischen Union (Mittelwert). Quelle: Anresis.ch, Swiss Antibiotic Resistance Report 2020 und European Centre for Disease Prevention and Control
Massnahmen zur Bekämpfung der zunehmenden Antibiotikaresistenzen beinhalten u.a.
-
die koordinierte Überwachung resistenter Erreger auf nationaler und internationaler Ebene,
-
den rationalen Gebrauch von Antibiotika in der Human- und Tiermedizin sowie in der Landwirtschaft sowie
-
die Entwicklung neuer Antibiotika mit Aktivität gegen resistente Erreger.
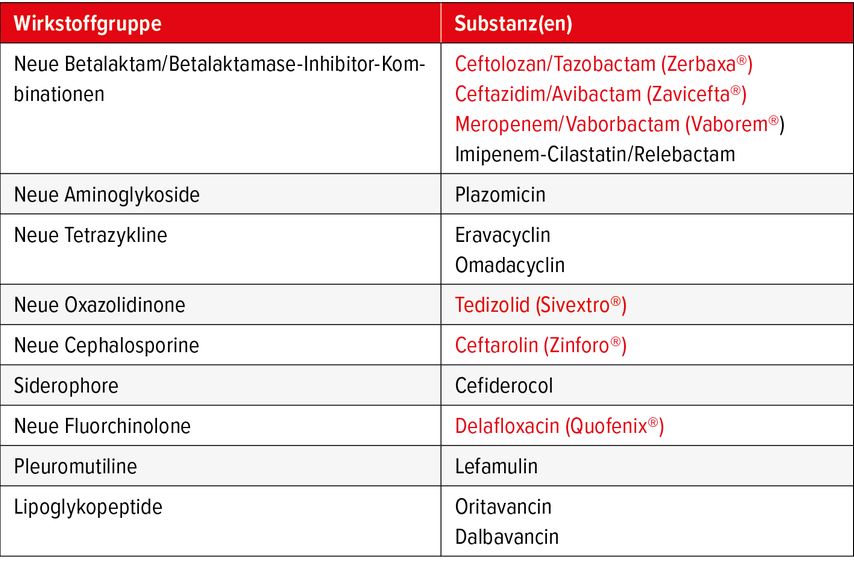
Neue Antibiotika wurden lange als die vordringliche Massnahme angesehen, um resistente Erreger zu bekämpfen. Bei den meisten neu eingeführten Antibiotika traten jedoch sehr schnell Resistenzen auf. Dies ist nicht erstaunlich, sind Bakterien doch sehr anpassungsfähig und Antibiotikaresistenzgene mobil oder schon seit Jahrtausenden in der Natur zu finden.2 Die Entwicklung neuer Antibiotika ist aufwendig und teuer, zudem ist ihr Einsatzgebiet und damit der wirtschaftliche Erfolg häufig beschränkt. Dies führte dazu, dass die Pipeline der neuen Antibiotika vor 15 Jahren praktisch ausgetrocknet war. Durch entsprechende Initiativen (z.B. die «10x ’20 Initiative» der Infectious Diseases Society of America3) und Förderprogramme gelang es, mehr als zehn neue Antibiotika auf den Markt zu bringen (Tab. 1), die ein erweitertes Spektrum besitzen und Infektionen mit resistenten Erregern häufig wieder behandelbar machen. In diesem Zusammenhang ist es wichtig zu betonen, dass diese Antibiotika bei Antibiotika-empfindlichen Erregern in der Regel keine Vorteile gegenüber etablierten Antibiotika haben und infolgedessen mit wenigen Ausnahmen nur bei Nachweis eines resistenten Erregers bzw. bei hohem Verdacht (z.B. bekannte Kolonisation mit resistentem Erreger) und nicht in der empirischen Therapie verwendet werden. Dies, um einen rationalen Gebrauch dieser Reserveantibiotika zu gewährleisten und einer Resistenzentwicklung vorzubeugen, vor der auch diese neuen Antibiotika nicht geschützt sind.
Tab. 1: Übersicht über die seit 2010 von der U.S. Food and Drug Administration zugelassenen neuen Antibiotika. In Rot die Antibiotika, die auch in der Schweiz durch Swissmedic zugelassen wurden
Ceftarolin – ein 5.-Generations-Cephalosporin mit erweitertem Gram-positivem Spektrum
Ceftarolin ist in der Schweiz in einer Dosierung von 2x600mg i.v. zur Behandlung komplizierter Haut- und Weichteilinfektionen und ambulant erworbener Pneumonien zugelassen. Interessant ist in diesem Zusammenhang die Aktivität gegenüber Methicillin-resistenten Staphylokokken (Staphylococcus aureus [MRSA] und Koagulase-negativen Staphylokokken [MRSE]) und Penicillin-resistenten Pneumokokken (PRSP). Da es Alternativen gibt (u.a. Daptomycin, Vancomycin und Linezolid bei MRSA/MRSE bzw. Vancomycin bei PRSP) bzw. die Inzidenz von Infektionen mit z.B. PRSP in der Schweiz niedrig ist, eignet sich Ceftarolin nicht für den empirischen Einsatz. Interessant ist die für Betalaktame hohe Penetration in das Zentralnervensystem (17% bei entzündeten Meningen), sodass ein Einsatz bei ZNS-Infektionen mit resistenten Gram-positiven Erregern sinnvoll erscheint (allerdings in einer höheren als der zugelassenen Dosierung: 3x600mg). Zudem gibt es erste Daten, dass Ceftarolin ein geeigneter Partner bei der Kombinationstherapie lebensbedrohlicher Infektionen mit MRSA sein könnte.4
Neue Betalaktam-Betalaktamase-Inhibitor-Kombinationen
Auf diesem Gebiet gab es zweifellos die zahlreichsten Innovationen. Zumeist werden dabei altbekannte Betalaktam-Antibiotika mit neuen Betalaktamase-Inhibitoren (BLI) kombiniert, die gegenüber der Hydrolyse durch Betalaktamasen stabiler sind.
Bei Ceftolozan/Tazobactam wurde hingegen ein altbewährter BLI (Tazobactam) mit einem neuen 5.-Generations-Cephalosporin (Ceftolozan) kombiniert. Ceftolozan/Tazobactam ist in der Schweiz für die Behandlung komplizierter intraabdomineller Infektionen (cIAI) in Kombination mit Metronidazol, komplizierter Harnwegsinfektionen (HWI) und nosokomialer Pneumonien, einschliesslich beatmungsassoziierter Pneumonie, zugelassen. Es ist aktuell das wahrscheinlich wirksamste (wegen geringer Resistenzrate) Antibiotikum zur Behandlung von Infektionen mit multiresistentem P. aeruginosa. In diesem Szenario (und mit einer optimierten Pharmakologie, s.u.) ist eine effektive und weniger toxische Therapie im Vergleich zu der bisher verfügbaren Therapie mit Colistin oder Aminoglykosiden möglich.5 Die Wirksamkeit gegenüber Extended-Spectrum-Betalaktamasen(ESBL)- oder AmpC-produzierenden Erregern ist variabel: höher im Vergleich mit der Kombination Piperacillin/Tazobactam, aber deutlich niedriger als das in der Regel wirksame Meropenem.6 Um zu gewährleisten, dass der Spiegel möglichst lange Zeit über der minimalen Hemmkonzentration der Erreger liegt, ist eine Infusionsdauer von 3Stunden notwendig. Aufgrund der nur 50%igen Penetration in das Lungengewebe wird bei Pneumonien zudem eine doppelt so hohe Dosis (3x2g/1g i.v.) wie bei einem HWI oder einer cIAI (3x1g/0,5g) empfohlen. Grundsätzlich ist aber bei resistenten Erregern immer die doppelte Dosis sinnvoll.7
Bei Ceftazidim/Avibactam bzw. Meropenem/Vaborbactam wird durch den Einsatz neuer BLI ein erweitertes Spektrum erreicht. Diese verhindern zuverlässig eine Inaktivierung durch ESBL und AmpC-Betalaktamasen, meist aber auch durch Carbapenemasen vom Typ Klebsiella-pneumoniae-Carbapenemase (KPC) bzw. bei Ceftazidim/Avibactam auch vom Typ OXA-48. Diese beiden Antibiotika stellen einen wichtigen Fortschritt in der Behandlung von Infektionen mit Carbapenem-resistenten Enterobacterales oder P. aeruginosa dar, dies v.a. auch aufgrund der geringeren Toxizität im Vergleich zu den bisher zur Verfügung stehenden Antibiotika wie Colistin oder Aminoglykosiden.8 Leider fehlt eine Aktivität gegenüber Metallobetalaktamase-bildenden Enterobacterales und Carbapenem-resistenten A. baumannii. Die zugelassenen Indikationen entsprechen in der Schweiz derjenigen von Ceftolozan/Tazobactam (mit Ausnahme einer nicht notwendigen Zusatztherapie mit Metronidazol beim Einsatz von Meropenem/Vaborbactam bei cIAI). Um den Therapieeffekt zu optimieren, wird auch bei diesen beiden Antibiotika eine verlängerte Infusionsdauer (über 2 bzw. 3 Stunden) empfohlen.
Cefiderocol – ein trojanisches Pferd für die Behandlung von multiresistenten Erregern
Cefiderocol ist das erste Antibiotikum aus der neuen Klasse der Siderophor-Antibiotika. Vor allem aerobe Gram-negative Erreger haben spezialisierte Eisentransportsysteme entwickelt, um das für Enzyme notwendige Eisen in die Bakterienzelle zu schleusen. Siderophore fungieren dabei als extrazelluläre Eisenchelatoren, die über die Eisentransportsysteme in die Bakterienzelle gelangen. Bei Cefiderocol wird ein Cephalosporin mit Ähnlichkeit zu Cefepim/Ceftazidim mit einer Catechol-Seitenkette kombiniert. Nach Bindung dieser Seitenkette an extrazelluläres Eisen wird Cefiderocol als Siderophor erkannt und unter Umgehung von (bei resistenten Erregern mutierten) Porinen bzw. Effluxpumpen aktiv in die Bakterienzelle geschleust, wo es direkt am Ziel wirken kann.
Durch diesen innovativen Wirkmechanismus, kombiniert mit einer zusätzlichen Stabilität gegenüber praktisch allen Betalaktamasen, wird eine theoretische Aktivität gegenüber fast allen multiresistenten aeroben Gram-negativen Erregern erzielt (inkl. A. baumannii und Stenotrophomonas maltophilia). Leider zeigt eine kürzlich publizierte Studie für Cefiderocol eine erhöhte Mortalität bei Infektionen mit multiresistenten Erregern im Vergleich zur verfügbaren Standardtherapie,9 weshalb Cefiderocol in der amerikanischen und europäischen Zulassung mit dem Hinweis versehen ist, es nur zu verwenden, wenn keine oder nur begrenzte Therapiealternativen verfügbar sind. Unter der Therapie wurde gelegentlich auch eine Resistenzentwicklung dokumentiert. Ob vor diesem Hintergrund eine Kombinationstherapie der Schlüssel zum Erfolg dieses innovativen und gegen fast alle resistenten Gram-negativen Erreger aktiven Medikaments ist, werden zukünftige Studien zeigen. In der Schweiz ist Cefiderocol noch nicht zugelassen.
Ausblick
Neben den hier kurz vorgestellten Antibiotika wurden v.a. in den USA weitere Substanzen zugelassen, die teilweise auch gegen resistente Gram-negative Bakterien wirksam sind (Plazomicin, Eravacyclin, Omadacyclin, Imipenem-Cilastatin/Relebactam). Das zur Therapie resistenter Erreger zur Verfügung stehende Antibiotika-Arsenal hat sich in den letzten zehn Jahren deutlich vergrössert. Die vorgestellten Antibiotika sind meist mindestens so wirksam wie und in der Regel weniger toxisch als die bisherigen Alternativen. Zusätzliche Antibiotika mit erweitertem Erregerspektrum sind in der Pipeline. Trotzdem dürfen andere Massnahmen zur Bekämpfung der zunehmenden Antibiotikaresistenzen aber nicht vergessen werden. Diese beinhalten auf der Ebene der neuen, aber auch alten Antibiotika eine optimierte Verabreichung (Stichwort verlängerte oder kontinuierliche Infusion) und wenn sinnvoll ein sogenanntes «therapeutic drug monitoring».10 Als übergeordnete Massnahmen sind ein reduzierter Antibiotikaverbrauch im ambulanten und stationären Sektor und in der Tiermedizin/Landwirtschaft und ein sinnvoller Einsatz von Antibiotika entscheidend.
Fazit
Neue Antibiotika sind auch in Zukunft notwendig, um Infektionen mit multiresistenten Erregern gezielt behandeln zu können. Aufgrund der hohen Entwicklungskosten und des meist begrenzten Einsatzgebietes neuer Antibiotika sind komplementäre Ansätze wie der rationale Gebrauch existierender Antibiotika dringend notwendig, um der Bedrohung durch multiresistente Erreger Herr zu werden.
Literatur:
1 Cassini A et al.: Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect Dis 2019; 19: 56-66 2 D’Costa VM et al.: Antibiotic resistance is ancient. Nature 2011; 477: 457-61 3 Infectious Diseases Society of America: The 10x ’20 Initiative: pursuing a global commitment to develop 10 new antibacterial drugs by 2020. Clin Infect Dis 2010; 50: 1081-3 4 Geriak M et al.: Clinical data on daptomycin plus ceftaroline versus standard of care monotherapy in the treatment of methicillin-resistant Staphylococcus aureus bacteremia. Antimicrob Agents Chemother 2019; 63: e02483-18 5 Pogue JM et al.: Ceftolozane/tazobactam vs polymyxin or aminoglycoside-based regimens for the treatment of drug-resistant Pseudomonas aeruginosa. Clin Infect Dis 2020; 71: 304-10 6 Farrell DJ et al.: Ceftolozane/tazobactam activity tested against Gram-negative bacterial isolates from hospitalised patients with pneumonia in US and European medical centres (2012). Int J Antimicrob Agents 2014; 43: 533-9 7 Tamma PD et al.: Infectious Diseases Society of America Guidance on the treatment of extended-spectrum beta-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis 2021; 72: e169-e83 8 Tumbarello M et al.: Efficacy of ceftazidime-avibactam salvage therapy in patients with infections caused by Klebsiella pneumoniae carbapenemase-producing K. pneumoniae. Clin Infect Dis 2019; 68: 355-64 9 Bassetti M et al.: Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): a randomised, open-label, multicentre, pathogen-focused, descriptive, phase 3 trial. Lancet Infect Dis 2021; 21: 226-40 10 Osthoff M et al.: Prolonged administration of beta-lactam antibiotics - a comprehensive review and critical appraisal. Swiss Med Wkly 2016; 146: w14368
Das könnte Sie auch interessieren:
Mit Antikörpern gegen bakterielle Infektionen
In Zeiten zunehmender Antibiotikaresistenzen werden innovative Strategien gegen bakterielle Erreger dringend benötigt. Als eine der potenziellen Lösungen bieten sich therapeutische ...
Infektionen in Krankenhäusern in Deutschland
Welche Infektionen führen häufig zu Hospitalisierungen und wie viel kostet die stationäre Behandlung von Infektionskrankheiten? Eine deutsche Expert:innengruppe versuchte, diese Fragen ...
Guidelines 2025: ein Update
Im Oktober 2025 präsentierte die European AIDS Clinical Society (EACS) eine aktuelle Version ihrer europäischen Behandlungsleitlinien zum Thema HIV/Aids. Seit zwei Jahrzehnten stellen ...