Infektionen mit atypischen Mykobakterien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Gegensatz zur Tuberkulose nehmen Infektionen mit atypischen Mykobakterien zu. Diese sind schwerer zu behandeln und die Therapie dauert länger, erklärte der Infektiologe Dr. Michael Knappik, Wien, bei einem Giftigen Dienstag.
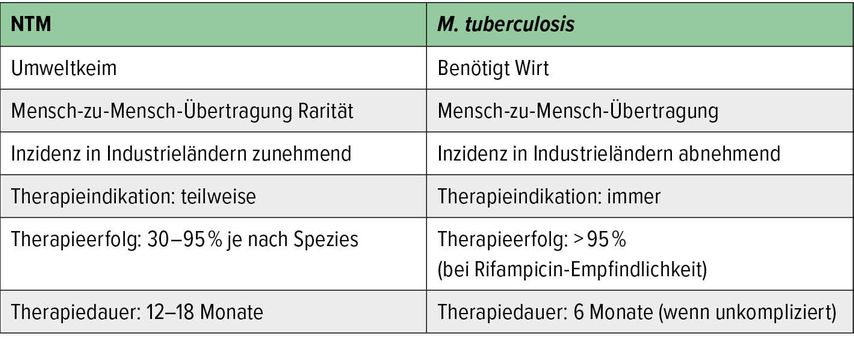
Die Inzidenz von Infektionen mit atypischen Mykobakterien hat in allen Industrieländern in den letzten zehn Jahren zugenommen“, sagte Dr. Michael Knappik, Abteilung für Atemwegs- und Lungenkrankheiten, Klinik Penzing, Wien, einleitend. „Die Diagnostik und die Therapie dieser Erkrankungen sind zumeist sehr komplex.“
Epidemiologie und Prognose
Es gibt ca. 190 verschiedene Spezies von Mykobakterien. Abgesehen von Mycobacterium tuberculosis und M. leprae gehören alle diese Spezies zu den atypischen Mykobakterien (auch als „nicht tuberkulöse Mykobakterien“ [NTM] oder „mycobacteria other than tuberculosis“ [MOTT] bezeichnet).
NTM finden sich ubiquitär in der Umwelt (in Wasser, Erde oder Staub). Ihr Spektrum ist sehr heterogen, es gibt pathogene und apathogene Arten, manche Spezies wachsen schnell, andere langsam, und manche befallen eher die Lunge, andere eher die Haut. Tabelle 1 zeigt einen Vergleich zwischen NTM und M. tuberculosis.
Die weitaus häufigsten NTM-Infektionen betreffen die Lunge, es können aber auch Haut und Weichteile oder das lymphatische System (typischerweise bei Kindern) betroffen sein; bei stärkerer Immunsuppression (z.B. bei HIV-Infektion mit sehr niedriger Zahl an CD4+-Zellen) gibt es auch disseminierte Erkrankungen. Die Empfänglichkeit für NTM-Infektionen und deren Manifestation werden sowohl von Wirtsfaktoren als auch von der speziesspezifischen Virulenz beeinflusst. In Europa findet sich als Erreger von NTM-Lungenerkrankungen mit 37% am häufigsten der Mycobacterium-avium-Komplex (MAC), der aus vier Subspezies von M. avium sowie aus M. intracellulare und M. chimera besteht, gefolgt von M. gordonae (17%), verschiedenen rasch wachsenden NTM (16%), M. xenopi (14%) und M. kansasii (5%). Diese Verteilung ist in anderen Weltregionen recht unterschiedlich, MAC ist jedoch immer am häufigsten.1 „In Deutschland macht der MAC 55% aller Isolate aus, das dürfte in Österreich ähnlich sein“, ergänzte der Infektiologe.
„Die Inzidenz von NTM-Erkrankungen dürfte inzwischen bei ca. 5/100000 Einwohner liegen und hat damit die Inzidenz der Tuberkulose in Mitteleuropa, die in den letzten Jahren gesunken ist, im Wesentlichen eingeholt“, so Knappik. In einer Metaanalyse fand sich eine relativ hohe Fünfjahresmortalität von über 25%, wobei Männer und Patienten mit Kavernen eine besonders schlechte Prognose aufweisen.2
Risikofaktoren und Diagnostik
Die wichtigsten Risikofaktoren für eine pulmonale Infektion mit NTM sind COPD (besonders, wenn Emphysembullae vorhanden sind), Bronchiektasien und zystische Fibrose. „Studien zufolge besteht bei Vorhandensein von Bronchiektasien mit Abstand das höchste Risiko“, fuhr der Infektiologe fort. Darüber hinaus können aber auch Lungenkarzinome, Aspiration bei gastroösophagealem Reflux, Lungenfibrosen, Strukturanomalien des Thorax, St.p. früheren mykobakteriellen Infektionen (z.B. Residuen nach Tuberkulose) und Pneumokoniosen wie die Silikose eine Rolle spielen.
Weiters gibt es systemische Wirtsfaktoren, wie etwa eine HIV-Infektion mit weniger als 50CD4+-Zellen/µl, Diabetes mellitus, Alkoholkrankheit, immunsuppressive Therapie (z.B. mit TNF-α-Blockern), Rauchen, aber auch Malignome, rheumatoide Arthritis, Kollagenosen, chronisches Nierenversagen oder angeborene Immundefekte.
Die klinische Relevanz von NTM variiert je nach Spezies. Sie ist laut einem systematischen Review bei M. intracellulare mit 88% sehr hoch, gefolgt von M. kansasii (78%), M. avium (63%) und M. abscessus (61%). Die klinische Relevanz ist hier definiert als jener Prozentsatz aller isolierten Stämme einer Spezies, bei der der betroffene Patient die diagnostischen Kriterien für eine Lungenerkrankung durch NTM erfüllte.3
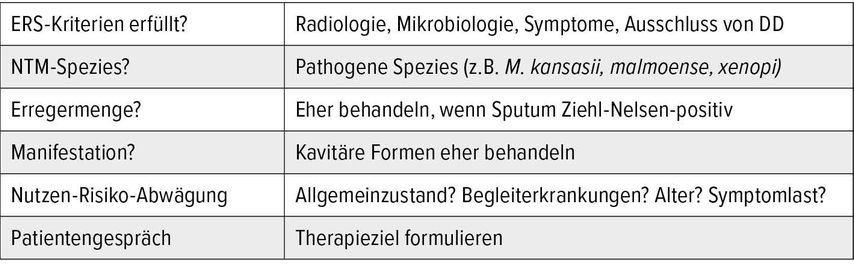
Im Jahr 2020 wurden erstmals europäisch-amerikanische, von vier Fachgesellschaften getragene Leitlinien zur Diagnostik und Therapie von NTM-Infektionen veröffentlicht.4 Um eine NTM-Erkrankung zu diagnostizieren, sollten klinische, radiologische und mikrobiologische Kriterien vorhanden sein. Die klinischen Kriterien können pulmonal (Husten, Sputumproduktion, Dyspnoe) oder systemisch (Gewichtsverlust, Nachtschweiß, Fieber oder subfebrile Temperaturen und Fatigue) sein.4 „Im Hinblick auf die radiologischen Kriterien gibt es zwei Verlaufsformen, in die fast alle pulmonalen NTM-Erkrankungen fallen“, erklärte Knappik. Das eine ist die nodulär-bronchiektatische Verlaufsform, die hauptsächlich postmenopausale Frauen ohne vorbestehende Lungenerkrankungen betrifft. Klinisch finden sich prolongierter Husten, Fatigue und Gewichtsverlust. Radiologisch bestehen Bronchiektasien mit Noduli, teilweise Tree-in-Bud-Zeichen, wobei Mittellappen und Lingula am meisten betroffen sind. Die fibrokavernöse Verlaufsform betrifft eher Männer zwischen 50 und 70 Jahren, die häufig pulmonale Vorerkrankungen wie COPD oder Fibrose aufweisen. Radiologisch sind hier fibrokavitäre Konsolidierungen vor allem im Oberlappen zu sehen.4
Mikrobiologisch sollten mindestens zwei Sputumkulturen mit derselben NTM-Spezies vorliegen, um Infektion von Kolonisation aus der Umwelt zu unterscheiden. Alternativ dazu kann auch eine positive Kultur aus einer Bronchiallavage oder ein Lungenbiopsat mit mykobakterieller Histologie und kulturellem NTM-Nachweis die NTM-Infektion beweisen.4 „Wenn die Ziehl-Nelsen-Färbung positiv, aber die PCR auf M. tuberculosis negativ ist, haben wir es in mehr als 99% der Fälle mit NTM zu tun“, ergänzte der Infektiologe.
„Resistenztests sind bei NTM oft nicht sinnvoll, weil es meist keine gesicherte Korrelation zwischen Testergebnis und klinischem Erfolg gibt. Solche Tests sollten daher nur bei gesicherter klinischer Relevanz bei ausgewählten Spezies für bestimmte Antibiotika durchgeführt werden“, betonte Knappik. Ein Beispiel sind MAC-Erreger, bei denen eine starke Korrelation zwischen Empfindlichkeit auf Makrolide und Amikacin einerseits und dem klinischen Behandlungserfolg andererseits vorliegt.
Therapie
Die Therapie von NTM-Infektionen ist langwierig und kann mit vielen Nebenwirkungen einhergehen. Abhängig von der NTM-Spezies ist ein Therapieversagen oder eine Re-Infektion häufig. Daher ist es vor Therapiebeginn dringend notwendig, die Therapieindikation zu überprüfen und mit dem Patienten den Therapieverlauf und mögliche Nebenwirkungen zu besprechen. Insbesondere bei älteren, multimorbiden Patienten und geringer Symptomlast, sollte man eine Therapieindikation kritisch überprüfen.
NTM lassen sich nach therapeutischen Kriterien in leicht und schwer behandelbare Spezies unterteilen. Leicht behandelbar sind z.B. M. kansasii, M. xenopi, M. szulgai oder M. marinum. Zu den schwer behandelbaren Spezies gehören z.B. M. avium complex und M. abscessus.5
Wenn MAC als Erreger vorliegen, wird bei der nodulär bronchiektatischen Verlaufsform ein Regime aus Azithromycin (oder Clarithromycin), Rifampicin und Ethambutol verwendet, das dreimal wöchentlich gegeben wird. Bei der kavernösen Verlaufsform gibt man zusätzlich zu diesem Regime noch ein Aminoglykosid (Amikacin oder Streptomycin) i.v. dreimal wöchentlich für mindestens zwei bis drei Monate. Die Therapiedauer beträgt mindestens zwölf Monate nach der Sputumkonversion.4
M. kansasii wird mit einem ähnlichen Regime oder auch mit Isoniazid, Rifampicin und Ethambutol behandelt.4
M. abscessus ist u.a. deshalb schwer behandelbar, weil es häufig gegen Makrolide resistent ist. Hier kommen andere Substanzen, wie Imipenem, Cefoxitin, Linezolid sowie auch Amikacin infrage (wobei Amikacin nach der Initialphase der Behandlung auch inhalativ gegeben werden kann).4
„Bei schwer behandelbaren NTM liegen die Heilungschancen teilweise unter 50%, womit sie sogar eine schlechtere Prognose als die multiresistente Tuberkulose haben.“, so Knappik abschließend.
Als Alternativen zur medikamentösen Therapie kommen in bestimmten Fällen auch operative Eingriffe oder auch „watchfulwaiting“ infrage.4 Tabelle 2 zeigt eine Checkliste für die Therapieentscheidung.
Quelle:
„Atypische Mykobakteriosen“, Vortrag von Dr. Michael Knappik, Abteilung für Atemwegs- und Lungenkrankheiten, Klinik Penzing, Wien, im Rahmen des (virtuellen) Giftigen Dienstags am 30. März 2021
Literatur:
1 Hoefsloot W et al.: The geographic diversity of nontuberculous mycobacteria isolated from pulmonary samples: an NTM-NET collaborative study. Eur Respir J 2013; 42(6): 1604-13 2 Diel R et al.: High mortality in patients with Mycobacterium avium complex lung disease: a systematic review. BMC Infect Dis 2018; 18(1): 206 3 Zweijpfenning SMH et al.: Geographic distribution of nontuberculous mycobacteria isolated from clinical specimens: a systematic review. Semin Respir Crit Care Med 2018; 39(3): 336-42 4 Daley CL et al.: Treatment of nontuberculous mycobacterial pulmonary disease: an official ATS/ERS/ESCMID/IDSA clinical practice guideline. Eur Respir J 2020; 56(1): 2000535 5 Schönfeld N in: Anti-infectives and the lung (ERS Monograph). S Aliberti, Chalmers, JD, and Pletz, MW (Hrsg.), 2017
Das könnte Sie auch interessieren:
Diskriminierung von Menschen mit HIV in Deutschland und Österreich
Leider müssen Menschen, die mit HIV leben, auch im Jahr 2025 noch mit Schlechterbehandlung und Ablehnung leben – überwiegend in Hinblick auf Leistungen im Gesundheitsbereich. Die ...
Update EACS-Guidelines
Im schottischen Glasgow fand im November 2024 bereits zum 31. Mal der KongressHIV Drug Therapy Glasgow, kurz HIVGlasgow, statt. Eines der Highlights des Kongresses war die Vorstellung ...
Best of CROI 2025
Im März 2025 fand in San Francisco die 32. Conference on Retroviruses and Opportunistic Infections (CROI) statt. Wie gewohnt nahmen zahlreiche Expert:innen teil, um diverse ...