Blutparasiten – Malaria und Babesiose
Bericht:
Dr. Norbert Hasenöhrl
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Während Malaria immer noch ein weltweites Problem darstellt, sind heimische Blutparasiten sehr selten, so DDr. Felix Lötsch von der Klinischen Abteilung für Infektionen und Tropenmedizin an der MedUni Wien bei einem Giftigen Dienstag.
Malaria
„Malaria wird von humanpathogenen Plasmodien, einzelligen Organismen, verursacht, die im Lauf ihres Lebenszyklus im Menschen einerseits Hepatozyten, andererseits Erythrozyten befallen“, erläuterte DDr. Felix Lötsch, MSc, Klinische Abteilung für Infektionen und Tropenmedizin, Universitätsklinik für Innere Medizin I, MedUni Wien, am Beginn seines Vortrags. Laut WHO traten im Jahr 2019 weltweit 229 Millionen Malariafälle auf, davon 94% in Afrika. In diesem Jahr gab es weltweit 409000 Todesfälle durch Malaria. Circa 50% aller weltweiten Malariafälle ereignen sich in fünf afrikanischen Ländern – Nigeria, DR Kongo, Uganda, Mosambik und Niger. In Afrika ist der Haupterreger (99,7%) Plasmodium falciparum, der Erreger der Malaria tropica, der gefährlichsten Malariaform.
„Erfreulicherweise ist die Zahl der weltweiten Malariafälle in den letzten Jahren zurückgegangen“, fuhr Lötsch fort. So sank z.B. in der Mekong-Region in Asien die Zahl der Malariaerkrankungen seit dem Jahr 2000 um 90%. Aus China sowie El Salvador wurden seit drei Jahren keine Malariafälle mehr berichtet. Im Gegensatz dazu ist es in Venezuela zu einem starken Anstieg von Malariafällen gekommen, was in erster Linie am Zusammenbruch des dortigen Gesundheitssystems liegen dürfte.
Malariaerreger
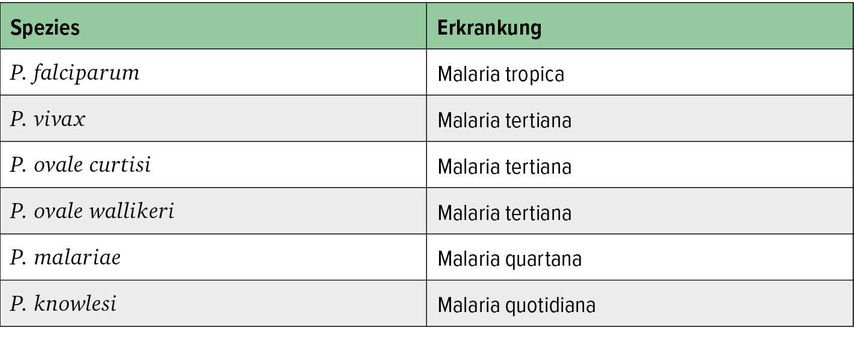
Während P. falciparum vor allem in Afrika vorkommt, ist der zweithäufigste Malariaerreger, P. vivax, im nördlichen Teil Südamerikas sowie in Südostasien zu finden, dafür weniger in Afrika (außer am Horn von Afrika). P. ovale tritt vor allem in Afrika auf, P. knowlesi in Südostasien und P. malariae überall.
Sprach man noch vor einigen Jahren von vier humanpathogenen Plasmodienspezies, so unterscheidet man mittlerweile sechs (Tab. 1).
Diese Plasmodienspezies unterscheiden sich in verschiedenen Aspekten voneinander, etwa durch die Periodizität der Fieberschübe. Auch beim Erythrozytenbefall gibt es Unterschiede. So befallen P. ovale und P. vivax bevorzugt junge Erythrozyten, P. malariae bevorzugt alte und P. falciparum alle Formen von roten Blutkörperchen. Die Inkubationszeit liegt bei sieben bis 40 Tagen, ganz vereinzelt kann eine Malaria auch schon nach fünf Tagen auftreten. „Das bedeutet aber, dass ein Fieber, das innerhalb der ersten fünf Tage nach Ankunft in einem Endemiegebiet auftritt, sicher keine Malaria sein kann!“, betonte der Experte.
Der Lebenszyklus von Plasmodien
Der Lebenszyklus von Plasmodien läuft, grob vereinfacht, so ab: Zunächst injiziert der Vektor – eine Mückeder Gattung Anopheles – die Plasmodien in Form von Sporozoiten in den Menschen, wo sie zunächst in die Leber gelangen. In diesem Stadium sind die Betroffenen asymptomatisch, und die Erkrankung ist mit heutigen Methoden in dieser Phase auch nicht diagnostizierbar. Die Parasiten entwickeln sich in den Hepatozyten zu Schizonten; diese führen zum Platzen der befallenen Zellen, wonach Schizonten ins Blut gelangen. In den Erythrozyten gibt es einen weiteren Vermehrungszyklus, der dann zum Befall neuer Erythrozyten führt. Einige Plasmodien scheren aus diesem Zyklus aus und entwickeln sich zu Geschlechtsformen, sogenannten Gametozyten. Diese werden dann wiederum von Moskitos aufgenommen, wo sie einen weiteren Entwicklungszyklus durchlaufenund im Anschluss der nächste Mensch infiziert werden kann.
Malariasymptome
Das bekannte Hauptsymptom der Malaria ist Fieber (97%), weiters sind Schüttelfrost (78%), Kopfschmerzen (74%) und Schweißausbrüche (64%) häufig. Aber auch Myalgien und Abgeschlagenheit kommen nicht selten vor. „Gelegentlich präsentieren sich Patienten vorrangig mit gastrointestinalen Symptomen wie Diarrhö und Übelkeit, was evtl. dazu führt, dass man nicht vorrangig an eine Malaria denkt. Es gilt der Grundsatz, dass jeder Patient mit Fieber, der aus einem Endemiegebiet kommt, innerhalb der Inkubationszeit auf Malaria abgeklärt werden muss!“, warnte Lötsch.
Eine schwere Malaria entsteht u.a. durch eine Mikrozirkulationsstörung; es kann zu Azidose, Hypoglykämie, Anämie, Ikterus, Nierenversagen, neurologischen Symptomen, Lungenödem, Blutungen und Hyperparasitämie kommen.
Diagnostik
Im Labor können sich folgende Befunde zeigen: Thrombopenie und Leukopenie, evtl. auch Anämie, erhöhte Leberwerte, erhöhte LDH (als Marker der Zellzerstörung) und erhöhtes CRP.
Eine Malariaprophylaxe kann die Diagnose verschleiern, weil die Parasitämie reduziert und die Inkubationszeit verlängert sein kann. „Schnelltests sind kein adäquater Ersatz für eine hochqualitative Mikroskopie, die den Goldstandard der Diagnostik darstellt“, betonte der Experte. Wenn die Erstmikroskopie negativ ausfällt, der klinische Verdacht aber besteht, so sollte alle zwölf bis 24 Stunden ein dicker Tropfen untersucht werden. Dabei ist die Nachweissensitivität im Blut aus der Fingerbeere, das mit einer Blutzuckerlanzette abgenommen wird, größer als im peripher-venösen EDTA-Blut.
Die Vorteile der Mikroskopie sind die Möglichkeit der Speziesdiagnostik, die Detektion von Doppelinfektionen (mit mehr als einer Spezies), die Bestimmung und die Verlaufskontrolle der Parasitämie. Der Nachteil der Mikroskopie liegt (für tropische Länder) darin, dass Strom und ein Mikroskop erforderlich sind, vor allem aber auch in der Tatsache, dass sie einen erfahrenen Untersucher braucht und die Ergebnisse dementsprechend untersucherabhängig sind.
Vorteile der Schnelltests sind technische Einfachheit, geringe Kosten, die Tatsache, dass keine Infrastruktur notwendig ist, und das Vorliegen eines Ergebnisses in 15 bis 30 Minuten. Dem stehen jedoch Nachteile gegenüber: Sehr geringe Parasitenzahlen sind nicht detektierbar, die Sensitivität für Nicht-falciparum-Plasmodien ist schlecht, eine Quantifizierung ist nicht möglich, und die Tests bleiben nach rezenten Infektionen für einen gewissen Zeitraum falsch positiv. „Außerdem nehmen die falsch negativen Ergebnisse auch deshalb zu, weil die Schnelltests einen diagnostischen Selektionsdruck ausgelöst haben, d.h., es gibt zunehmend Plasmodienstämme, denen gerade die vom Schnelltest zu detektierenden Antigene fehlen“, warnte Lötsch.
Therapie
Jede Form der Malaria kann heutzutage mit Artemisinin bzw. darauf basierenden Kombinationstherapien (ACT) behandelt werden. Artesunat, ein Artemisininderivat, kann bei komplizierter Malaria tropica auch i.v. verabreicht werden. Mittel der zweiten Wahl sind bei unkomplizierter Malaria tropica Atovaquon plus Proguanil oder Chinin plus Doxycyclin oder Clindamycin, bei komplizierter M. tropica Chinin i.v. und anschließend ACT, bei Non-falciparum-Malaria Chloroquin, wobei einer auf Artemisinin basierten Therapie immer ganz klar der Vorrang gegeben werden sollte. Bei P. vivax oder P. ovale müssen im Anschluss die sogenannten Hypnozoiten mit Primaquin oder Tafenoquin behandelt werden, nachdem eine G6PD-Defizienz ausgeschlossen worden ist, da eine schwere G6PD-Defizienz eine absolute Kontraindikation für diese Substanzen darstellt.
„Die sogenannte Artemisininresistenz, die vor allem in Südostasien auftritt, ist eigentlich keine Resistenz, sondern lediglich eine Toleranz der Erreger, die durch eine Mutation länger in frühen Stadien ihrer Entwicklung verbleiben, in denen Artemisinin nicht so gut greift. Das heißt, dass die Parasitenclearance verlangsamt ist, dass aber verlängerte Artemisinin-Therapieschemata nach wie vor wirken“, erläuterte Lötsch.
Im Zweifelsfall sollte an ein Referenzzentrum überwiesen werden.
Babesiose
Im Gegensatz zur Malaria wird die Babesiose durch heimische Blutparasiten verursacht. Es handelt sich dabei um eine (seltene) Zoonose, die durch Zecken übertragen wird; zusätzlich sind auch Fälle von Übertragung durch Bluttransfusion, Transplantation oder transplazentar beschrieben. In Europa entstehen humane Erkrankungen vor allem durch Babesia divergens, die Rinder, Wild, Primaten und eben auch den Menschen befallen kann. In den USA kommt B. microti vor, die Mäuse befällt.
Babesien befallen direkt die Erythrozyten. „Es gibt nicht wenige Gegenden in Österreich, wo bis zu 100% der Zecken von Babesien befallen sind“, sagte Lötsch. „Wir vermuten daher, dass asymptomatische Infektionen viel häufiger sind als symptomatische.“
Die Symptome der Babesiose sind ähnlich wie bei Malaria (Fieber, Schüttelfrost, Kopfschmerzen etc.). Die Diagnose wird mikroskopisch oder mittels PCR gestellt. Ein Zustand nach Splenektomie ist mit schweren Verlaufsformen assoziiert.
B. divergens wird mit Clindamycin und Chinin behandelt, B. microti mit Atovaquon und Azithromycin, wobei hier die Behandlung eindeutig an einem Referenzzentrum erfolgen sollte.
Quelle:
„Heimische und tropische Blutparasiten“, Vortrag von DDr. Felix Lötsch, Universitätsklinik für Innere Medizin I, MedUni Wien, im Rahmen des virtuellen Giftigen Dienstags am 20. April 2021
Literatur:
beim Vortragenden
Das könnte Sie auch interessieren:
Diskriminierung von Menschen mit HIV in Deutschland und Österreich
Leider müssen Menschen, die mit HIV leben, auch im Jahr 2025 noch mit Schlechterbehandlung und Ablehnung leben – überwiegend in Hinblick auf Leistungen im Gesundheitsbereich. Die ...
Update EACS-Guidelines
Im schottischen Glasgow fand im November 2024 bereits zum 31. Mal der KongressHIV Drug Therapy Glasgow, kurz HIVGlasgow, statt. Eines der Highlights des Kongresses war die Vorstellung ...
Best of CROI 2025
Im März 2025 fand in San Francisco die 32. Conference on Retroviruses and Opportunistic Infections (CROI) statt. Wie gewohnt nahmen zahlreiche Expert:innen teil, um diverse ...