Der komplexe Weg zur personalisierten Behandlung des multiplen Myeloms
Bericht:
Torsten U. Banisch, PhD
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim jährlichen Meeting der International Myeloma Society (IMS) standen die neuesten Fortschritte in der Myelombehandlung im Mittelpunkt sowie der Siegeszug immunologischer Behandlungsansätze und deren Zukunft. Ein weiterer Schwerpunkt lag auf der Wahl der passenden Induktionstherapie und der Dauer von Erhaltungstherapien hin zu maßgeschneiderten, patient:innenspezifischen Therapien.
Keypoints
-
Ein tiefes Ansprechen auf Induktionstherapien ist kritisch für den Erfolg der weiteren Behandlung; Quadrupel-Therapien zeigen überlegene Daten.
-
Eine dynamische Erfassung des MRD-Status kann das mögliche sichere Ende einer Erhaltungstherapie bestimmen.
-
BMCA-CAR-T-Zellen der dritten Generation sind effizienter, langlebiger und innerhalb von zwei bis drei Tagen hergestellt.
-
Rezente Studien zeigen erste positive Tendenzen beim Einsatz von Immuntherapien in früheren Behandlungslinien.
Behandlung neu diagnostizierter MM-Patient:innen
In den letzten Jahren wurden große Fortschritte in der Behandlung des multiplen Myeloms (MM) gemacht: Schon ein simples Regime bestehend aus Induktionstherapie, autologer Stammzelltransplantation (ASZT) und Erhaltungstherapie kann bei einem neu diagnostizierten MM zu einem lang anhaltenden Therapieerfolg von bis zu fünf Jahren führen, bevor erst eine Zweitlinienbehandlung erforderlich ist. Dies wurde unter anderem in der Phase-III-Studie DETERMINATION gezeigt, in der Patient:innen in der Erstlinie mit Bortezomib und Lenalidomid plus Dexamethason (RVd) behandelt wurden, gefolgt von einer Transplantation und Erhaltungstherapie mit Lenalidomid.1
Die EMORY-1000-Studie ergänzte diese Daten und zeigte, dass Transplantation plus RVd und Erhaltung mit Lenalidomid bei Patient:innen mit Standardrisiko zu einem medianen Gesamtüberleben (OS) von 13 Jahren führt. Eine Erhaltung mit Lenalidomid plus Bortezomib bei Hochrisikopatient:innen erreichte ein medianes OS von 6 bis 7 Jahren.2
Dennoch besteht ein ungedeckter medizinischer Bedarf, was die Behandlung von Hochrisikopatient:innen angeht. Es bleibt zu klären, welche Dauer bei Erhaltungstherapien sinnvoll ist, ab wann diese gestoppt werden können und welche unterstützenden Behandlungen einen lang anhaltenden Therapieerfolg sichern können.
Fortschritte in der Induktionsbehandlung
Die rezent durchgeführte Phase-II-Studie GRIFFIN konnte zeigen, dass ein tiefes Ansprechen auf die Induktionsbehandlung kritisch für den klinischen Erfolg der weiteren Behandlung ist. Darin wurden Patient:innen mit 6 Zyklen RVd plus Daratumumab (Dara-RvD), Transplantation und anschließender Erhaltung mit Daratumumab über einen Zeitraum von zwei Jahren behandelt, was zu einem überlegenen Ansprechen gegenüber einer Behandlung mit RVd führte. Nach Induktionsbehandlung konnte bereits bei 22% der Patient:innen im Dara-RVd-Arm eine Negativität bei der minimalen Resterkrankung (MRD) festgestellt werden, gegenüber 8% mit RvD. Der erzielte Behandlungserfolg nach Induktion wirkte sich auch nach einem Nachbeobachtungszeitraum von 4 Jahren weiterhin positiv auf die Rate des progressionsfreien Überlebens (PFS; 87,2% vs. 70%) und des OS aus, wobei 64% der Patient:innen unter Dara-RVd nach Abschluss der Studie weiterhin MRD-negativ waren, im Vergleich zu 30% unter RVd.3
Somit ist eine Induktionsbehandlung, in diesem Fall durch Quadrupel-Therapie mit Dara-RVd (wenn auch nur von kurzer Dauer) bereits kritisch für den weiteren Therapieerfolg.
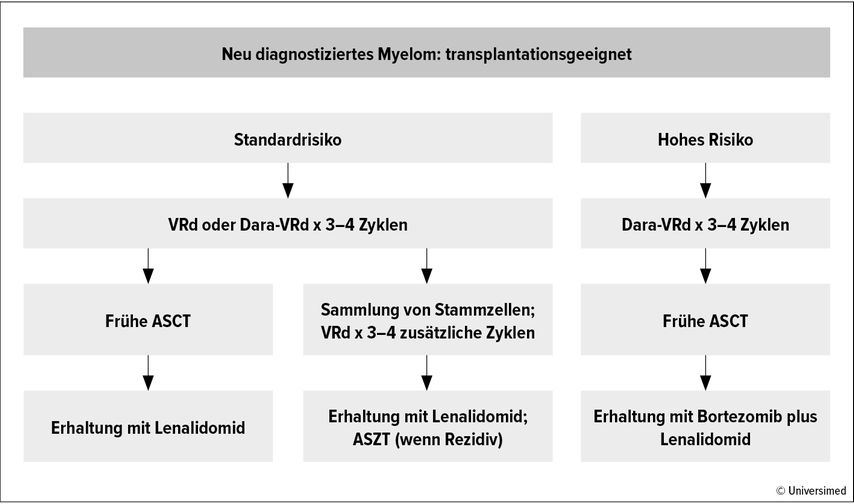
Bei der Behandlung von Hochrisikopatient:innen konnte in mehreren Studien gezeigt werden, dass die Ergänzung einer Therapie aus Carfilzomib, Lenalidomid plus Dexamethason (KRd) mit Daratumumab zu einem tieferen Ansprechen führt.4–6 Ein Vergleich der Daten der MASTER-Studie (Dara-KRd) und der oben vorgestellten GRIFFIN-Studie (Dara-RVd) ergab, dass die Dara-KRd-Behandlung gemessen an MRD-Negativität und dem Auftreten von stereotypischen Hochrisiko-Anomalien klare Vorteile bei Hochrisikopatient:innen hat (Abb. 1).3,5
Abb. 1: Konsensus-Behandlungsschema für Patient:innen mit neu diagnostiziertem MM. Modifiziert nach Rajkumar SV et al.45
Transplantation: noch erforderlich?
Aufgrund der Erfolge der Triple- und Quadrupel-Induktionstherapien stellt sich die Frage, ob eine anschließende autologe Stammzelltransplantation noch erforderlich ist. Die Studien FORTE, EMN02 und DETERMINATION beschäftigten sich mit genau dieser Frage und stellten fest, dass eine Triple-Behandlung plus Transplantation klare Vorteile gegenüber einer Behandlung ohne Transplantation hat.7,8
Die laufende MIDAS-Studie untersucht den Nutzen einer Transplantation bei Quadrupel-Induktion: Patient:innen werden mit sechs Zyklen Isatuximab plus KRd (Isa-KRd) behandelt, mit anschließender Konsolidierung mit weiteren sechs Zyklen Isa-KRd oder mit zwei Zyklen Isa-KRd plus Transplantation und nachfolgender Lenalidomid-Erhaltungstherapie für drei Jahre.9
Die bisherige Empfehlung, dass alle geeigneten Patient:innen eine Transplantation erhalten sollten, bleibt bestehen.
Idealdauer von Erhaltungstherapien: MRD-basierend oder bis Progression?
Heutzutage dauert die Behandlung von MM-Patient:innen rund 13 Jahre. Eine Therapie über solch eine langen Zeitraum birgt jedoch viele Risiken, wie lang anhaltende Toxizitäten, Sekundärerkrankungen, Infektionen, Zytopenien und negative Auswirkungen auf die Lebensqualität. Viele rezente Studien widmen sich deshalb der Frage, wann und unter welchen Umständen Erhaltungstherapien – bei Beibehaltung der erzielten Therapieerfolge – ausgesetzt werden können.
Die Daten der IFM2009- und DETERMINATION-Studien können hierfür miteinander verglichen werden, da beide demselben Behandlungsschema mit VRd folgen. Patient:innen in der IFM2009-Studie erhielten eine Erhaltungstherapie mit Lenalidomid für ein Jahr, gegenüber einer Erhaltung bis Progression in der DETERMINATION-Studie.1,10,11 Die Daten belegen, dass sowohl PFS als auch OS bei durchgängiger Behandlung verlängert werden, jedoch haben nicht alle Patient:innen einen Vorteil bei diesem Behandlungsschema. Die unterliegenden Risiken, Ansprechraten, MRD und Tolerierbarkeit müssen ebenfalls miteinbezogen werden.
Der neue Goldstandard wird sein, die MRD dynamisch über den Behandlungszeitraum zu erfassen, um so zu ermitteln, ob eine Therapie beendet werden kann. Die MRD ist hierbei ein guter Read-out, da gezeigt wurde, dass MRD-negative Patient:innen, welche MRD-positiv werden, genauso schlechte Therapieergebnisse aufweisen wie Patient:innen, die bei Therapiebeginn schon MRD-positiv waren. Patient:innen, die jedoch von MRD-positiv auf MRD-negativ gelangt sind, haben genauso gute Behandlungsergebnisse wie Patient:innen, die die MRD-Negativität beibehalten.12,13
In den Studien MASTER und GEM12MENOS65 wurde eine sequenzielle Ermittlung von MRD über den Behandlungszeitraum durchgeführt.14,15 Die Erhaltungstherapien von Patient:innen, die nach 24 Zyklen MRD-negativ waren, wurden ausgesetzt, ohne ein messbares Auftreten von negativen Spätfolgen. Die laufenden Studien PERSEUS, RADAR und MASTER-2 sollen diese Ergebnisse konsolidieren.16–18
Ein weiterer Ansatz sind Therapien mit einer festgelegten Dauer. Malandrakis et al. präsentierten eine neue Studie, in der Patient:innen nach drei Jahren Erhaltungstherapie, die dreimal hintereinander als MRD-negativ klassifiziert wurden und einen negativen PET-CT-Scan hatten, aus der Behandlung entlassen wurden. Bei einem Nachbeobachtungszeitraum von weiteren zwei Jahren zeigten die meisten Patient:innen (36/42) einen anhaltenden Therapieerfolg. Jedoch konnten nur 25% der Patient:innen aus der Erhaltung wie angegeben entlassen werden.19
Es bleibt also offen, wie mit Patient:innen umgegangen werden muss, die dauerhaft MRD-positiv sind oder eine Rückkehr zur MRD-Positivität aufweisen. Es ist ebenfalls unklar, ob die MRD als einziger Read-out für die Festlegung des weiteren Therapieverlaufs ausreichend ist.
Fortschritte bei der Behandlung älterer, gebrechlicher Patient:innen
Ältere, gebrechliche Patient:innen haben ein höheres Risiko für negative Therapieergebnisse unter einer Standardbehandlung.20 Zudem zeigen sie eine höhere Inzidenz von nichthämatologischen Nebenwirkungen und Behandlungsabbrüchen. Patient:innen sollten deshalb vor Aufnahme einer Therapie auf ihre Gebrechlichkeit hin geprüft werden. Hierzu gibt es eine Vielzahl an Möglichkeiten wie Funktionstests, welche auf klinischen Daten oder „Real world“-Evidenzen basieren.21
Die Studien ALCYONE and MAIA haben bereits einen Vorteil in der Erstlinienbehandlung von Daratumumab-inkludierenden Therapien wie Dara-VMP oder Dara-Rd bei dieser Patient:innenpopulation gezeigt.22,23 Die IFM2017-01-Studie wurde speziell für gebrechliche Patient:innen konzipiert und untersucht den klinischen Vorteil einer Behandlung mit Lenalidomid, Daratumumab und nur zwei Zyklen Dexamethason gegenüber einer Behandlung mit Lenalidomid und Dexamethason. Vorläufige Daten nach zwölf Monaten Nachbeobachtungszeit zeigen eine vergleichbare Gesamtansprechrate (ORR) zwischen beiden Armen (96% unter Dara-Rd gegenüber 85% unter Rd), ohne ein vermehrtes Auftreten von Nebenwirkungen. Die Daten zum PFS werden für nächstes Jahr erwartet.24 Somit scheint eine Dexamethason-sparende Therapie eine effiziente Strategie zu sein.
Auch der Nutzen einer Behandlung mit bispezifischen Antikörpern wird gerade untersucht, unter anderem in der Phase-II-Studie IFM2021-1, in welcher Regime wie Teclistamab plus Daratumumab oder Teclistamab plus Lenalidomid verglichen werden.25
Verbesserte Behandlungsoptionen bei r/r MM
Noch vor Kurzem gab es keine wirkungsvollen Therapieoptionen für Patient:innen, die nach Behandlungen mit Proteasominhibitoren, Anti-CD38-Antikörpen und Immunmodulatoren wieder progredient wurden.
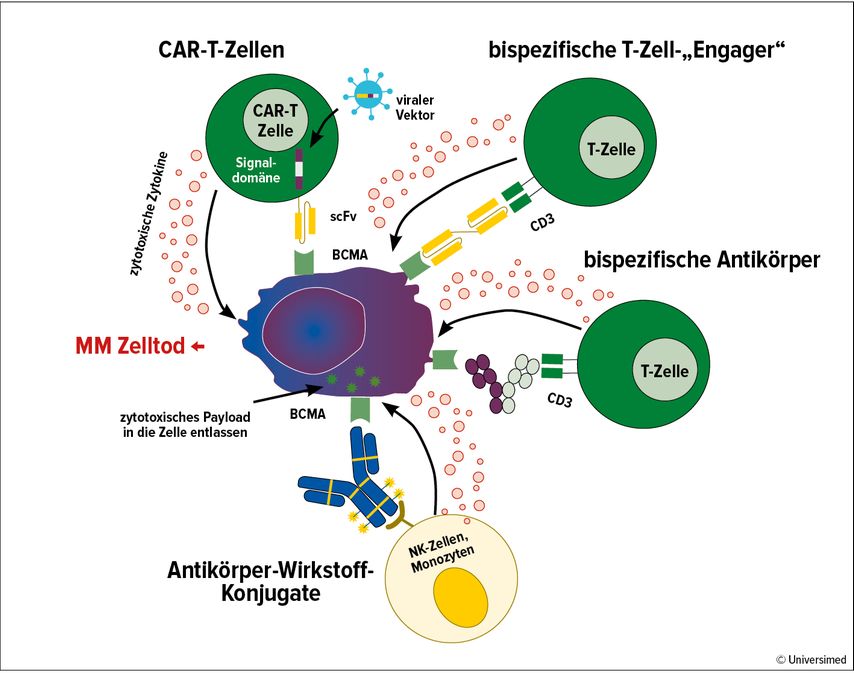
Der Siegeszug von B-Zell-Maturations-Antigen(BCMA)-gerichteten Therapien, wie den chimären Antigenrezeptor-T-Zell(CAR-T-Zell)-Therapien Ide-Cel und Delta-Cel, oder die bispezifischen Antikörper Teclistamab und Elranatamab sowie Immuntherapien mit Talquetamab revolutionierten die Behandlung von Patient:innen mit rezidiviertem/refraktärem MM (r/r MM) in den letzten 2 Jahren (Abb. 2).26–30 Jedoch bringen diese Behandlungsmöglichkeiten ihre eigenen Herausforderungen mit sich, wie etwa hohe Toxizitäten, lange Produktionsdauer von 4–6 Wochen, niedrige T-Zell-Qualität, eine hohe Rate an Infektionen, eine geringe Verfügbarkeit und eine nicht flächendeckende Patient:innen-Eignung.
Diese Probleme stehen im Mittelpunkt der aktuellen Forschung. Neue BMCA-CAR-T-Zellen der dritten Generation, wie bbz-OX40 oder PHE885, sind nicht nur effizienter und langlebiger, sondern können innerhalb von zwei bis drei Tagen (je nach Plattform) hergestellt werden.31,32
Zudem läuft die Entwicklung von nicht immunbasierten Alternativtherapien wie die der Cereblon-E3-Ligase-modulatorischen Wirkstoffe (CELMoDS) Iberdomid und Mezigdomid, welche jedoch noch nicht zugelassen sind.33, 34
Zu den Alternativtherapien gehört auch Selenexor, ein selektiver Inhibitor des nukleären Exportes, welcher zusammen mit Dexamethason für die Behandlung von r/r MM zuglassen ist. In der verwendeten Dosis liegen jedoch hohe Toxizitäten vor. In der Phase-I/II-Studie STOMP wurden nun Patient:innen mit einer geringeren Dosis Selenexor plus Pomalidomid in der vierten Linie behandelt und zeigten mit einer ORR von 54,3% und einem PFS von einem Jahr vielversprechende Verbesserungen.35 Die Wirkung von Selenexor-basierten Therapien bei Patient:innen mit r/r MM werden aktuell in mehreren Studien untersucht.36,37
Die Zukunft der Immuntherapie: Einsatz bereits in der Erst- und Zweitlinie?
Durch den bisherigen Erfolg der neuen Immuntherapien stellt sich die Frage, ob ein früherer Einsatz ebenfalls einen klinischen Nutzen bringen könnte.
Ein erster Einblick kann anhand eines Studienvergleiches geliefert werden: Die CARTITUDE-1-Studie untersucht den Nutzen einer Therapie mit Cita-cel bei Patient:innen mit median 6 Vorbehandlungen, die CARTITUDE-4-Studie bei Patient:innen mit median 2 Vorbehandlungen. Die Daten zum PFS sind mit einer 12-Monats-Rate von 85% mit zwei Vorbehandlungen gegenüber 76% vielversprechend, aber die noch kurze Laufzeit erlaubt keine definitiven Schlussfolgerungen.38,39
Ein anderer Anwendungsbereich für CAR-T-Zellen könnte in der Konsolidierungsphase liegen, bei Patient:innen, die nicht optimal auf eine Transplantation ansprechen. In der laufenden Studie KarMMa-2 mit Ide-cel konnte eine MRD-Negativität bei 61% der Patient:innen bei einem Nachbeobachtungszeitraum von 12 Monaten festgestellt werden.40
Factbox: Grundsätzliche Herausforderungen in der Behandlung des multiplen Myeloms
Die wahre Herausforderung bei der komplexen Erkrankung des MM ist die personalisierteBehandlung der Patient:innen. Es stellt sich nicht nur die Frage nach der Art und Dauer der Behandlung, sondern auch nach deren Intensität.
Grundlegend müssen krankheitsbezogene Eigenschaften wie Zytogenetik, zirkulierende Plasmazellen und extramedulläre Erkrankungen, aber auch patient:innenbezogene Eigenschaften wie Gebrechlichkeit, Alter, Komorbiditäten und Patient:innen-Compliance in Einklang gebracht werden.
Diese guten Ergebnisse führten zu einer neuen Phase-III-Studie, KarMMa-9, welche eine Konsolidierung mit Ide-cel und anschließender Erhaltung mit Lenalidomid mit einer Standardbehandlung mit Lenalidomid bis zur Progression vergleicht. Auch die laufenden Studien CARTITUDE-5 und -6 beschäftigen sich mit ähnlichen Fragestellungen.41,42
Für Hochrisikopatient:innen ist der Nutzen einer Konsolidierungstherapie nach Induktion und Transplantation ebenfalls denkbar. Die in der Entwicklung befindliche Phase-III-Studie TRIUMpH des Blood & Marrow Transplant Clinical Trials Network (BMT-CTN) soll ermitteln, ob eine Konsolidierung mit CAR-T-Zellen einen klinischen Nutzen hat und ob eine anschließende Erhaltung mit einem bispezifischen Antikörper wirksam ist. Hierfür hat die Studie drei Arme: Alle Patient:innen erhalten eine Dara-VRd-Induktion von vier Zyklen mit anschließender Transplantation. Im Kontrollarm erfolgen eine Weiterbehandlung mit zwei Zyklen Dara-VRd und eine Erhaltung mit Lenalidomid plus Daratumumab. Im zweiten und dritten Arm erfolgen eine Behandlung mit Cilta-Cel nach der Induktion und eine Erhaltungstherapie mit Lenalidomid plus Daratumumab oder Talquetamab plus Daratumumab. In der Studie wird die MRD ebenfalls dynamisch ermittelt; bei anhaltender MRD-Negativität über zwei Jahre hinweg wird die Behandlung gestoppt, bei wieder auftretender MRD-Positivität wird die Behandlung bis zur Progression fortgeführt.43
Für bispezifische Antikörper in der Frühbehandlung gibt es kaum öffentliche Daten, es laufen jedoch zurzeit mehr als 9 relevante Studien. In der Phase-Ib-Studie MajesTEC-2 wurden Patient:innen mit 1–3 Vorbehandlungen mit Teclistamab plus Daratumumab und Lenalidomid behandelt. Die ersten Ergebnisse sind bereits vielversprechend, mit einer ORR von 93,5%, wobei 81% der Patient:innen nach median 8,4 Monaten Nachbeobachtungszeitraum keine Progression zeigen.44
Quelle:
20. Jahrestagung der International Myeloma Society, 27.–30. September 2023, Athen, Griechenland
Literatur:
1 Richardson PG et al.: N Engl J Med 2022; 387: 132-47 2 Nisha SJ et al.: J Clin Oncol 2020; 38: 1928-37 3 Voorhees PM et al.: Lancet Haematol 2023; 10: e825-37 4 Landgren O et al.: JAMA Onc 2021; 7: 862-8 5 Costa LJ et al.: J Clin Oncol 2022; 40: 2901-12 6 Bhutani M et al.: Blood 2022; 140: 4440-1 7 Cavo M et al.: Lancet Hematol 2020; 6: e456-68 8 Gay F et al.: Lancet Oncol 2021; 22: 1705-20 9 ClinicalTrials.gov: NCT04934475. 2023. Online unter https://clinicaltrials.gov/study/NCT04934475 . Abgerufen am 27. Oktober 2023 10 Perrot A et al.: Blood 2018; 132: 2456-64 11 Avet-Loiseau H et al.: Blood 2021; 138: 82 12 De Tute RM et al.: JCO 2022; 40: 2889-900 13 Paiva B et al.: Blood 2023; 141: 579-91 14 Costa LJ et al.: J Clin Oncol 2022; 40: 2901-12 15 Rosinol L et al.: Blood 2023; 142: 1518-28 16 Kara-Louise R et al.: BMJ Open 2022; 12: e063037 17 ClinicalTrials.gov: NCT03710603. 2022. Online unter https://clinicaltrials.gov/study/NCT03710603 . Abgerufen am 30. Oktober 2023 18 ClinicalTrials.gov: NCT05231629. 2023. Online unter: https://www.clinicaltrials.gov/study/NCT05231629?term=NCT05231629&rank=1 . Abgerufen am 30. Oktober 2023 19 Malandrakis P et al.: IMS 2023 20 Durie BGM et al.: Lancet 2017; 389: 519-27 21 Cook G et al.: Leukemia 2020; 34: 2285-94 22 Mateos MV et al.: Clin Lymphoma Myeloma Leuk 2021; 21: 785-98 23 Facon T et al.: Lancet Oncol 2021; 22: 1582-96 24 Mainier S et al.: ASH 2022; Abstr. #569 25 ClinicalTrials.gov: NCT05572229. 2023. Online unter https://clinicaltrials.gov/study/NCT05572229 . Abgerufen am 30. Oktober 2023 26 Munshi N et al.: N Engl J Med 2021; 384: 705-16 27 Lin Y et al.: ASCO 2023; Abstr. #8009 28 Moreau P et al.: N Engl J Med 2022; 387: 495-505 29 Lesokhin A et al.: Nat Med 2023; 29: 2259-67 30 Chari A et al.: N Engl J Med 2022; 387: 2232-44 31 Wang T et al.: IMS 2023 32 ClinicalTrials.gov: NCT04537442. 2020. Online unter https://www.clinicaltrials.gov/study/NCT04537442 . Abgerufen am 30. Oktober 2023 33 Richardson PGN et al.: N Engl J Med 2023; 389: 1009-22 34 Lonial S et al.: Lancet Haematol 2022; 9: e822-32 35 Chen CI et al.: ASH 2020; Abstr. #726 36 Du J et al.: Hemasphere 2023; 7: e44667ed 37 ClinicalTrials.gov: NCT05530421. Online unter https://clinicaltrials.gov/study/NCT05530421 . Abgerufen am 30. Oktober 2023 38 Dhakal et al.: ASCO 2023; Abstr. #LBA106 39 Garfall AL et al.: Blood Canc Discov 2023; 4: 118-33 40 Dhodapkar MV et al.: ASH 2022; Abstr. #3314 41 Dytfeld D et al.: ASH 2021; Abstr. #1835 42 Boccadoro M et al.: ASH 2022; Blood 2022; 140: 4630-2 43 Saad ZU et al.: IMS 2023 44 Searle E et al.: ASH 2022; Abstr. #160 45 Rajkumar SV et al.: IMS 2023 46 Sagar L et al.: IMS 2023
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Chinesische Studien mit zukunftsweisenden Ergebnissen
Asiat:innen sind an der Jahrestagung der ESMO mit vielen klinischen Studien aktiv beteiligt. Beim diesjährigen ESMO-Kongress schafften es auch mehrere der Studien mit innovativen ...
Ausgezeichnete Studien aus dem Bereich der Hämatologie
Im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie werden jedes Jahr diverse Preise und ...