Therapieoptionen beim multiplen Myelom: „the next generation“
Bericht:
Dr. Kassandra Settele
Review von:
Assoc. Prof. Priv.-Doz. Dr. Maria Krauth
Klinische Abteilung für Hämatologie
und Hämostaseologie
Medizinische Universität Wien
E-Mail: maria.krauth@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In diesem Jahr wurden die Behandlungsleitlinien der European Society for Medical Oncology (ESMO) für das multiple Myelom (MM) aktualisiert. Sowohl in der Erstlinientherapie der Patienten, die für eine autologe Stammzelltransplantation (ASCT) infrage kommen, als auch in der Erstlinientherapie der nicht transplantablen Patienten gibt es Updates. Neue Studien führten auch zur Anpassung der Therapieleitlinien in der rezidivierten/refraktären (rr) Situation. Die neuen Behandlungsempfehlungen und einige der Studien, auf denen sie basieren, werden in diesem Artikel dargelegt.
Transplantgeeignete Patienten
In den ESMO-Guidelines von 2017 waren für jüngere, für eine ASCT geeignete Patienten in der Erstlinie vier Dreifachkombinationen als äquivalente Therapieoptionen angeführt: VTd (Bortezomib, Thalidomid, Dexamethason), VC(Cyclophosphamid)d, PAD (Bortezomib, Doxorubicin, Dexamethason), R(Lenalidomid)Vd. Das diesjährige Update zeigt nun eine klare Empfehlung für die Inklusion des CD38-Antikörpers Daratumumab (Dara) in die Induktionstherapie, sogar als eine der ersten Optionen. Falls verfügbar soll VRd (jedoch derzeit noch nicht in der EU zugelassen) oder Dara-VTd angewandt werden.1
Das aktuelle Konzept der Erstlinientherapie der für eine Transplantation geeigneten Patienten gestaltet sich folgendermaßen:
-
Die Induktion ist ein essenzieller Schritt in der Therapie dieser Patienten.
-
Momentan sind VTd/VRd die besten Erstlinienoptionen, sie sind VCd auf jeden Fall vorzuziehen.
-
Ungeklärt ist, ob K(Carfilzomib)Rd besser wirkt als VRd.
-
Eine Vierfachtherapie, die einen CD38-Antikörper einschließt, wird in Zukunft vermutlich der Standard of Care sein.
-
Das Erreichen einer Negativität in Bezug auf die minimale Resterkrankung (MRD) ist ein wichtiger Punkt: Je tiefer die mittels Induktion erreichte Remission ist, desto besser scheint das finale Outcome zu sein. Daher sollte zukünftig das Erreichen einer MRD-Negativität ein neuer Schwerpunkt werden.
-
Als globale Strategie soll eine intensive Erstlinientherapie angestrebt werden, die sich zusammensetzt aus Induktion, Transplantation, Konsolidation und Erhaltungstherapie.2
CASSIOPEIA-Studie
Aus der CASSIOPEIA-Studie ist die Inklusion eines CD38-Antikörpers in die Initialtherapie bereits bekannt: In dieser Phase-III-Studie wurde VTd+/–Dara als Induktions- und Konsolidierungstherapie verabreicht, ergänzt durch eine Erhaltungstherapie mit Dara bzw. ohne Erhaltungstherapie im VTd-Arm. Im Vergleich zur Induktion/Konsolidierung mit lediglich VTd (und nur mehr Beobachtung in der Erhaltungsphase) konnte gezeigt werden, dass die Vierfachtherapie zu sehr tiefen MRD-Negativitäts-Raten sowohl nach Induktion als auch nach Konsolidierung führte. Auch in Bezug auf das progressionsfreie Überleben (PFS) zeigte sich die Vierfachkombination mit einer Rate von 93% vs. 85% im Follow-up nach median 18,8 Monaten überlegen (HR: 0,47; 95% CI: 0,33–0,67).3
FORTE-Studie
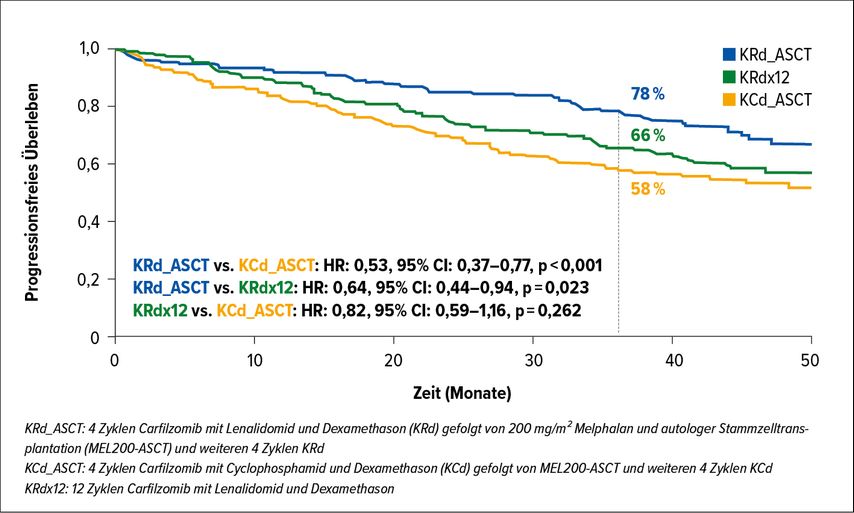
Die FORTE-Studie untersuchte acht Zyklen KCd+ASCT gegen 12 Zyklen KRd und gegen acht Zyklen KRd+ASCT. Dabei konnte sowohl gezeigt werden, dass KRd KCd überlegen ist, als auch, dass die ASCT trotz der neuen Therapieoption nicht obsolet geworden ist. Die PFS-Rate im Follow-up nach median 45 Monaten betrug 58% im KCd+ASCT-Arm, 66% im KRd-Arm und 78% im KRd+ASCT-Arm. Auch in Hinblick auf eine anhaltende MRD-Negativität war KRd+ASCT den anderen Armen überlegen: Eine anhaltende MRD-Negativität (<10–5 in der Durchflusszytometrie) wiesen 68% der Patienten im KRd+ASCT-Arm vs. 54% im KRd-Arm vs. 45% im KCd+ASCT-Arm auf. Die Überlegenheit von KRd+ASCT zeigte sich über alle analysierten Subgruppen hinweg, insbesondere auch bei Hochrisikopatienten. Zusätzlich konnte gezeigt werden, dass eine Erhaltungstherapie mit KR vs. R alleine das mediane PFS zusätzlich verbesserte, mit einer 3-Jahres-PFS-Rate von 81% vs. 68%.4
Abb. 1: Vergleich des progressionsfreien Überlebens unter KRd + ASCT, KRd bzw. KCd + ASCT in der FORTE-Studie (nach Gay et al.)4
Beeindruckende MRD-Negativitäts-Raten
Die am Jahreskongress der American Society of Hematology (ASH) 2020 präsentierte Phase-II-Studie von Landgren et al. untersuchte die Vierfachkombination mit acht Zyklen Dara+KRd als Erstlinientherapie. In dieser Studie ist primär keine ASCT geplant, es soll wiederum die Frage beantwortet werden, ob eine ASCT in der Ära von modernen Mehrfachkombinationen noch zwingend notwendig ist. Alle bisher eingeschlossenen Patienten sprachen auf die Therapie an und es kam zu einer MRD-Negativitäts-Rate von 70% – dies sind sehr beeindruckende, in dieser Form noch nie da gewesene Ergebnisse.5
GRIFFIN-Studie
Die Phase-II-Studie GRIFFIN untersucht Dara in Kombination mit VRd, das im Vergleich zu VTD häufiger verwendete Triplett. Auch hier zeigt sich ein Trend zu einem längeren PFS und Gesamtüberleben (OS) mit der Vierfachkombination. Mittlerweile ist aus dieser Studie auch bekannt, dass sich ein klarer Vorteil in Bezug auf MRD und CR (komplettes Ansprechen) zeigen konnte.6
Nicht transplantgeeignete Patienten
Bei Patienten, die für eine ASCT nicht geeignet sind, rät die neue Leitlinie in der Erstlinie zum Einsatz von Dara-Rd, Dara-VMP (Bortezomib, Melphalan, Prednison) bzw. VRd.1
-
Die Inklusion eines CD38-Antikörpers in die Erstlinientherapie wird auch hier klar empfohlen.
-
VRd oder Dara-Rd sind die präferierten Initialtherapien.
-
Melphalan ist nicht mehr zwingend Teil der initialen Therapie.
-
Bei Hochrisikopatienten sollte VRd zum Einsatz kommen.
-
Bei alten, gebrechlichen Patienten wird der Einsatz von Rd befürwortet.
-
Je nach Konstitution des Patienten kann ggf. eine Dosismodifikation erfolgen.
-
Eine längere Therapiedauer zur adäquaten Krankheitskontrolle sollte angestrebt werden, bei gleichzeitigem Erhalt der Lebensqualität. Das frühe Absetzen der Kortisontherapie wird befürwortet, um toxische Wirkungen zu verhindern.
-
Ein kontinuierliches Monitoring ist wichtig, auf das Auftreten von Toxizitäten muss geachtet werden.
ALCYONE-Studie
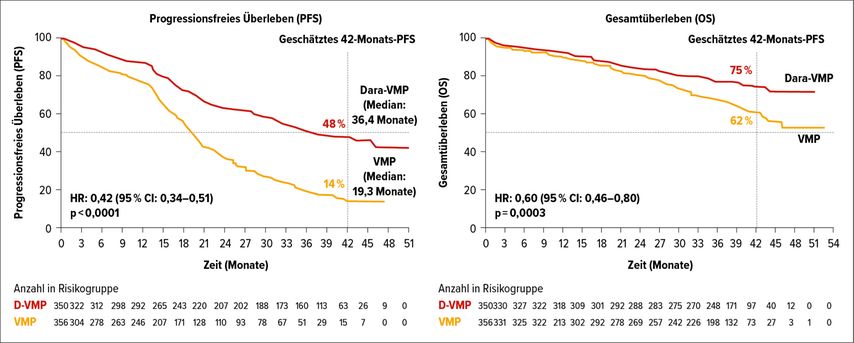
Die ALCYONE-Studie untersuchte in diesem Setting die Vierfachkombination Dara-VMP gegen VMP. Hierbei zeigte sich, dass die Vierfachkombination bezüglich PFS und OS überlegen war: Die Rate des geschätzten 42-Monats-PFS betrug unter Dara-VMP 48% vs. 14% unter VMP, die geschätzte 42-Monats-OS-Rate lag bei 75% vs. 62%. Dies entspricht einer Risikoreduktion von 40% (HR: 0,60; 95% CI: 0,46–0,80; p=0,0003). Die Patienten unter Therapie mit der Vierfachkombination erreichten außerdem tiefere Remissionen als die Patienten im VMP-Arm. Des Weiteren konnte festgestellt werden, dass eine tiefere Remission zu einem längeren PFS führte.7
Abb. 2: Progressionsfreies Überleben und Gesamtüberleben in der ALCYONE-Studie (nach Mateos et al.)7
MAIA-Studie
Das Update der Phase-III-Studie MAIA konnte mit beeindruckenden Ergebnissen aufwarten: In dieser Studie wurde Dara-Rd mit Rd verglichen. Nach einem langen Follow-up von median 42,8 Monaten war der Median des PFS in der Dara-Rd-Gruppe noch nicht erreicht. Die PFS-Rate betrug nach 48 Monaten 60% im Dara-Rd-Arm vs. 38% im Rd-Arm, mit einer Risikoreduktion von 46% für Progression oder Tod (HR: 0,54; 95% CI: 0,43–0,57; p=0,0001). Bemerkenswert ist auch, dass nun erstmals gezeigt werden konnte, dass auch Patienten mit zytogenetischem Hochrisikoprofil von dieser Therapie profitieren.8
Rezidiviertes/refraktäres multiples Myelom
Die aktualisierte Leitlinie unterscheidet zwischen dem ersten und dann subsequenten Relapsen. Im Vergleich zu den Guidelines von 2017 gibt es nun eine detaillierte Aufteilung der Patienten in unterschiedliche Gruppen je nach Ersttherapie und in Bezug auf die Sensitivität hinsichtlich einzelner Wirkstoffe. Ein besonderes Augenmerk liegt auf den gegenüber Lenalidomid und Bortezomib refraktären Patienten. Hier kann man prinzipiell zwischen zwei Behandlungsmodalitäten unterscheiden: Kombinationen basiert auf Pomalidomid (Pom) oder Kombinationen ohne immunmodulierende Substanzen (IMiD).
Pomalidomid-basierte Therapieregime
Die OPTIMISMM-Studie konnte klar zeigen, dass mit Vd+Pom vs. Vd ein deutlicher Vorteil in Bezug auf das PFS erreicht werden konnte (medianes PFS 11,2 vs. 7,1 Monate; HR: 0,61; 95% CI: 0,49–0,77; p<0,0001). Besonders gute Ergebnisse konnten erzielt werden, wenn dieses Schema bereits nach nur einer Vortherapie verabreicht wurde.9
Das Design der ELOQUENT-3-Studie verglich Elotuzumab (Elo)+Pom-d gegen Pom-d bei Lenalidomid-refraktären Patienten, die zuvor mindestens zwei Vortherapien erhalten hatten. Die Ergebnisse hinsichtlich des primären Endpunkts PFS waren ähnlich gut wie in der OPTIMISSM-Studie: Das mediane PFS unter Elo+Pom-d lag bei 10,3 Monaten, während es unter Pom-d lediglich 4,7 Monate betrug (HR für Progress oder Tod: 0,54; 95% CI: 0,34–0,86, p=0,008).10
In der ICARIA-Studie wurde der neue CD38-Antikörper Isatuximab (Isa)+Pom-d gegen Pom-d untersucht. Die Patienten hatten mindestens zwei Vortherapien, inklusive eines Proteasomen-Inhibitors und Lenalidomid, erhalten. Auch diese Studie konnte mit vergleichbaren Ergebnissen aufwarten: Das mediane PFS betrug 11,53 Monate im Isa-Pom-d-Arm vs. 6,47 Monate im Pom-d-Arm (HR: 0,596; 95% CI: 0,436–0,814; p=0,001).11
Bei APOLLO handelte es sich um eine große Phase-III-Studie, in der Dara+Pom-d bei Patienten mit mindestens einer Vortherapie untersucht wurde. Die Kombinationstherapie zeigte auch hier einen klaren Vorteil. Unter Dara+Pom-d lag die Rate des 12-Monats-PFS bei 52% vs. 35% unter Pom-d. Nach einem Follow-up von median 16,9 Monaten betrug das mediane PFS unter Dara+Pom-d 14 Monate vs. 6,9 Monate unter Pom-d (HR: 0,63; 95% CI: 0,47–0,85; p=0,0018). Insgesamt entstand jedoch durch die Zugabe von Dara zur Pom-d-Therapie für alle analysierten Subgruppen ein Vorteil.12
Es gibt also sehr gute Pomalidomid-basierte Therapieoptionen, die man beim ersten und folgenden Rezidiven anwenden kann. Vd+Pom ist bereits nach einer Vortherapie zugelassen, während Elo bzw. Isa+Pom-d nur bei Patienten mit mindestens zwei Vortherapien zugelassen sind. Die unterschiedlichen Regime wiesen in den Studien ein vergleichbar langes medianes PFS auf.
Abb. 3: Behandlungsmodalitäten bei gegenüber Lenalidomid und Bortezomib refraktären Patienten mit multiplem Myelom
IMiD-freie Kombinationen
Wenn man sich für eine IMiD-freie Kombination entschließt, hat man die Wahl zwischen einer Tripletttherapie mit Daratumumab+Vd/Kd oder den Kombinationen Selinexor+Vd (in der EU noch nicht zugelassen) bzw. Isatuximab+Kd sowie einer Dubletttherapie mit Kd oder Vd.
Das Therapieschema Dara+Vd wurde in der altbekannten multizentrischen, randomisierten, offenen, kontrollierten Phase-III-Studie CASTOR im Vergleich zu Vd untersucht. Bezüglich des primären Endpunkts PFS konnte gezeigt werden, dass Dara+Vd mit einem medianen PFS von 16,7 Monaten Vd mit 7,1 Monaten eindeutig überlegen war (HR: 0,31; 95% CI: 0,24–0,39; p<0,0001).13
Bei Selinexor handelt es sich um einen neuen oralen Wirkstoff, der in der Kombination mit Vd in der globalen, randomisierten, offenen, kontrollierten Phase-III-Studie BOSTON bei Patienten mit ein bis drei Vortherapien im Vergleich zur Dubletttherapie mit Vd untersucht wurde. Es zeigte sich ein früher und anhaltender Vorteil in Bezug auf den primären Endpunkt PFS, mit einem medianen PFS unter Selinexor+Vd von 13,93 Monaten vs. 9,46 Monate unter Vd (HR: 0,70; p=0,0075).14
Auch neu sind die Daten der CANDOR-Studie, die Dara+Kd mit Kd bei rrMM-Patienten mit ein bis drei Vortherapien verglich.15 Im Update, präsentiert am ASH-Kongress 2020, mit einem Follow-up nach median 27,8 Monaten betrug das PFS im Dara+Kd-Arm 28,6 Monate, während es im Kd-Arm bei 15,2 Monaten lag. Dies entspricht einer Risikoreduktion von 41% für Progress oder Tod (HR: 0,590; 95% CI: 0,45–0,78). Auch in der Subgruppe der Lenalidomid-exponierten/-refraktären Patienten zeigte sich ein deutlicher Vorteil mit einem medianen PFS von 28,1 vs. 11,1 Monate. Dara+Kd konnte somit einen erstaunlichen Benefit zeigen.16
Diese Daten scheinen sich in der IKEMA-Studie mit einem weiteren CD38-Antikörper, Isatuximab, bestätigt zu sehen. Hier konnte mit Isatuximab+Kd eine Risikoreduktion von 47% für Progress oder Tod im Vergleich zu Kd erreicht werden (HR: 0,531; 99% CI: 0,318–0,889; p=0,0007). Das mediane PFS war im Isatuximab+Kd- Arm noch nicht erreicht und betrug im Kd-Arm 19,15 Monate (95% CI: 15,77–NE).17
Subsequente Rezidive
Bei den späteren Rezidiven, wenn Patienten schon viele Vortherapien erhalten haben und teilweise tripelrefraktär sind, gibt es besonders zu Selinexor gute Daten in Kombination mit Pom-d (STOMP)18 bzw. mit Dara-d19. Auch Belantamab ist eine Therapie, die in dieser Situation sehr gut von Patienten angenommen wird und gut verträglich ist. Diese Substanz wurde in unterschiedlichen Kombinationen, z.B. mit Pom/Dex (ALGONQUIN)20 bzw. mit Vd (DREAMM-6)21, getestet – mit guten Ergebnissen. Möglicherweise wird diese Substanz aufgrund der guten Wirksamkeit und Tolerabilität (vor allem in Kombination mit anderen Substanzen) auch in früheren Therapielinien zum Einsatz kommen.
Bispezifische Antikörper
Als neue zielgerichtete Therapieoption mit unterschiedlichen Targets an den Myelomzellen sind in den letzten Jahren unterschiedliche bispezifische Antikörper aufgekommen, die in verschiedenen Studien untersucht werden. Insgesamt zeigen sich unter Therapie mit bispezifischen Antikörpern hohe objektive Ansprechraten von etwa 60–80% bei einem akzeptablen Sicherheitsprofil.
CAR-T-Zellen
Auch für die Therapie des multiplen Myeloms mittels chimärischer Antigenrezeptor-T-Zellen (CAR-T-Zellen) existieren mittlerweile einige Produkte. Um ein Beispiel herauszugreifen, untersuchte die Phase-Ib/II-Studie CARTITUDE-1 die Therapie mit Ciltacabtagen-Autoleucel bei rrMM mit einer beachtlichen Anzahl tripel- bzw. pentarefraktärer Patienten in der Studienpopulation. In dieser Studie konnten gute Ansprechraten von über 90% und MRD-Negativitäts-Raten von 93% erzielt werden. Auch das 12-Monats-PFS war günstig und lag bei 76,6%.22 Als zweites Beispiel sei die KarMMa-Studie angeführt, die Idecabtagen-Vicleucel hinsichtlich unterschiedlicher Dosierungen und der Ansprechtiefe untersuchte. Mit einer höheren Zieldosis verlängerte sich das PFS und betrug bei einer Zieldosis von 450×106 CAR+-T-Zellen im Median 12 Monate. Auch ein tieferes Ansprechen korrelierte wiederum mit einem längeren PFS: Bei den Patienten mit komplettem/stringent komplettem Ansprechen betrug das PFS im Median 20 Monate.23 In der Subgruppenanalyse zeigte sich u.a., dass hingegen prognostisch negative Voraussetzungen wie extramedulläre Erkrankung bzw. eine hohe Tumorlast die gute Ansprechrate nicht substanziell beeinflussten.24
Literatur:
1 Dimopoulos MA et al.: Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2021; 32(3): P309-22 2 Moreau P: 6th World Congress on Controversies in multiple myeloma 2020 3 Moreau P: Bortezomib, thalidomide, and dexamethasone with or without daratumumab before and after autologous stem-cell transplantation for newly diagnosed multiple myeloma (CASSIOPEIA): a randomised, open-label, phase 3 study. Lancet 2019; 394(10192): 29-38 4 Gay F et al.: Survival analysis of newly diagnosed transplant-eligible multiple myeloma patients in the randomized FORTE trial. ASH-Meeting 2020; Abstr. #141 5 Langren O et al.: Weekly carfilzomib, lenalidomide, dexamethasone and daratumumab (wKRd-D) combination therapy in newly diagnosed multiple myeloma: final results from a clinical and correlative phase 2 study. ASH-Meeting 2020; Abstr. #3204 6 Kaufman JL et al.: Daratumumab (DARA) plus lenalidomide, bortezomib, and dexamethasone (RVd) in patients with transplant-eligible newly diagnosed multiple myeloma (NDMM): updated analysis of Griffin after 12 months of maintenance therapy. ASH-Meeting 2020; Abstr. #549 7 Mateos et al.: Daratumumab plus bortezomib, melphalan, and prednisone versus bortezomib, melphalan, and prednisone in patients with transplant-ineligible newly diagnosed multiple myeloma: overall survival in Alcyone. Blood 2019; 134(Suppl 1): 859 8 Kumar SK et al.: Updated analysis of daratumumab plus lenalidomide and dexamethasone (D-Rd) versus lenalidomide and dexamethasone (Rd) in patients with transplant-ineligible newly diagnosed multiple myeloma (NDMM): the phase 3 Maia study. ASH-Meeting 2020; Abstr. #2276 9 Richardson PG et al.: Pomalidomide, bortezomib, and dexamethasone for patients with relapsed or refractory multiple myeloma previously treated with lenalidomide (OPTIMISMM): a randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20(6): 781-94 10 Dimopoulos M et al.: Elotuzumab plus pomalidomide and dexamethasone for multiple myeloma. N Engl J Med 2018; 379(19): 1811-22 11 Attal M et al.: Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): a randomised, multicentre, open-label, phase 3 study. Lancet 2019; 394(10214): 2096-107 12 Dimopoulos M et al: Apollo: phase 3 randomized study of subcutaneous daratumumab plus pomalidomide and dexamethasone (D-Pd) versus pomalidomide and dexamethasone (Pd) alone in patients (Pts) with relapsed/refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr. #412 13 Mateos MV et al.: Daratumumab, bortezomib, and dexamethasone versus bortezomib and dexamethasone in patients with previously treated multiple myeloma: three-year follow-up of CASTOR. Clin Lymphoma Myeloma Leuk 2020; 20(8): 509-18 14 Dimopoulos M et al.: Weekly selinexor, bortezomib, and dexamethasone (SVd) versus twice weekly bortezomib and dexamethasone (Vd) in patients with multiple myeloma (MM) after one to three prior therapies: Initial results of the phase III BOSTON study. ASCO-Kongress 2020; Abstr. #8501 15 Usmani SZ et al.: Carfilzomib, dexamethasone, and daratumumab versus carfilzomib and dexamethasone for the treatment of patients with relapsed or refractory multiple myeloma (RRMM): primary analysis results from the randomized, open-label, phase 3 study Candor (NCT03158688). Blood 2019; 134(Suppl 2): LBA-6 16 Dimopoulos M et al: Carfilzomib, dexamethasone, and daratumumab versus carfilzomib and dexamethasone in relapsed or refractory multiple myeloma: updated efficacy and safety results of the phase 3 Candor study. ASH-Meeting 2020; Abstr. #2325 17 Moreau P et al.: Isatuximab plus carfilzomib and dexamethasone vs carfilzomib and dexamethasone in relapsed/refractory multiple myeloma (IKEMA): interim analysis of a phase 3, randomized, open-label study. EHA-Kongress 2020, Abstr. #LB2603 18 Chen CI et al.: Selinexor in combination with pomalidomide and dexamethasone (SPd) for treatment of patients with relapsed refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr. #726 19 Gasparetto C et al.: Selinexor, daratumumab, and dexamethasone in patients with relapsed or refractory multiple myeloma. eJHaem 2020; 2(1): 56-65 20 Trudel S et al.: Part 1 results of a dose finding study of belantamab mafodotin (GSK2857916) in combination with pomalidomide (POM) and dexamethasone (DEX) for the treatment of relapsed/refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr. #725 21 Popat R et al.: DREAMM-6: safety, tolerability and clinical activity of belantamab mafodotin (Belamaf) in combination with bortezomib/dexamethasone (BorDex) in relapsed/refractory Multiple Myeloma (RRMM). ASH-Meeting 2020; Abstr. #1419 22 Madduri D et al.: CARTITUDE-1: Phase 1b/2 Study of ciltacabtagene autoleucel, a b-cell maturation antigen–directed chimeric antigen receptor t cell therapy, in relapsed/refractory multiple myeloma. ASH-Meeting 2020; Abstr. #177 23 Munshi NC et al.: Idecabtagene vicleucel (ide-cel; bb2121), a BCMA-targeted CAR T-cell therapy, in patients with relapsed and refractory multiple myeloma (RRMM): initial KarMMa results. ASCO-Kongress 2020; Abstr. #8503 24 Raje NS et al.: Idecabtagene Vicleucel (ide-cel, bb2121) in relapsed and refractory multiple myeloma: analyses of high-risk subgroups in the KarMMa study. ASH-Meeting 2020; Abstr. #3234
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...