Neue Wege in der Behandlung der Graft-versus-Host-Disease
Die 46. Jahrestagung der European Society for Blood and Marrow Transplantation (EBMT), die in diesem Jahr – wie derzeit alle Kongresse – virtuell stattfinden musste, war mit 6700 registrierten Zuschauern aus 89 Ländern ein voller Erfolg. Es wurden 972 Abstracts präsentiert, darunter einige praxisverändernde Studien. Ein Fokus in der Präsidentensitzung lag auf der Graft-versus-Host-Disease, aber auch in anderen Bereichen gab es spannende Ergebnisse zu berichten.
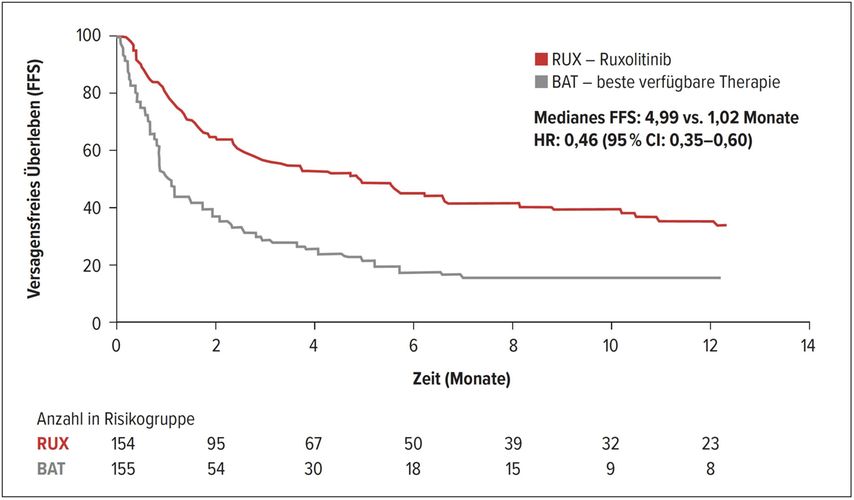
Ruxolitinib, ein JAK1/2-Inhibitor, wurde in der REACH2-Studie für die Behandlung von steroidrefraktärer akuter GvHD Grad 2–4 gegen die beste verfügbare Therapie geprüft.1 Eingeschlossen waren 309 Patienten im Alter ≥12 Jahre, die ≥3 Tage nach einer systemischen Hochdosis-Steroidtherapie mit oder ohne Calcineurininhibitoren progredient waren, kein Ansprechen nach 7 Tagen zeigten oder bei denen die Steroide nicht ausgeschlichen werden konnten. Primärer Studienendpunkt war das Ansprechen am Tag 28, sekundäre Endpunkte u.a. das anhaltende Ansprechen am Tag 56 sowie das OS nach 6 Monaten. 72,1% der Patienten im Ruxolitinib- versus 85,2% im Kontrollarm brachen die Therapie ab. Gründe für das Therapieabbrechen waren in 20,8% versus 43,9% der Fälle die fehlende Wirksamkeit, in 16,9% versus 3,2% Nebenwirkungen und in 16,2% versus 14,2% das Versterben der Patienten. 31,6% der Patienten des Kontrollarms wechselten in den Ruxolitinib-Arm über. Der primäre Endpunkt der REACH2-Studie wurde erreicht: Am Tag 28 waren 62,3% versus 39,4% der Patienten in Remission (OR:2,64; 95% CI: 1,65–4,22; p<0,001), 34,4% versus 19,4% in kompletter Remission. Anhaltende Remissionen am Tag 56 zeigten 39,6 versus 21,9% der Patienten (CR: 26,6% vs. 16,1%). Die Überlegenheit von Ruxolitinib gegenüber bester verfügbarer Therapie zeigte sich auch in allen untersuchten Subgruppen. Das Risiko für das Versagen der aGvHD-Therapie wurde durch Ruxolitinib um 54% gegenüber der Kontrolltherapie reduziert (HR:0,46; 95% CI: 0,35–0,60) (Abb. 1). Das mediane versagensfreie Überleben („failure-free survival“, FFS) betrug 4,99 versus 1,02 Monate. Das Sicherheitsprofil entsprach den für Ruxolitinib bekannten Daten mit Thrombozytopenie als häufigster Nebenwirkung.
JUN-Aktivierung bei sklerodermatöser GvHD zeigt neue Therapieoptionen auf
Die sklerodermatöse chronische GvHD („graft-versus-host disease“) gehört zu den am meisten gefürchteten Auswüchsen dieser beeinträchtigenden Nebenwirkung. Pathophysiologisch werden chronische Entzündungen sowie zellvermittelte und humorale Immunreaktionen mit abschließender Fibrosierung beobachtet. In dem dafür entwickelten scIGVHD(„severe combined immunodeficiency GvHD“)-Mausmodell mit MHC-gematchtem und „minor antigen“(miAG)-mismatchtem Gewebe konnte gezeigt werden, dass Fibroblasten eine hohe Expression von JUN aufweisen.2 JUN ist ein Transkriptionsfaktor, der in die Akute-Phase-Reaktion involviert ist und die Genexpression bezüglich der Produktion von Zytokinen und Wachstumsfaktoren bei Infektionen reguliert. Auch CD47, ein Immuncheckpoint, der die Phagozytose durch Makrophagen verhindert, wurde durch die Fibroblasten im scIGVHD-Modell stark exprimiert. Diese Erkenntnisse konnten anhand von 45 scIGVHD-Biopsien bestätigt werden. Als Nächstes erfolgte eine Analyse von primären Fibroblasten aus frischen humanen scIGVHD-Biopsien. Eine Chromatinsequenzierung (ATAC-seq) zeigte die weite Zugänglichkeit von scIGVHD-Fibroblasten gegenüber den JUN- und IL-6-Promotorregionen sowie der CD47-Enhancer- und Promotorregion. Im Normalgewebe war hingegen die JUN-Promotorregion wenig zugänglich. Weitere Untersuchungen an den scIGVHD-Fibroblasten zeigten, dass der IL-6-Promotor und die CD47-Enhancer und -Promotoren durch JUN reguliert wurden. Zudem wurden durch die JUN-Aktivität auch Schlüsselproteine im Hedgehog-Signalweg wie GLI1, PTCH1 und PTCH2 reguliert. Diese Erkenntnisse eröffnen potenzielle neue Therapiewege wie beispielsweise die Anwendung von Hedgehog-Inhibitoren oder Anti-CD47- und -IL-6R-Antikörper bei Auftreten von sklerodermatöser chronischer GvHD, schlussfolgerten die Wissenschaftler. Erste Untersuchungen im Xenograft-Modell zeigten diesbezüglich vielversprechende Ergebnisse.
Reduzierte Toxizität mit Treosulfan bei pädiatrischer Stammzelltransplantation
Treosulfan-haltige Regime werden zur Konditionierung vor allogener Stammzelltransplantation eingesetzt. Um mehr über die frühe Toxizität, Engraftment, GvHD, 2-Jahres-OS-Rate und 100-Tage-/2-Jahres-EFS-Rate bei Kindern zu erfahren, wurde eine multizentrische Beobachtungsstudie mit pädiatrischen Patienten mit nicht malignen Erkrankungen durchgeführt.3 Der Beobachtungszeitraum der Studie war von Juni 2011 bis Jänner 2019. Das primäre Studienziel war das 2-Jahres-EFS. Es wurden 114 Kinder in einem medianen Alter von 5,2 Jahren in die Studie eingeschlossen. Etwa die Hälfte der Patienten war an einer Hämoglobinopathie erkrankt, ein Drittel wies angeborene Immundefekte auf und 16% hatten Erkrankungen des Knochenmarks. Bezüglich der Pharmakokinetik von Treosulfan wurden große interindividuelle Unterschiede beobachtet. Mit der täglichen Dosierung von 10g/m2 lag die mediane AUC bei 1758mg/l mit einer Spanne von 766 bis 3368mg/l und bei 14g/m2 bei 1557mg/l mit einer Spanne von 643 bis 3278mg/l. Die Treosulfan-Clearance stieg mit dem Alter der Patienten an. Die Häufigkeit von früher Toxizität (Mukositis, Hauttoxizität) war bei hoher Treosulfan-Konzentration (>1750mg/l) signifikant gegenüber niedrigen Konzentrationen (<1350mg/l) erhöht. Bei Kindern ≥2 Jahre wurde ebenfalls signifikant häufiger eine Mukositis beobachtet. Das kumulative Auftreten der akuten GvHD Grad 2–4 betrug 11,9% (95% CI: 7,1–19,9), das der chronischen GvHD 5,3% (95% CI: 2,4–11,5). Nach 2 Jahren waren insgesamt 87,6% (95% CI: 81,7–93,9) der Patienten am Leben sowie 97% der Kinder <2 Jahren. Die 2-Jahres-EFS-Rate betrug 73,5% (95% CI: 65,8–82,1). Es zeigte sich keine signifikante Korrelation zwischen der Treosulfankonzentration und dem Spender-Empfänger-Chimärismus mit der GvHD, dem EFS oder dem OS. Mit einem therapeutischen Drug-Monitoring (TDM) könnte die Toxizität reduziert werden, insbesondere bei jüngeren Kindern, schlussfolgerten die Autoren.
Eltrombopag verbessert Ansprechrate bei schwerer aplastischer Anämie
In der offenen, randomisierten Phase-III-Studie RACE wurde untersucht, ob die Zugabe von Eltrombopag zu hATG („horse antitymocyte globuline“) und CsA (Cyclosporin A) bei Therapie-naiven Patienten mit schwerer oder sehr schwerer aplastischer Anämie (SAA/vSAA) die Wirksamkeit verbessert.4 In die Studie wurden 197 Patienten eingeschlossen und nach Schwere der Erkrankung, Alter und Behandlungszentrum stratifiziert. Der primäre Endpunkt der Studie war eine hämatologische komplette Remission (CR) nach 3 Monaten. Sekundäre Endpunkte waren u.a. das Gesamtüberleben (OS), ein hämatologisches Ansprechen nach 6 Monaten, die klonale Evolution sowie die Anzahl und Allellast von somatischen myeloischen Mutationen. Die Charakteristiken der Patienten beider Studienarme waren vergleichbar: Das mediane Alter betrug 52 (hATG/CsA) bzw. 55 Jahre (hATG/CsA + Eltrombopag), eine vSAA lag bei 33,7% bzw. 35,4% der Patienten vor und die Präsenz eines PNH(paroxysmale nächtliche Hämoglobinurie)-Klons (>1%) wurde bei 44,9% bzw. 35,5% der Patienten nachgewiesen. Im Ergebnis wurde, mit einer medianen Nachbeobachtungszeit von 18 Monaten, die 3-Monats-CR-Rate durch Eltrombopag von 9,9% auf 21,9% erhöht (OR: 3,2; p=0,012). Die Ansprechraten lagen bei 31,7% (hATG/CsA) versus 59,4% (hATG/CsA + Eltrombopag). Zur Zeit der Präsentation der Auswertung betrug die Ansprechrate von Patienten, die 6 Monate überlebten und weder transplantiert wurden noch eine klonale Evolution aufwiesen, bei 44,8% versus 71,8%. Nach 24 Monaten lag das OS bei 83,2% versus 86,3%. Das Auftreten von klinisch relevanten Nebenwirkungen war in beiden Armen vergleichbar. Eine Analyse mittels NGS („next generation sequencing“) bei 163 (Therapiebeginn) bzw. 132 Patienten (6 Monate nach Therapiebeginn) zeigte keine Veränderung bezüglich der somatischen myeloischen Mutationen.
Blinatumomab bei Kindern mit rezidivierter akuter lymphatischer Leukämie wirksam
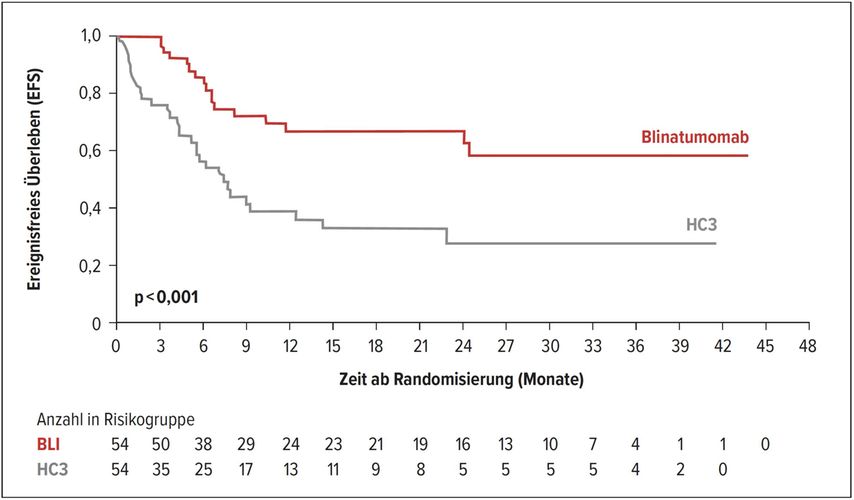
Kinder mit einem hohen Risiko für ein Rezidiv bei B-Zell-Vorläufer-akuter lymphatischer Leukämie (BCP-ALL) sind bei einer zweiten kompletten Remission Kandidaten für eine allogene Stammzelltransplantation. Da sich das BiTE („bispecific T-cell engager“) Blinatumomab als effektiv bei Kindern mit rezidivierter oder refraktärer BCP-ALL gezeigt hat, wurde eine offene, randomisierte, kontrollierte Phase-III-Studie durchgeführt, in der Blinatumomab als dritte Konsolidierungstherapie gegen eine Chemotherapie (HC3: Dexamethason, Vincristin, Daunorubicin, Methotrexat, Ifosfamid, PEG-Asparaginase) verglichen wurde.5 Nach der Rekrutierung von 108 Patienten wurde die Aufnahme in die Studie geschlossen, da in einer Zwischenanalyse der prädefinierte Vorteil für den Blinatumomab-Arm erreicht war. Mit der Blinatumomab-Therapie konnte das Risiko für ein Rezidiv um 64% gegenüber dem HC3-Arm reduziert werden (HR:0,36; 95% CI: 0,19–0,66; p<0,001) (Abb. 2). Bei Patienten mit Frührezidiv trat ein Rezidiv bei 32% im Blinatumomab-Arm und bei 64% im HC3-Arm auf (HR:0,21; 95% CI: 0,07–0,59), bei Patienten mit Spätrezidiv bei 31% im Blinatumomab-Arm versus 61% HC3-Arm (HR:0,43; 95% CI: 0,20–0,95). Die Wahrscheinlichkeit zu sterben wurde um 57% verringert (HR:0,43; 95% CI: 0,18–1,01). 11% versus 32% der Patienten mit Frührezidiv verstarben, bei Patienten mit Spätrezidiv verstarben 16% versus 32%. Die kumulative Inzidenz von Rezidiven nach einer zweiten kompletten Remission war im Blinatumomab-Arm geringer verglichen mit dem HC3-Arm (24% versus 54%). 90% versus 54% der Patienten erreichten eine MRD(„minimal residual disease“)-Remission.
Abb. 2: Ereignisfreies Überleben (EFS) bei dritter Konsolidierung mit Blinatumomab versus Chemotherapie5
Bericht:
Dr. Ine Schmale
Quelle:
46th Annual Meeting of the European Society for Blood and Marrow Transplantation (EBMT), 29. August bis 1. September 2020
Literatur:
1 Zeiser R et al.: Randomized phase 3 trial evaluating the efficacy and safety of ruxolitinib vs best available therapy in patients with steroid-refractory acute graft-vs-host disease (REACH2 trial). EBMT 2020, Abstr. #O081 2 Müller A et al.: JUN activation in dermal fibroblasts promotes fibrosis and inflammation in sclerodermatous graft-vs-host disease in mice and humans. EBMT 2020, Abstr. #O096 3 van der Stoep E et al.: Treosulfan exposure in pediatric HSCT is associated with early toxicity bu not with event-free survival. EBMT 2020, Abstr. #O173 4 de Latour RP et al.: Results of the EBMT SAAWP phase III prospective randomized multicenter RACE study of horse ATG and ciclosporin with or without eltrombopag in naive SAA patients. EBMT 2020, Abstr. #O018 5 Locatelli F et al.: Superior event-free survival with blinatumomab versus chemotherapy in children with high-risk first relapse of B-cell precursor acute lymphoblastic leukemia: A randomized, controlled phase 3 trial. EBMT 2020, Abstr. #O001
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Heilung für das multiple Myelom?
Fortschritte des Wissens zur Pathogenese des multiplen Myeloms (MM) und die davon abgeleitete Entwicklung neuer Behandlungsformen haben zu einer signifikanten Steigerung des Überlebens ...
Interessante Daten zu neuen Therapieoptionen
Am hämatologischen Jahreskongress der American Society of Hematology (ASH) wurden Updates von Studien wie TRIANGLE und POLARIX präsentiert, ohne dass sich hierbei grundlegende neue ...