Challenges bei Therapieversagen und im Nebenwirkungsmanagement
Bericht:
Mag. Dr. Anita Schreiberhuber
Zu den Highlights des 5. CAR-T-Zell-Meetings zählten einerseits Ergebnisse aus der translationalen Forschung und neue vielversprechende Ansätze in der CAR-T-Zell-Therapie, andererseits nahm auch das Toxizitäts- und Patientenmanagement großen Raum ein.
Translationale Forschung: Pankreaskarzinom
Im Rahmen der Best Abstract Sessions and Awards wurden am ersten Kongresstag die drei bestbewerteten Arbeiten junger Forscher*innen aus dem Bereich der Zell- und Gentherapie präsentiert.
Dr. Marc Wehrli, Inselspital, Universitätsspital Bern, berichtete über Erkenntnisse seiner Forschung mit einem spezifischen, eigens konzipierten CAR-T-Konstrukt (CARTEAM bzw. mesoFAP), dessen Wirksamkeit sowohl am duktalen Adenokarzinom des Pankreas (PDAC) als auch im Tumormikromilieu mit besonderem Fokus auf krebsassoziierte Fibroblasten (CAF) untersucht wurde.1 Forschungsgrundlage war, dass in mehreren Anti-Mesothelin-CAR-T-Studien zwar Sicherheit, aber keine anhaltende Wirksamkeit gezeigt werden konnte. CAF stellen eine Barriere für Medikamente und Immunzellen dar und liefern dem Tumor Wachstumssignale.2 Auf dieser Grundlage wurde die Hypothese aufgestellt, dass durch das gezielte Ansetzen an CAF das Tumorwachstum und die Immunsuppression gehemmt werden können und gleichzeitig die Zugänglichkeit von Zellen und Substanzen zum Tumor erhöht werden kann. In einem ersten Experiment wurde bestätigt, dass das CARTEAM imstande ist, durch das Mesothel exprimierte PDAC-Zellen sowie FAP(Fibroblasten-aktivierendes Protein)-exprimierende Fibroblasten zu eliminieren. In einem In-vivo-Tumormodell wurde die Wirksamkeit von mesoFAP-CAR-T-Zellen gegen PDAC und CAF untersucht, indem Mäusen CAF und PDAC injiziert und die Mäuse mit dem CARTEAM behandelt wurden. Tatsächlich konnte im Vergleich zu den Kontrollen unter CARTEAM eine deutliche Reduktion des Tumorvolumens nachgewiesen werden. Das CARTEAM wurde zusätzlich auch in zwei Ex-vivo-Modellen einer Prüfung unterzogen: Eines davon waren Tumorproben eines humanen PDAC, die in Tumorfragmente gesplittet wurden, um daraus sog. Sphäroide zu konstruieren. Letztere wurden einer mikrofluidischen Ko-Kultur beigefügt und danach mit CARTEAM behandelt. Auch hier konnte wiederum gezeigt werden, dass unter CARTEAM vs. Kontrollen eine stärkere Reduktion des prozentualen Anteils an Tumorzellen erzielt wurde. Somit konnte in In-vitro-, In-vivo- und auch Ex-vivo-Experimenten die Überlegenheit des neu konstruierten CAR-T-Zell-Konstrukts gegenüber den Kontrollen in der Tumorkontrolle bestätigt werden, was angesichts der Tatsache, dass das PDAC nach wie vor ein Malignom mit äußerst ungünstiger Prognose ist,3 vielversprechend klingt.
Challenges bei CAR-T-Zell-Versagen
„Die CAR-T-Zell-Therapie hat definitiv die Therapielandschaft im Bereich der hämatologischen Malignome revolutioniert. Die Zulassungsstudien haben allerdings nicht nur Erfolge, sondern auch die Herausforderungen in diesem Therapiefeld aufgezeigt“, stellte Ass. Prof. Dr. Maria Themeli, University Medical Center Amsterdam, zu Beginn ihres Vortrags klar. Unter dem Titel „Bringing CAR T cells to the next generation of efficacy and safety“ berichtete sie über die Ursachen für Therapieversagen bzw. Verlust des Ansprechens nach erfolgter Leukapherese. Als Hauptmechanismus führte Themeli Antigenverlust oder Downregulierung der Antigen-Expression an.4 „Wir brauchen CAR-T-Zellen, die an einer niedrigeren Zielexpression ansetzen können“, konstatierte die Forscherin, die über umfassende Erfahrung in Konzeption und Entwicklung der CAR-T-Zellen verfügt. Aktuell werden zwei Strategien untersucht, um den Responseverlust zu vermeiden: der Einsatz zweier separater Rezeptoren, die an unterschiedlichen Antigenen (Antigen A und B) ansetzen, und der Einsatz eines sog. Tandem-Rezeptors. Diese Strategien sind derzeit noch durch die Tatsache limitiert, dass erst entsprechende tumorspezifische Antigene identifiziert werden müssen.
Als weitere Ursache für ein Therapieversagen nannte Themeli ein fehlendes Persistieren der CAR-T-Zell-Funktionsfähigkeit, was sich bereits in den ersten Studien herauskristallisierte: Die Rezidive korrelierten mit der Abwesenheit/fehlenden Expansion der CAR-T-Zellen. Dies unterstreicht, dass das Design des CAR-T-Zell-Rezeptors für die Zellexpansion ausschlaggebend ist.4 Dass kostimulatorische Signale zu einer höheren Persistenz führen, konnte bereits an Mäusen mit multiplem Myelom (MM) demonstriert werden: Die Kombination eines CD28-CAR der zweiten Generation mit einem 4-1BB-Liganden (CD28 wird mit 4-1BB koexprimiert) führte zu einer Potenzierung der CAR-T-Zell-Funktion.5
In weiterer Folge versuchte die Arbeitsgruppe um Themeli, beide Strategien konkomitant anzuwenden, das bedeutet einen Ansatz an zwei Targets und die Kombination von kostimulatorischen Molekülen. „Wir stellten die Hypothese auf, dass wir auf diese Weise die Bindungsaffinität zwischen zytotoxischen T-Zellen und Tumorzellen erhöhen, dabei gleichzeitig die volle Stimulation durch die kostimulatorischen Domänen bewirken und dadurch die Persistenz der Zellen verbessern können“, erklärte Themeli. Tatsächlich hat sich der multiplexe Ansatz in Kombination mit Kostimulation durch einen CAR und einen chimerischen kostimulatorischen Rezeptor als starke Strategie erwiesen, um die Outcomes von CAR-T-Zellen durch Verstärkung der Zytotoxizität und Erhöhung der Persistenz zu verbessern.6
Europäische Guidelines zum CAR-T-Cell-Management
Prof. Dr. Ibrahim Yakoub-Agha von der Universitätsklinik Lille referierte über Toxizitäten- und Patientenmanagement. Zu Beginn seines Vortrags widmete er sich der Frage nach dem Nutzen von Guidelines und beantwortete diese selbst folgendermaßen: Die Patientenbetreuung wird lokal unterschiedlich gemanagt, und wenn gut etablierte Leitlinien fehlen, entwickelt jedes Zentrum lokale Ansätze. Yakoub-Agha hob auch den Unterschied zwischen Leitliniendokumenten zur „Praxisharmonisierung“ und solchen hervor, die auf einem breiten „Konsensus“ beruhen. Letztere basierten überwiegend auf den Ergebnissen von prospektiven randomisierten Studien, in denen spezifischen Fragen nachgegangen worden sei, und bekanntlich repräsentieren Studienpopulationen hochselektionierte Patientengruppen. Demnach sei es zwar hilfreich, über evidenzbasierte Daten zu verfügen, im Gegensatz dazu lieferten praxisharmonisierende Leitlinien jedoch den Vorteil, dass sie Antworten auf Fragen geben, zu denen kein Konsensus gefunden wurde. Sie decken alle Aspekte betreffend Zelltherapie und Transplantation ab und sind für die Kliniker von praktischem Nutzen. Kurz gesagt sei, Yakoub-Agha zufolge, ein Konsensus für Diagnose, Scoring, Versicherung und Erstattung hilfreich, „Praxisharmonisierung“ hingegen für das Patientenmanagement.
Mit dem Ziel der Anwendbarkeit auf jegliche maligne hämatologische Erkrankung oder Art einer CAR-T-Zell-Therapie hat die European Society for Blood and Marrow Transplantation (EBMT) erstmalig Empfehlungen für das Management von Kindern und Erwachsenen publiziert, die einer CAR-T-Zell-Therapie unterzogen werden.7 „In Kooperation mit dem JACIE (Joint Accreditation Committee of ISCT [International Society for Cell and Gene Therapy] and EBMT) haben wir dabei versucht, die Patientenreise von der Identifikation bis post CAR-T-Zell-Infusion zu zeichnen und praktische Empfehlungen zu geben“, berichtete Yakoub-Agha.
Darüber hinaus haben die beiden führenden europäischen hämatologischen Fachgesellschaften – die EBMT und die European Hematology Association (EHA) – mit der sog. GoCART-Koalition im November 2020 eine strategische Partnerschaft gegründet, um Europa in der Zelltherapie weltweit an die Spitze zu bringen,8 und gemeinsam eine Aktualisierung der Erstversion zum Patientenmanagement erarbeitet. Darin finden sich u.a. eine individuell für jedes Zentrum adaptierbare Checkliste für die Leukapherese, Empfehlungen zur Vorgangsweise bei Komplikationen, Algorithmen zur Behandlung von Nebenwirkungen (AE) wie dem CRS („cytokine release syndrome“) oder dem ICANS („immune effector cell-associated neurotoxicity syndrome“).9
Nebenwirkungsmanagement
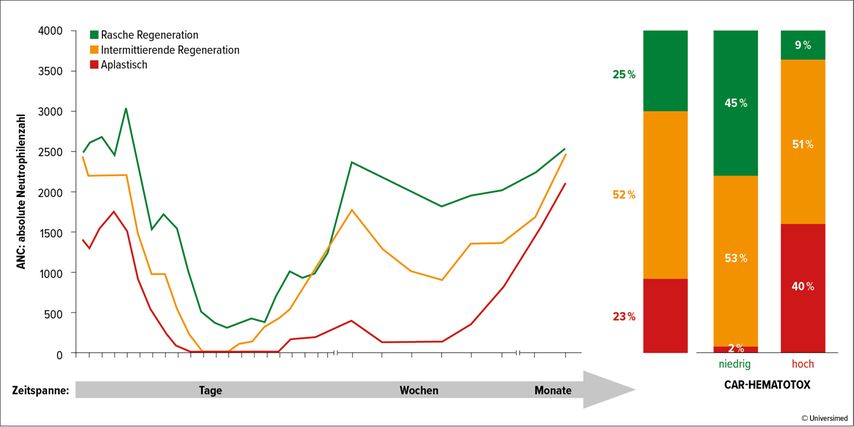
„Hämatotoxizitäten zählen zu den häufigsten immunassoziierten AE post CAR-T und prädisponieren für Infektionen und Komplikationen. Bereits in den Zulassungsstudien der ersten CAR-T-Zell-Therapien wurde eine beachtlich hohe Zahl an Zytopenien der Grade ≥3 verzeichnet“, berichtete Univ.-Prof. Dr. Marion Subklewe, Ludwig-Maximilians-Universität München. Aber auch im Real-World-Setting konnten diese Beobachtungen bestätigt werden: Von 258 Patienten aus 6 Zentren entwickelten fast 70% eine schwere Zytopenie, 68% sogar eine prolongierte Zytopenie (>7 Tage). Bei der Regeneration der Neutrophilenzahlen (ANC = absolute Neutrophilenzahl) werden 3 Phänotypen unterschieden: rasch (innerhalb von 14 Tagen), intermediär (ANC >1500/µl, gefolgt von einem zweiten Abfall mit ANC <1000/µl) und aplastisch (kontinuierliche schwere Neutropenie; ANC <500/µl ≥14 Tage) – je schwerer die Ausprägung, umso länger die Regeneration (Abb.1).10 „Der diagnostische Algorithmus für Zytopenie basiert auf dem Ansprechen auf G-CSF“, erklärte Subklewe. So konnte eine französische Forschergruppe nachweisen, dass Patienten, die früh (Tag 2 post CAR-T) G-CSF erhielten, in einem signifikant geringeren Ausmaß febrile Neutropenien entwickelten als jene, bei denen die G-CSF-Verabreichung spät (nach Tag 5 post CAR-T) erfolgte (58 vs. 81%). Die Applikation von G-CSF hatte keine Auswirkungen auf die CAR-T-Zell-Expansion und erwies sich auch als sicher.11
Abb. 1: Neutrophilenregeneration post CAR-T in Korrelation zur Risikogruppe gemäßCAR-Hematotox-Score. Modifiziert nach Rejeski K et al.10
Score zur Prädiktion von schweren Zytopenien
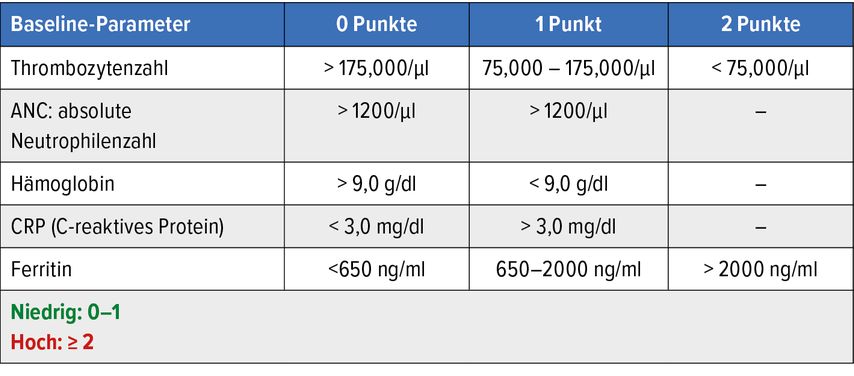
„Wir haben leider keine guten Daten zum Management von Patienten, die auf G-CSF kein Ansprechen zeigen“, gab Subklewe zu bedenken. Ihre Arbeitsgruppe hat in Kooperation mit weiteren Arbeitsgruppen den CAR-Hematotox-Score zur Vorhersage des Auftretens einer schweren Zytopenie entwickelt. Als Cut-off wurde die Zeitspanne < vs. ≥14 Tage bis zum Auftreten der schweren Zytopenie definiert. Primärer Endpunkt war der Anteil an Patienten mit einer klinisch signifikanten Neutropenie, definiert als ANC ≤500µl zwischen den Tagen 0 und 60 post CAR-T. Die Untersuchung wurde zuerst in einer Trainings- und anschließend in einer Validierungskohorte durchgeführt. Dabei wurden fünf Faktoren identifiziert, die vor der Lymphodepletion erfasst werden sollten: Thrombozytenzahl, ANC, Hämoglobin, CRP und Ferritin. Niedriges Risiko (LR) wurde mit einem Score von 0 bzw. 1, hohes Risiko (HR) mit einem Score von ≥2 definiert (Tab. 1).10 „Dabei wird berücksichtigt, dass wir den der Hämatotoxizität zugrunde liegenden Mechanismus immer noch nicht verstanden haben“, merkte Subklewe an. Die Ergebnisse einer retrospektiven Studie an 344 Patienten deuten darauf hin, dass vermutlich eine niedrige Knochenmarkreserve und Inflammation – reflektiert durch hohe Ferritin- und CRP-Spiegel – zumindest dazu beitragen.12 Diese Ergebnisse werden u.a. dadurch erhärtet, dass in einer anderen Untersuchung der Schweregrad von CRS und die Höhe der CRS-assoziierten Zytokinspiegel sowie eine geringere Thrombozytenzahl vor der Lymphodepletion als Prädiktoren für Hämatotoxizität identifiziert wurden.13
Tab. 1: CAR-Hematotox-Score: niedrig (0–1 Punkte) vs. hoch (2–7 Punkte). Modifiziert nach RejeskiK et al.10
Der CAR-Hematotox-Score wurde auch in Korrelation mit der Zeitspanne bis zur Neutrophilen- und Thrombozytenregeneration (mediane Zeitspanne: 5 vs. 13 Tage) gesetzt: Patienten mit einer raschen Regeneration fallen hauptsächlich in die LR-, jene mit einer langen Regeneration und aplastische Patienten hauptsächlich in die HR-Gruppe.10 Darüber hinaus hat sich der CAR-Hematotox-Score auch hilfreich für die Vorhersage des Auftretens von Infektionen und des Überlebens erwiesen und kann dazu genutzt werden, HR-Patienten prophylaktisch Antibiotika zu verabreichen: In einer multizentrischen, retrospektiven Analyse wurde nachgewiesen, dass eine antibakterielle Prophylaxe im Vergleich zum Verzicht auf eine solche zu einer signifikant niedrigeren Inzidenz an Infektionen führte (16 vs. 46; p<0,0001). „Dabei handelte es sich vorwiegend um bakterielle Infektionen, die in der Beobachtungszeit von 90 Tagen post CAR-T verzeichnet worden sind. Wir wissen, dass im Langzeitverlauf dann eher virale und opportunistische Infektionen auftreten“, merkte Subklewe an. Patienten in der HR-Gruppe wiesen im Vergleich zu jenen in der LR-Gruppe zudem ein kürzeres progressionsfreies (3,4 vs. 12,6 Monate) und Gesamtüberleben (9,1 Monate vs. nicht erreicht) auf und waren länger hospitalisiert (im Median: 20 vs. 16 Tage).14 „Wir sollten unsere Patienten vor der Lymphodepletion stratifizieren, um das Risiko für die Entwicklung von Komplikationen zu evaluieren. Diesen Ergebnissen zufolge erhalten Patienten mit LR bei uns keine antibiotische Prophylaxe, sondern nur G-CSF am Tag 5, falls bis dahin noch keine Regeneration der Neutrophilen erfolgt ist. Im Gegensatz dazu erhalten HR-Patienten eine Prophylaxe mit einem Chinolon und G-CSF fix am Tag 5, um die Neutrophilenregeneration anzukurbeln“, so das Resümee von Subklewe.
Quelle:
5th European CAR-T-Cell-Meeting, 9.–11. Februar 2023, Rotterdam
Literatur:
1 Best Abstracts Session & Awards, 9. Februar 2023 2 Ho WJ et al.: Nat Rev Clin Oncol 2020; 17: 527-40 3 Wang H et al.: Sci Rep 2020 4 Majzner RG, Mackall CL: Nat Med 2019; 25: 1341-55 5 Drent E et al.: Clin Cancer Res 2017; 25: 4014-25 6 Katsarou A et al.: Sci Trans Med 2021 7 Yakoub-Agha I et al.: Haematologica 2020; 05: 297-316 8 https://www.ebmt.org/sites/default/files/2020-11/Press-release_EBMT-EHA%20GoCART_FINAL.pdf (Zugriff: 24. Februar 2023) 9 Hayden PJ et al.: Ann Oncol 2021 10 Rejeski K et al.: Blood 2021; 38: 2499-513 11 Liévin R et al.: BMT 2022; 57: 431-39 12 Rejeski K et al.: ASH 2022; Abstr. #1987 13 Juluri K et al.: Blood Adv 2022; 6: 2055-68 14 Rejeski K et al.: J Immunother Caancer 2022
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...