Rolle des PNPLA3-Gens für Leberfettgehalt bei schwerem insulinresistentem Diabetes
Autorinnen:
Dr. med. Oana Patricia Zaharia
PD Dr. med. Julia Szendrödi, PhD
Klinisches Studienzentrum
Institut für Klinische Diabetologie
Deutsches Diabetes-Zentrum (DDZ)
Leibniz-Zentrum für Diabetes-Forschung
an der Heinrich-Heine-Universität Düsseldorf
E-Mail:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Einzelnukleotid-Polymorphismus rs738409 im «Patatin-like phospholipase domain-containing 3»(PNPLA3)-Gen ist mit der Entwicklung und dem Fortschreiten der nichtalkoholischen Fettlebererkrankungen (NAFLD) assoziiert. Ziel der Studie war es festzustellen, ob sich die Prävalenz des Polymorphismus bei den neuen Diabetessubtypen unterscheidet und mit der gewebespezifischen Insulinsensitivität und dem Leberlipidgehalt assoziiert ist.
Keypoints
-
Der Einzelnukleotid-Polymorphismus rs738409 im «Patatin-like phospholipase domain-containing 3»(PNPLA3)-Gen ist mit der Entwicklung und dem Fortschreiten der nichtalkoholischen Fettlebererkrankungen (NAFLD) assoziiert.
-
Die Prävalenz des Polymorphismus bei den neuen Diabetessubtypen unterscheidet sich und ist mit der gewebespezifischen Insulinsensitivität und dem Leberlipidgehalt assoziiert.
-
Patienten mit schwerem insulinresistentem Diabetes sind häufiger Träger des G-Allels.
-
Dies kann auf eine erhöhte Insulinresistenz und Lipolyse des Fettgewebes und/oder eine erhöhte Freisetzung von Lipoproteinen aus der Leber zurückzuführen sein, die das Fortschreiten von NAFLD und Diabetes wechselseitig beschleunigen können.
Einleitung
Die ektope Speicherung von Triglyzeriden in der Leber spielt eine wesentliche Rolle bei der Entwicklung sowohl peripherer als auch zentraler Insulinresistenz und trägt damit zur Pathogenese von Typ-2-Diabetes bei.1 Frühere Querschnittsanalysen zeigten, dass Patienten mit Typ-2-Diabetes häufig einen erhöhten hepatozellulären Lipidgehalt aufweisen,1, 2 der mit einer erhöhten Insulinresistenz verbunden ist. Patienten mit Diabetes weisen jedoch heterogene klinische Merkmale und Verläufe auf. Clusteranalysen, basierend auf der Erhebung einfacher metabolischer Eigenschaften, erbrachten eine Stratifizierung in neue Subtypen des Diabetes über die klassische Klassifizierung in Typ-1- und Typ-2-Diabetes hinaus.3–6 Insbesondere der schwere insulinresistente Diabetessubtyp (SIRD) mit gesteigertem kardiovaskulärem Risiko wurde mit einer erhöhten Prävalenz nichtalkoholischer Fettlebererkrankungen (NAFLD) und einer erhöhten Indizes für Leberfibrose verbunden.4
Genomweite Assoziationsstudien beschrieben, dass eine Variante (rs738409) des sogenannten «Patatin-like phospholipase domain-containing 3»(PNPLA3)-Gens das NAFLD-Risiko erhöhte.7 Es wurde gezeigt, dass PNPLA3 und andere Gene wie «transmembrane 6 superfamily member 2» (TM6SF2) eine additive Wirkung auf Lebersteatose, Steatohepatitis und Leberfibrose ausüben8 und anschliessend zu einer erhöhten Mortalität beitragen können.9–11 Weitere Studien haben robuste Assoziationen zwischen PNPLA3 und Steatose und/oder Fibrose im Zusammenhang mit Stoffwechselerkrankungen gezeigt.12 Die Beteiligung von PNPLA3 an der Modulation der Insulinresistenz wird jedoch kontrovers diskutiert, da Studien entweder keine Beziehung zur Insulinresistenz zeigen13 oder sie als Manifestation des Fortschreitens der NAFLD zur Fibrose interpretieren.14
Zielsetzung
Ziel unserer Studie (Zaharia et al.15) war es daher, (i) festzustellen, ob bestimmte Diabetes-Cluster, insbesondere SIRD, Unterschiede in der Prävalenz des PNPLA3-Polymorphismus aufweisen, und (ii) die Assoziationen zwischen dem Genotyp und Stoffwechselparametern wie der Ganzkörperinsulinsensitivität und der hepatischen Insulinsensitivität zu bewerten. Wir nahmen an, dass der Polymorphismus in PNPLA3 insbesondere bei Patienten mit SIRD unabhängig von der Insulinresistenz Veränderungen des Leberlipidgehalts verursacht.
Ergebnisse
Insgesamt 917 Teilnehmer der Deutschen Diabetes-Studie (GDS)16 wurden mittels hyperinsulinämisch-euglykämischen Clamp, Magnetresonanzspektroskopie und Genotypisierung untersucht. Wie erwartet, hatte der SIRD-Subtyp die niedrigste Ganzkörperinsulinsensitivität im Vergleich zum schweren insulindefizienten Diabetessubtyp (SIDD), dem milden Adipositas-bedingten Diabetessubtyp (MOD), dem milden altersbedingten Diabetessubtyp (MARD) und dem schweren Autoimmundiabetessubtyp (SAID).
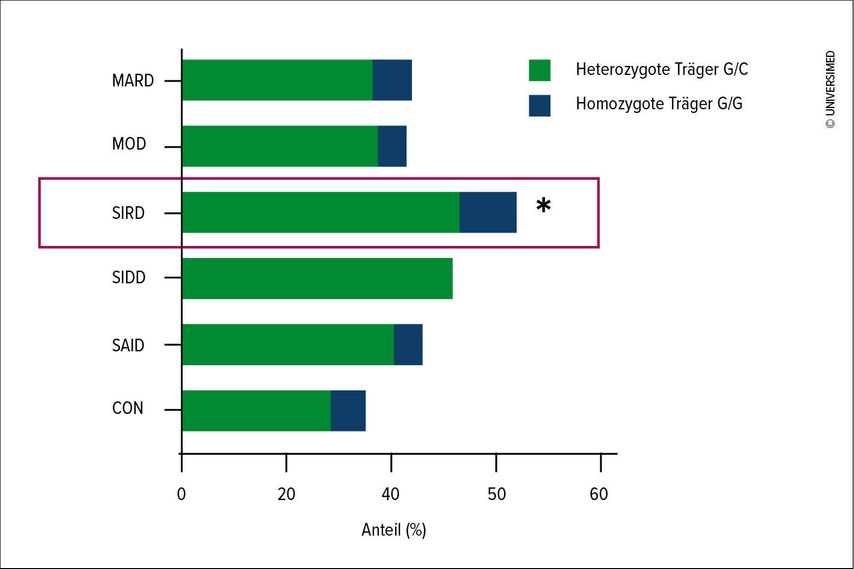
SIRD zeigte eine höhere Prävalenz des PNPLA3-Polymorphismus im Vergleich zu anderen Subtypen und einer glukosetoleranten Kontrollgruppe (Abb. 1). Ausserdem war der hepatozelluläre Lipidgehalt in SIRD höher als in den anderen Subtypen des Diabetes. Der PNPLA3-Polymorphismus war bei SIRD-Patienten nicht direkt mit Insulinsensitivität oder Leberfettgehalt assoziiert, jedoch hatten Träger des G-Allels im Vergleich zu Nichtträgern höhere Spiegel an freien Fettsäuren und eine erhöhte fettgewebespezifische Insulinresistenz.
Abb. 1: Genotypverteilung der rs738409-Variante des «Patatin-like phospholipase domain containing 3»(PNPLA3)-Gens bei Menschen ohne Diabetes (CON), mit schwerem Autoimmundiabetes (SAID), schwerem insulindefizientem Diabetes (SIDD), schwerem insulinresistentem Diabetes (SIRD), mildem Adipositas-bedingtem Diabetes (MOD) und mildem altersbedingtem Diabetes (MARD). *p<0,05 vs. CON, MOD, MARD und SAID
Diese Studie zeigt, dass Patienten mit schwerem insulinresistentem Diabetes (SIRD), die nicht nur eine höhere gewebespezifische Insulinresistenz, sondern auch einen höheren hepatozellulären Lipidgehalt als andere Diabetessubtypen aufweisen, auch häufiger Träger des G-Allels im PNPLA3-Gen sind. Innerhalb des SIRD-Subtyps weisen G-Allel-Träger höhere zirkulierende freie Fettsäuren auf, jedoch keine Assoziation mit dem Leberfettgehalt und der Ganzkörperinsulinresistenz.
Rolle des PNPLA3-Gens für die Ganzkörperinsulinresistenz
Frühere Studien zeigten eine Dissoziation zwischen hohem Leberfett und normaler Insulinsensitivität bei Trägern des SNP rs738409 im PNPLA3-Gen.13 Der zuvor vorgeschlagene Mechanismus beinhaltete eine Verringerung der hepatischen Diacylglycerolakkumulation und eine verringerte Aktivierung von Proteinkinase C, wodurch letztendlich die Lipid-induzierte Ganzkörperinsulinresistenz gehemmt wurde.17 Basierend auf früheren Studien kann zumindest ein Teil der beobachteten Heterogenität der Insulinsensitivität auf Unterschiede bei Fettleibigkeit und hauptsächlich auf abdominales Fettgewebe zurückgeführt werden.18 Unterschiede in der Insulinsensitivität zwischen den Gruppen wurden grösstenteils durch Unterschiede in der Gesamt- und insbesondere der abdominalen, viszeralen Adipositas erklärt. Dies weist auf eine enge Verbindung zwischen Fettdepots im Bauchraum und der Glukoseregulierung hin, die möglicherweise durch Adipokine vermittelt wird.19 Es ist daher nicht überraschend, dass Patienten mit SIRD im Vergleich zu metabolisch gesunden Menschen ein höheres Gesamtkörperfett sowie ein höheres subkutanes und viszerales Fettgewebe aufwiesen.
Die Rolle der freien Fettsäuren für das metabolische und kardiovaskuläre Risiko
Lipotoxische freie Fettsäuren, hauptsächlich gesättigte Fettsäuren und Ceramide, sind mögliche Determinanten für Insulinresistenz und diabetesbedingte NAFLD.1,2 Die genetisch vermittelte NAFLD, die den PNPLA3-Genotyp begleitet, war zuvor mit erhöhten mehrfach ungesättigten Triglyzeriden assoziiert.20Wir beobachteten höhere Werte an zirkulierenden freien Fettsäuren und fettgewebespezifischer Insulinresistenz bei SIRD-Patienten, die Träger des G-Allels waren im Vergleich zu Nichtträgern. Diese Patienten zeigten wiederum unabhängig vom PNPLA3-Genotyp auch den höchsten Leberfettgehalt. Darüber hinaus sind freie Fettsäuren mit der Gesamtmortalität und der kardiovaskulären Mortalität assoziiert. Mit einer diesbezüglichen Testung kann man daher das Risiko für einen plötzlichen Herztod bestimmen.21, 22 Während frühere Studien darauf hindeuten, dass eine Dysregulation des Fettsäurestoffwechsels ein möglicher kardiovaskulärer Risikofaktor ist, muss noch geklärt werden, ob hohe zirkulierende freie Fettsäuren eine Ursache oder eine Folge von pathologischen Prozessen sind, die Herz-Kreislauf-Erkrankungen zugrunde liegen. Dennoch wurde bereits berichtet, dass Patienten mit SIRD ein erhöhtes kardiovaskuläres Risiko haben3, was auf ein kumulatives Risiko zurückzuführen sein könnte, resultierend aus dem Zusammenspiel von nichtalkoholischer Fettlebererkrankung23, 24 und Diabetes25 und gestörtem Metabolismus freier Fettsäuren.
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass Patienten mit schwerem insulinresistentem Diabetes häufiger Träger des G-Allels im PNPLA3-Gen sind, was mit einem Anstieg der zirkulierenden freien Fettsäuren und einer Insulinresistenz des Fettgewebes verbunden ist. Diese Patienten weisen sowohl eine erhöhte Ganzkörperinsulinresistenz als auch den höchsten hepatozellulären Lipidgehalt auf, während Träger des G-Allels ein zusätzliches kardiovaskuläres Risiko aufweisen, da sie höhere freie Fettsäuren haben. Diese Ergebnisse deuten auf ein erhöhtes lipotoxisches Milieu bei Trägern des rs738409-Polymorphismus hin, das wiederum bei Patienten mit schwerem insulinresistentem Diabetes eine ausgeprägte Ganzkörper- und Leberinsulinresistenz und NAFLD auslöst.
Literatur:
1 Gancheva S et al.: Interorgan metabolic crosstalk in human insulin resistance. Physiol Rev 2018; 98: 1371-1415 2 Roden M et al.: The integrative biology of type 2 diabetes. Nature 2019; 576: 51-60 3 Ahlqvist E et al.: Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol 2018; 6: 361-9 4 Zaharia OP et al.: Risk of diabetes-associated diseases in subgroups of patients with recent-onset diabetes: a 5-year follow-up study. Lancet Diabetes Endocrinol 2019; 7: 684-94 5 van Gemert T et al.: Die 5 Cluster des Diabetes–eine neue/alternative Klassifikation? Diabetes aktuell 2019; 17: 178-83 6 Zaharia OP et al.: Subphänotypen des Diabetes. Der Diabetologe 2019; 15: 288-95 7 Trepo E et al.: PNPLA3 gene in liver diseases. J Hepatol 2016; 65: 399-412 8 Koo BK et al.: Additive effects of PNPLA3 and TM6SF2 on the histological severity of non-alcoholic fatty liver disease. J Gastroenterol Hepatol 2018; 33: 1277-85 9 European Association for the Study of the Liver (EASL) et al.: EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64: 1388-1402 10 Tilg H et al.: NAFLD and diabetes mellitus. Nat Rev Gastroenterol Hepatol 2017; 14: 32-42 11 Dulai PS et al.: Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: systematic review and meta-analysis. Hepatology 2017; 65: 1557-65 12 Eslam M et al.: Genetics and epigenetics of NAFLD and NASH: clinical impact. J Hepatol 2018; 68: 268-79 13 Franko A et al.: Dissociation of fatty liver and insulin resistance in I148M PNPLA3 carriers: differences in diacylglycerol (DAG) FA18:1 lipid species as a possible explanation. Nutrients 2018; 10: 1314 14 Romero-Gómez M: APOC3 polymorphisms and non-alcoholic fatty liver disease: resolving some doubts and raising others. J Hepatol 2011; 55: 1184-6 15 Zaharia OP et al.: Role of patatin-like phospholipase domain-containing 3 gene for hepatic lipid content and insulin resistance in diabetes. Diabetes Care 2020; 43: 2161-8 16 Szendroedi J et al.: Cohort profile: the German Diabetes Study (GDS). Cardiovasc Diabetol 2016; 15: 59 17 Kumashiro N et al.: Role of patatin-like phospholipase domain-containing 3 on lipid-induced hepatic steatosis and insulin resistance in rats. Hepatology (Baltimore, Md.) 2013; 57: 1763-72 18 Preis SR et al.: Abdominal subcutaneous and visceral adipose tissue and insulin resistance in the Framingham heart study. Obesity (Silver Spring) 2010; 18: 2191-8 19 Tonjes A et al.: Adipokine pattern in subjects with impaired fasting glucose and impaired glucose tolerance in comparison to normal glucose tolerance and diabetes. PLoS One 2010; 5: e13911 20 Luukkonen PK et al.: Hepatic ceramides dissociate steatosis and insulin resistance in patients with non-alcoholic fatty liver disease. J Hepatol 2016; 64: 1167-75 21 Pilz S et al.: Free fatty acids are independently associated with all-cause and cardiovascular mortality in subjects with coronary artery disease. J Clin Endocrinol Metab 2006; 91: 2542-7 22 Pilz S et al.: Elevated plasma free fatty acids predict sudden cardiac death: a 6.85-year follow-up of 3315 patients after coronary angiography. Eur Heart J 2007; 28: 2763-9 23 Targher G et al.: Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: a meta-analysis. J Hepatol 2016; 65: 589-600 24 Francque SM et al.: Non-alcoholic fatty liver disease and cardiovascular risk: pathophysiological mechanisms and implications. J Hepatol 2016; 65: 425-43 25 Grundy Scott M et al.: Diabetes and cardiovascular disease. Circulation 1999; 100: 1134-46
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...