Gezielte Diagnostik, bessere Therapie: gründliche Anamnese als Grundlage
Bericht: Dr. med. Felicitas Witte
Fachliche Kontrolle:
Prof. Dr. med. Peter Schmid-Grendelmeier
Senior Consultant Dermatologie/Allergologie
Hochgebirgsklinik Davos
Zuger Kantonsspital
Universitätsspital Zürich
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Was rät man Eltern von Neugeborenen, wie sie eine atopische Dermatitis (AD) bei ihrem Baby verhindern können? Wann macht eine komponentenbasierte Allergiediagnostik Sinn? Wie lassen sich durch eine gründliche Anamnese Tipps für eine gezielte Behandlung finden? Einen aktuellen Überblick über Risiko- und Triggerfaktoren der AD, primäre Prävention und gezielte Diagnostik gab Prof. Dr. med. Peter Schmid-Grendelmeier aus Zürich auf den Zürcher Fortbildungstagen Dermatologie.
Keypoints
-
Mit modernen Diagnosetests können die Form der AD und allfällige damit einhergehende Begleitsymptome gezielter diagnostiziert und entsprechend behandelt werden.
-
In schweren Fällen liegt bei AD manchmal eine Autoimmunreaktion zugrunde, bei der sich IgE-Antikörper gegen kutane oder nichtkutane Antigene richten.
-
Hautpflege ist absolut essenziell, übertriebene Hautpflege aber kann eventuell auch schädlich sein.
-
Die lange Liste an Komorbiditäten zeigt, dass AD eine systemische Krankheit mit zum Teil weitreichenden Folgen sein kann.
Atopische Dermatitis (AD) ist ein Standardthema in jeder Dermatologiepraxis und auf jeder Allergiestation. 2023 wurde die deutsche AWMF-Leitlinie aktualisiert, die auch hierzulande gilt. Im Alltag bleibt aber häufig kaum Zeit, sich die ausführlichen Informationen durchzulesen und zu wissen, was es Neues gibt. Bei den Zürcher Fortbildungstagen Dermatologie gab Prof. Dr. med. Peter Schmid-Grendelmeier einen umfassenden Überblick über Prävention und Diagnostik der AD. Der Dermatologe und Allergologe leitete 21 Jahre die Allergiestation in der Dermatologie im Universitätsspital Zürich und forscht seit Jahrzehnten intensiv über AD.
Übertriebene Hautpflege vermeiden
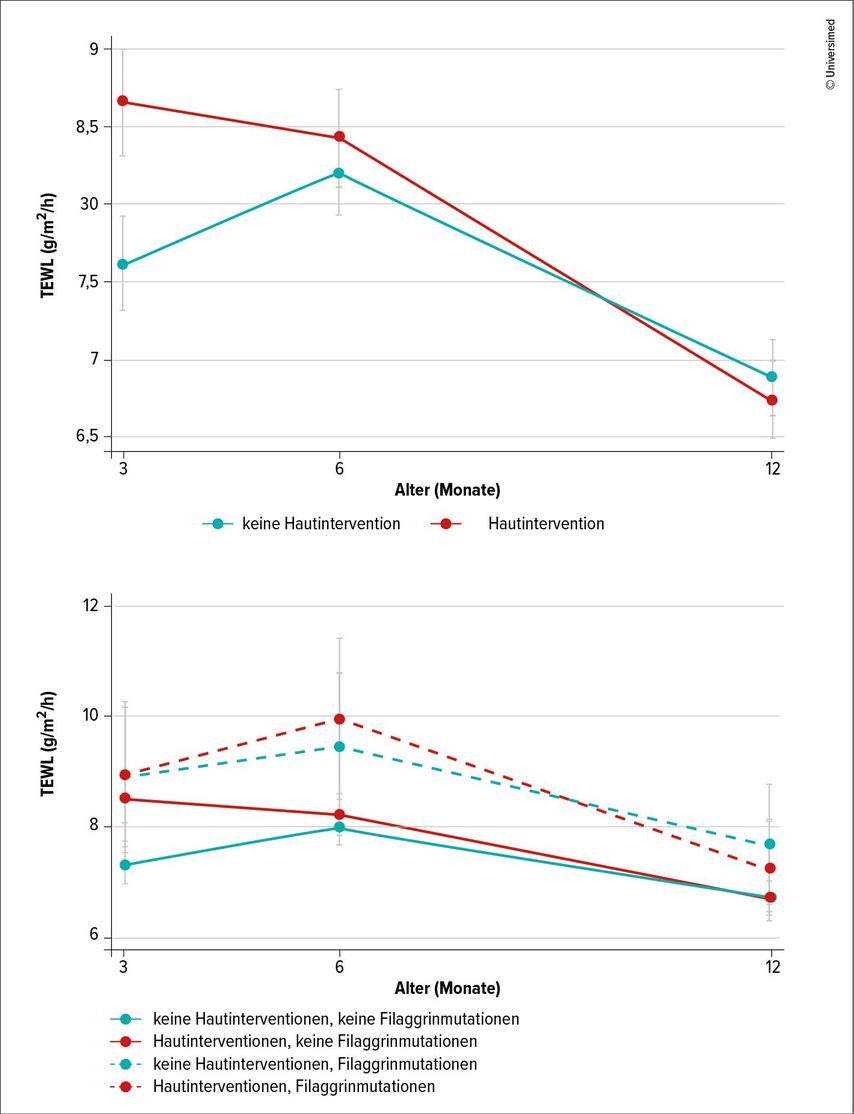
Ein Thema, über das in den vergangenen Jahren in der Fachliteratur immer mehr berichtet wurde, ist die primäre Prävention der AD. «Wichtig ist zu vermitteln: Hautpflege ist absolut essenziell», sagte Schmid-Grendelmeier. «Aber übertriebene Hautpflege mehrmals täglich kann nicht nur nicht nützlich, sondern eventuell sogar schädlich sein.» In der PreventADALL-Studie1 mit 2153 Säuglingen führten mehrfache Ölbäder pro Woche zu einer gestörten Hautbarriere, vor allem durch vermehrten Verlust von Wasser über die Haut in den ersten drei Monaten. Besonders betroffen waren Kinder mit Filaggrinmutationen (Abb.1,2). Das Protein Filaggrin spielt eine wichtige Rolle bei Bildung und Funktion der Hautbarriere. Bei Mutationen des Filaggringens mit «loss of function» funktioniert die Hautbarriere nicht mehr richtig, und das Risiko für eine AD steigt. Zwischen 20% und 50% der Patienten mit AD haben mindestens eine Mutation im Filaggringen, während dies nur auf 10% der normalen Bevölkerung zutrifft.2 Auch zu viel eincremen kann sich negativ auswirken: In der BEEP-Studie3 wurden 1394 Neugeborene mit hohem Risiko für eine AD entweder täglich eingecremt oder nicht. Das Eincremen schützte nicht vor einem Ekzem, und die eingecremten Kinder hatten sogar ein höheres Risiko für Hautinfektionen und möglicherweise für eine Nahrungsmittelallergie. Womöglich stört das Cremen mechanisch die Hautbarriere und die Ölbäder greifen in die Lipidzusammensetzung ein, was dann zum erhöhten Wasserverlust und zur Austrocknung der Haut führt. In den letzten Jahren hat sich herausgestellt, dass es vier verschiedene Endo- und Phänotypen der AD gibt, die sich anhand der Konzentration bestimmter Biomarker unterscheiden lassen, unter anderem bestimmte Interleukine, Zytokine und TH2-Leukozyten.4 «Bisher nutzen wir die Typen vor allem in Studien», sagte Schmid-Grendelmeier. «Ich hoffe aber, dass sie uns bald auch helfen, unsere Therapie spezifischer anzupassen und zum Beispiel nur gezielt die Patienten mit neuen Biologika zu behandeln, die gemäss ihrem Biomarker-Profil darauf ansprechen werden.»
Abb. 1 und 2: Transepidermaler Wasserverlust (TEWL) in g/m2/h (95%CI) bei 1683 Säuglingen mit und ohne Mutationen im Filaggringen, jeweils mit und ohne Intervention an der Haut (Ölbäder) (modifiziert nach Rehbinder EM et al. 2024)1
Komponentenbasierte Allergiediagnostik
Die Diagnose basiert nach wie vor auf der klinischen Untersuchung. Mit den modernen Tests können heute aber die Form der AD und allfällige damit einhergehende Begleitsymptome gezielter diagnostiziert und die Behandlung angepasst werden. Je nach Studie lässt sich bei 50 bis 80% der Patienten mit AD eine IgE-vermittelte Sensibilisierung auf Aeroallergene und/oder auf Nahrungsmittelallergene nachweisen.5,6 Bestimmte Phänotypen korrelieren mit bestimmten Allergenen. So lassen sich beispielsweise bei Patienten mit AD und Erythrodermie öfter hohe Spiegel von IgE-Antikörpern gegen das Kuhmilchprotein Kasein (Bos d 8) nachweisen.7 Die Babys haben ein hohes Risiko, auf Kuhmilch allergisch zu reagieren und dass eine allfällige Milchallergie persistieren wird.8–12 «Falls ein Kind mit hochgradiger Kasein-Sensibilisierung auf Kuhmilch tatsächlich allergisch reagiert hat, sollte es Milch meiden, und es sollte immer ein Notfallset mitgeführt werden», sagte Schmid-Grendelmeier. «Der allergologisch versierte Kinderarzt wird dann die IgE-Werte auf Kasein (Bos d 8) in den kommenden Jahren regelmässig bestimmen, da das Kind möglicherweise spontan eine Toleranz entwickelt und dann Milch wieder verträgt.» Die deutsche AWMF-Leitlinie5 empfiehlt eine gezielte Allergiediagnostik mit Prick-Testungen und/oder Bestimmung der IgE-Antikörper, wenn die Anamnese bei dem Kind darauf hinweist oder es Symptome hat, die auf eine Allergie weisen. «Was für eine klinische Relevanz es hat, wenn sich erhöhte IgE-Spiegel nachweisen lassen, muss man dann weiter untersuchen», ergänzte Schmid-Grendelmeier. «Und zwar, indem man das Kind von den entsprechenden Allergenen für 4–6 Wochen fernhält – sofern das geht – und beobachtet, ob die Symptome dann verschwinden.» Alternativ kann man einen Provokationstest unter Überwachung durchführen. Eine erhöhte Konzentration von IgE-Antikörpern allein ohne klinische Bedeutung rechtfertige allerdings noch lange keine Karenz von dem Allergen, so Schmid-Grendelmeier.
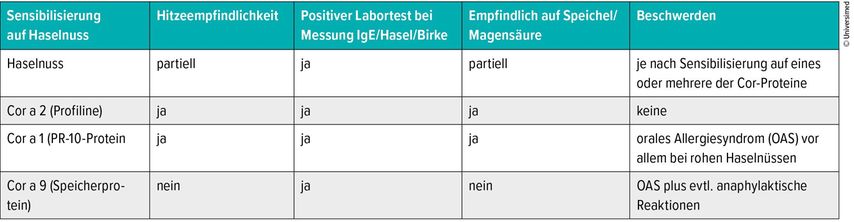
Patienten besser beraten dank Chip-Tests
Moderne Chip-Testkits wie ImmunoCAP ISAC® oder Alex® Allergy Explorer können in einem Test die IgE gegen 113 beziehungsweise 282 Allergene auf einmal bestimmen. «Anhand des Allergenmusters können wir den klinischen Phänotyp und den möglichen Schweregrad abschätzen und die Therapie anpassen», sagte Schmid-Grendelmeier. Die praktische Relevanz der Tests erklärte Schmid-Grendelmeier im Interview am Beispiel der Haselnuss (Tab.1). Ist ein Patient auf das Protein Profilin sensibilisiert, das in der Haselnuss Cor a 2 heisst, lassen sich IgE-Antikörper für alle profilinhaltigen Allergenquellen nachweisen. Das sind so gut wie alle Pollen. Der Patient hat aber keine Beschwerden bei Inhalation dieser Pollen. Anders verhält es sich beim Hauptallergen von Birkenpolle, Bet v 1 genannt. Das kommt in homologer Form auch in Stein- und Kernfrüchten vor; alle gehören zur PR-10-Proteinfamilie. Der Patient bekommt nicht nur bei Birkenpollen eine Rhinitis, sondern er kann durch Kreuzreaktionen auch ein Kribbeln im Mund spüren, wenn er bestimmte Nahrungsmittel isst, in denen «Bet v 1»-Homologe vorkommen wie in Haselnuss (Cor a 1), Apfel, Pfirsich, Sellerie oder Karotte. Diese Allergene sind allerdings hitzeempfindlich. «Deshalb hat der Patient meist nur Beschwerden beim Genuss der rohen Haselnuss beziehungsweise roher Nahrungsmittel», erklärte Schmid-Grendelmeier. Durch Speichel und Magensaft werden die Proteine denaturiert, weshalb der Patient die Beschwerden nur im Mund hat (orales Allergiesymptom), aber keine systemische Allergie. Ist ein Patient dagegen auf hitze- und magensaftresistente Proteine – im Falle der Haselnuss sogenannte Speicherproteine wie Cor a 9 oder Cor a 14 – sensibilisiert, kann es neben einem heftigeren oralen Allergiesyndrom auch zu einer Anaphylaxie mit Urtikaria, Asthmaattacken bis zum allergischen Schock kommen. «Diese Proteine kommen fast unverändert im Darm an und werden dort ins Blut aufgenommen.» Die molekularbasierte Allergiediagnostik erlaubt herauszufinden, welche der Patienten Pollen-assoziierte Kreuzreaktionen zeigen, also beispielsweise dass der Patient auf das Allergen Bet v 1 in Birkenpollen und gleichzeitig auf Mal d 1 in Äpfeln und Cor a 1 in Haselnüssen reagiert.6 «Das hilft uns, die Patienten besser beraten zu können, zum Beispiel, dass ein Birkenpollenallergiker Äpfel gekocht deutlich besser als roh verträgt.» Die gezielte Diagnostik hat allerdings ihren Preis: So kosten die Multi-Chiptests 340–350 Franken pro Chip.
Tab. 1: Beispiel einer Sensibilisierung auf Haselnuss: Mit einer gezielten IgE-Antikörper-Bestimmung gegen Allergene kann ermittelt werden, ob und welche Nahrungsmittel vermieden werden sollen (nach P. Schmid-Grendelmeier)
AD als Autoimmunreaktion
In schweren Fällen liegt bei AD manchmal eine Autoimmunreaktion zugrunde, bei der sich IgE-Antikörper gegen kutane oder nichtkutane Antigene richten. Der Patient sensibilisiert sich über Umweltallergene wie Cyclophilin (CYP) oder Mangan-Superoxid-Dismutase (MnSOD), und die entstandenen IgE-Antikörper richten sich dann gegen körpereigene Antigene, die CYP oder MnSOD ähneln. Es gibt noch diverse weitere solcher human-homologen Allergene in der Umwelt. Bisher empfehlen die Leitlinien noch nicht, routinemässig die IgE-Antikörper gegen diese Antigene zu bestimmen, aber es könnte sich auszahlen. Die Arbeitsgruppe um Prof. Dr. med. Paolo Matricardi von der Berliner Charité, der auf molekulare Diagnostik allergischer Erkrankungen spezialisiert ist, hat in einer Studie7 mit 3325 Allergiepatienten – darunter 577 mit AD – einen IgE-Index entwickelt, der sich aus der Reaktivität auf fünf Gruppen von human-homologen exogenen Allergenen zusammensetzt, und zwar Argininkinasen, Enolasen (ENO), CYP, Lipocalin und MnSOD. Der Index war bei 10,7% der Patienten mit Allergie ohne AD positiv. Bei den Patienten mit AD gab der Index einen Hinweis auf den Schweregrad: Von denjenigen mit AD in Remission hatten 20% einen positiven Index, von denen mit moderater AD 39% und von den Patienten mit schwerer AD waren es 54%. «Das weist darauf hin, dass die Auto-IgE-Antikörper bei diesen Patienten die AD mit verursacht haben», sagte Schmid-Grendelmeier. Auch können die IgE-Antikörper womöglich vorhersagen, ob sich bei den Patienten eine Behandlung mit dem IgE-Antikörper Dupilumab lohnt: AD-Patienten mit IgE-Antikörpern gegen ENO sprachen schlecht auf Dupilumab an, während das Medikament bei denjenigen mit IgE-Antikörpern gegen MnSOD und NPC-2 – ein intrazelluläres Cholesterin-Transportprotein – besser wirkte.
Lange Liste an Komorbiditäten
Ein weiterer Baustein der Diagnostik ist, den Patienten nach Faktoren zu fragen, die bei ihm einen AD-Schub auslösen. So gibt es etwa Hinweise, dass sehr hohe oder sehr geringe Temperaturen, wenig Luftfeuchtigkeit oder UVB-Strahlung und vermehrtes Heizen im Haus im Winter die Hautkrankheit verschlimmern können.13 Wird durch diese Einflüsse die Hautbarriere gestört, können Allergene oder Reizstoffe leichter in die Haut gelangen und eine Kontaktdermatitis auslösen.14 Viel Zeit solle man sich zudem nehmen, um nach allfälligen Komorbiditäten zu suchen, sagte Schmid-Grendelmeier. «Manchmal ist es weniger das Ekzem selbst, das die Patienten einschränkt, sondern die assoziierten Krankheiten.» Früher sprach man vom «allergischen Marsch», das heisst, dass sich die Symptome in charakteristischer Reihenfolge nacheinander entwickeln:15 Zunächst hat das Kind Milchschorf, dann bekommt es eine Neurodermitis, entwickelt eine Nahrungsmittelallergie und später allergische Rhinitis und allergisches Asthma. Dieses Konzept wird aber zunehmend kritisiert, denn diese klassische Reihenfolge ist nur bei etwa 7% der Patienten zu beobachten.16 Manche Autoren plädieren daher dafür, eher von einem «atopischen Cluster» zu sprechen.15
Die Liste der Begleitkrankheiten ist lang: Neben Asthma, Rhinitis und Nahrungsmittelallergien leiden Patienten mit AD häufiger unter Infektionen mit Viren, Bakterien oder Pilzen, die durch Sepsis oder Endokarditis auch lebensbedrohlich sein können. Weiter treten Schlafstörungen sowie psychiatrische Krankheiten wie Depressionen, Angststörungen, Aufmerksamkeitsdefizit/Hyperaktivitäts-Syndrom und Autismus-Spektrum-Störungen auf.17 «Das breite Spektrum der Komorbiditäten zeigt, dass AD eine systemische Krankheit mit zum Teil weitreichenden Folgen sein kann», so Schmid-Grendelmeier. Widersprüchliche Studien gab es bisher dazu, ob AD auch mit einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen einhergeht. Dass der Zusammenhang komplexer ist als gedacht, fand jüngst ein Forscherteam, an dem auch Schmid-Grendelmeier beteiligt war, aus Zürich, Davos und Augsburg in einer Studie mit 677 AD-Patienten und 79 Kontrollpatienten heraus.18 Insgesamt zeigte sich keine Korrelation zwischen AD und Herz-Kreislauf-Erkrankungen. Aber bei Patienten mit AD ohne atopische Komorbiditäten ging eine erhöhte Krankheitsaktivität mit einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen einher (Abb.3). «Die Schwere der AD scheint die Wahrscheinlichkeit für Herz-Kreislauf-Schäden zu beeinflussen, aber nur bei Patienten mit «reiner» AD, also ohne atopische Komorbiditäten», so das Fazit von Schmid-Grendelmeier. Welche Mechanismen dahinterstecken, versuche das Team gerade herauszufinden. «Es scheint an einer Zunahme gewisser Zytokine zu liegen.» Welche Konsequenzen das für die Praxis habe, sei noch nicht klar. «Möglicherweise müssen wir Patienten mit reiner AD häufiger auf kardiovaskuläre Komplikationen screenen.»
Abb. 3: Atopische Dermatitis (AD) und erhöhtes Risiko für Herz-Kreislauf-Erkrankungen. Die Schwere der AD scheint die Wahrscheinlichkeit für Herz-Kreislauf-Schäden zu beeinflussen, aber nur bei Patienten mit AD ohne atopische Komorbiditäten (modifiziert nach Fehr D et al. 2025)18
Eine weitere wohl bisher zu wenig beachtete Komorbidität sei Osteoporose. Gemäss einer Metaanalyse von 2021 aus zehn Studien mit insgesamt mehr als drei Millionen Teilnehmern geht eine AD mit einem erhöhten Risiko für verringerte Knochendichte, Osteopenie, Osteoporose und dadurch bedingte Frakturen einher.19 Der Zusammenhang ist deutlich auch bei Kindern zu sehen.20 «Möglicherweise ist das durch die Steroidtherapie bedingt», meinte Schmid-Grendelmeier. Positiv auf die Knochen könnte sich eine Behandlung mit Biologika auswirken. In einer Studie21, die bisher nur als Abstract in einer Sonderausgabe des British Journal of Dermatology veröffentlicht wurde, hatten Kinder mit AD und Dupilumab höhere Bone-Alkaline-Phosphatase(BALP)-Spiegel im Serum als diejenigen mit Placebo. Eingeschlossen waren 245 Kinder zwischen 6 und 11 Jahren, davon 203 ohne vorherige systemische Steroidtherapie und 42 mit. Der Effekt von Dupilumab war unabhängig davon, ob das Kind vorher Glukokortikoide genommen hatte oder nicht. «Dass Dupilumab die BALP erhöht, ist nachvollziehbar, weil dadurch der Gebrauch von Steroiden, insbesondere mit systemischer Applikation, meist vermindert werden kann», sagte Schmid-Grendelmeier. «Aber es wurde noch nie so klar gezeigt.» Was sich daraus für die Therapie ergebe, müssten erst weitere Studien klären. «Erst muss nachgewiesen werden, dass sich die erhöhten BALP-Spiegel dann auch positiv auf das Frakturrisiko auswirken.»
Quelle:
Zürcher Dermatologische Fortbildungstage, Vortrag von Prof. Dr. med. Peter Schmid-Grendelmeier am 21.6.2025
Literatur:
1 Rehbinder EM et al.: Frequent oil baths and skin barrier during infancy in the PreventADALL study. Br J Dermatol 2024; 191(1): 49-57 2 Thyssen JP et al.: Evidence that loss-of-function filaggrin gene mutations evolved in Northern Europeans to favor intracutaneous vitamin D3 production. Evol Biol 2014; 41(3): 388-96 3 Bradshaw LE et al.: Emollient application from birth to prevent eczema in high-risk children: the BEEP RCT. Health Technol Assess 2024; 28(29): 1-116 4 Bakker D et al.: Biomarkers in atopic dermatitis. J Allergy Clin Immunol 2023; 151(5): 1163-8 5 Werfel T et al.: S3 guideline atopic dermatitis: part 1 - general aspects, topical and non-drug therapies, special patient groups. J Dtsch Dermatol Ges 2024; 22(1): 137-53 6 Tokura Y, Hayano S: Subtypes of atopic dermatitis: from phenotype to endotype. Allergol Int 2022; 71(1): 14-247 Scala E et al.: A microarray-based IgE-molecular mimicry index (IgE-MMI): a biomarker for disease severity, clinical phenotypes, and therapeutic response in atopic dermatitis? Allergy 2024; 79(12): 3415-29 8 Matricardi PM et al.: The „allergic nose as a pollen detector“ concept: e-Diaries to predict pollen trends. Pediatr Allergy Immunol 2023; 34(6): e13966 9 Caubet JC et al.: Utility of casein-specific IgE levels in predicting reactivity to baked milk. J Allergy Clin Immunol 2013; 131(1): 222-4 10 Ito K et al.: The usefulness of casein-specific IgE and IgG4 antibodies in cow’s milk allergic children. Clin Mol Allergy 2012; 10(1): 1 11 Bartuzi Z et al.: Contribution of molecular allergen analysis in diagnosis of milk allergy. Curr Allergy Asthma Rep 2017; 17(7): 46 12 Kleine-Tebbe J, Jakob T: Molecular allergy diagnostics. Innovation for a better patient management. Springer 2017; 12(3): 291-304 13 Wang SP et al.: Impact of climate change on atopic dermatitis: a review by the international eczema council. Allergy 2024; 79(6): 1455-69 14 Engebretsen KA et al.: The effect of environmental humidity and temperature on skin barrier function and dermatitis. J Eur Acad Dermatol Venereol 2016; 30(2): 223-49 15 Belgrave DCM et al.: Developmental profiles of eczema, wheeze, and rhinitis: two population-based birth cohort studies. PLoS Med 2014; 11(10): e1001748 16 Paller AS et al.: The atopic march and atopic multimorbidity: many trajectories, many pathways. J Allergy Clin Immunol 2019; 143(1): 46-55 17 Brunner PM et al.: Increasing comorbidities suggest that atopic dermatitis is a systemic disorder. J Invest Dermatol 2017; 137(1): 18-25 18 Fehr D et al.: Deciphering the connection between atopic dermatitis and cardiovascular diseases: analysis of clinical associations and cardiometabolic proteins. Allergy 2025; 80(8): 2187-200 19 Wu D et al.: Bone mineral density, osteopenia, osteoporosis, and fracture risk in patients with atopic dermatitis: a systematic review and meta-analysis. Ann Transl Med 2021; 9(1): 40 20 Lee SW et al.: Fracture incidence in children after developing atopic dermatitis: a Korean nationwide birth cohort study. Allergy 2023; 78(3): 871-5 21 Irvine AD et al.: 676 - Dupilumab increases levels of bone growth biomarker irrespective of prior use of systemic corticosteroids in children with moderate-to-severe atopic dermatitis. Br J Dermatol 2024; 191(Supple_2): ljae266.050
Das könnte Sie auch interessieren:
Biologika-Therapie: Pipeline und Klinik
Biologika bieten die Option, in die hinter der atopischen Dermatitis stehenden Immunprozesse gezielt einzugreifen. Dieser Weg wurde zuerst mit dem Anti-IL-4/IL-13-Antikörper Dupilumab ...
Komorbiditäten bei atopischer Dermatitis
Atopische Dermatitis (AD) ist häufig mit atopischen und nicht atopischen Komorbiditäten assoziiert. Das Auftreten von Begleiterkrankungen bzw. das Risiko dafür kann in vielerlei Hinsicht ...
Psoriasis früh und aggressiv therapieren
Wird es einmal möglich sein, Psoriasis zu heilen bzw. eine langfristige Symptomfreiheit nach Absetzen einer Therapie zu erreichen? Verschiedene Wege zu diesem Ziel werden in Studien ...
%20und%20erh%C3%B6htes%20Risiko%20f%C3%BCr%20Herz-Kreislauf-Erkrankungen..jpg)