Die wichtigsten Ergebnisse des abwechslungsreichen Studienreigens
Bericht:
Dr Susanne Kammerer
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zum ersten Mal seit drei Jahren fand das Jahrestreffen der „American Academy of Dermatology“ (AAD) wieder als Präsenzveranstaltung statt. Die Freude hierüber war den Teilnehmern deutlich anzumerken. Besonders heiß diskutiert wurden die Studien, die im Rahmen der Late-Breaking-Sitzung vorgestellt wurden.
Nach wie vor besteht ein dringender Bedarf an Therapieoptionen für die mittelschwere bis schwere atopische Dermatitis (AD), z.B. für Patienten, die auf die Therapie mit Dupilumab nicht ansprechen oder diese nicht vertragen. Am diesjährigen Kongress wurden gleich zwei vielversprechende neuartige Therapieoptionen vorgestellt.
Die beiden randomisierten, doppelblinden, placebokontrollierten Phase-III-Studien ADvocate1 und ADvocate2 untersuchten den IL-13-Blocker Lebrikizumab als Monotherapie bei mittelschwerer bis schwerer AD.1 „Es handelt sich um eine laufende 52-Wochen-Studie, aber zum jetzigen Zeitpunkt sprechen wir über den 16-Wochen-Endpunkt“, erklärte Prof. Jonathan Silverberg, George Washington University School of Medicine, Washington D.C. (USA), in seiner Präsentation.
Die Studien umfassten 851 jugendliche und erwachsene Atopiker, die überwiegend aus den USA und Europa stammten. Mehr als die Hälfte der Teilnehmer hatten bereits eine systemische Therapie in der Vorgeschichte. Bei allen Patienten bestand die AD-Diagnose bereits mehr als 14 Jahre, und etwa 40% litten an einer schweren AD. Das Erreichen eines „Investigators’ Global Assessment“(IGA)-Scores von 0/1 mit einer Verbesserung um mindestens 2 Punkte vom Ausgangswert und eine Verbesserung des „Eczema Area and Severity Index“ (EASI) um 75% waren primäre Studienendpunkte.
Im Vergleich zu Placebo zeigte sich die aktive Behandlung mit 250mg Lebrikizumab alle 2 Wochen in beiden Studien deutlich überlegen. In Woche 16 erreichten 43% der Patienten in ADvocate1 einen IGA 0/1 gegenüber 12,8% unter Placebo (p<0,001). In ADvocate2 waren dies 33,1% gegenüber 10,9% (p<0,001). Die entsprechenden Raten für EASI75 waren: 59,3% versus 16,4% (p<0,001) bzw. 50,8% versus 18,2% (p<0,001). Bemerkenswert ist, dass die Unterschiede zwischen Lebrikizumab und Placebo bereits ab Woche 4 für beide Messgrößen signifikant waren. Die EASI90-Ansprechraten betrugen 38,2% und 30,2%, beide mit p<0,001 im Vergleich zu Placebo. Darüber hinaus sank in einer numerischen Bewertungsskala der Juckreiz um ≥4 Punkte bei 38,7% bzw. 26,5% der mit Lebrikizumab behandelten Patienten im Vergleich zu nur 5,1% bzw. 7,8% der Patienten in der Placebogruppe. Auch weitere Parameter veränderten sich positiv: So verbesserten sich dank der Behandlung sowohl die Lebensqualität, gemessen im „Dermatology Life Quality Index“ (DLQI), um ≥4 Punkte (74,5% und 64,4%) als auch Schlafstörungen (38,7% und 26,5%). „Dies sind klinisch relevante Ergebnisse“, betonte Prof. Silverberg.
Der Prozentsatz von Nebenwirkungen jeglicher Art war in den Placebogruppen insgesamt höher als in den Lebrikizumab-Gruppen (51,5% versus 45,4% in ADvocate1 und 66,2% versus 53% in ADvocate2). Ein Signal für Konjunktivitis wurde mit über 7% in der Verumgruppe gegenüber 2,1% bis 2,8% unter Placebo beobachtet. Sämtliche dieser Konjunktivitisfälle wurden als leicht oder mittelschwer eingestuft.
Angesichts dieser Ergebnisse betonte Prof. Silverberg: „Wir sind sehr gespannt auf die 52-Wochen-Daten.“
Weniger Konjunktivitis durch anderes Wirkprinzip
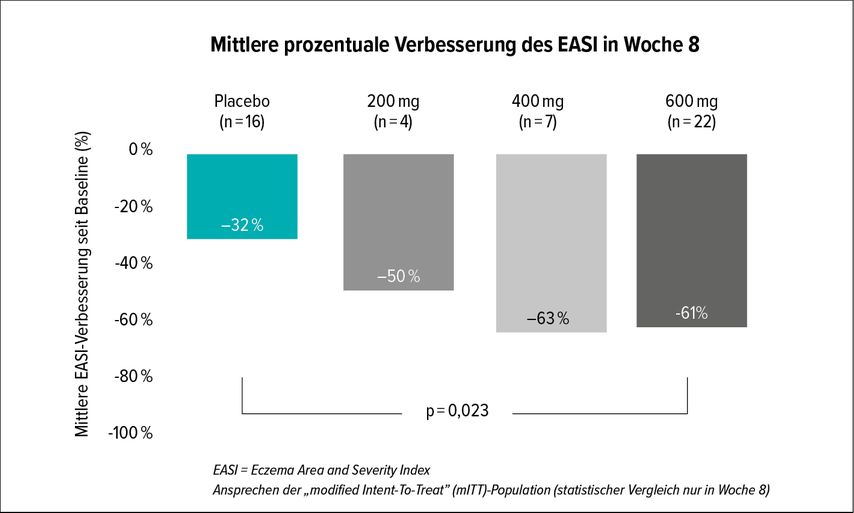
Eblasakimab inhibiert zwar ebenfalls IL-13, doch dieser Antikörper richtet sich selektiv gegen den IL-13-Rezeptor (R) α1 und blockiert sowohl die IL-4- als auch die IL-13-Signalübertragung über den Typ-2-Rezeptor. „Dupilumab blockiert das gesamte IL-4. Dieses Medikament hingegen blockiert nur einen Teil von IL-4, jedoch das gesamte IL-13“, erklärte Prof. Antony Blauvelt, Oregon Medical Research Center, OR (USA) den Unterschied.2 Die Hoffnung ist, dass die nur partielle IL-4-Blockade eine bessere Verträglichkeit, insbesondere eine Verringerung der Zahl an Konjunktivitiden, nach sich zieht. Dies scheint einer ersten Pilotstudie zufolge tatsächlich der Fall zu sein: 24 Erwachsene mit mittelschwerer oder schwerer atopischer Dermatitis von mindestens 3 Jahren Dauer, einem EASI ≥16, einem IGA-Score ≥3 (auf einer Skala von 0 bis 4) und einer Beteiligung von mindestens 10% der Körperoberfläche nahmen an der Studie teil. Im Rahmen einer Dosiseskalation wurden sie im Verhältnis 1:3 randomisiert und erhielten entweder Placebo oder eine von drei wöchentlichen Dosen von Eblasakimab (200–600mg). Anschließend wurden weitere 27 Patienten im Verhältnis 2:1 auf die höchste Eblasakimab-Dosis oder Placebo randomisiert. Der primäre Endpunkt war die mittlere prozentuale Verbesserung des EASI in Woche 8 (Abb. 1).
Abb. 1: Primärer Studienendpunkt einer Pilotstudie zur Therapie der AD mit Eblasakimab versus Placebo (nach Blauvelt A et al.)2
Zu diesem Zeitpunkt war der EASI in der höchsten Eblasakimab-Dosis um 61%, in der 400-mg-Dosis um 63% und in der 200-mg-Dosis um 50% gesunken, verglichen mit 32% unter Placebo (p=0,023). Ein Behandlungseffekt wurde bereits innerhalb der ersten Woche festgestellt.
50% der Patienten, die mit der 600-mg-Dosis Eblasakimab behandelt wurden, und 57% der Patienten mit der 400-mg-Dosis erreichten an Woche 8 sogar ein EASI-70-Ansprechen (p=0,018 gegenüber Placebo). Das Biologikum hatte auch eine deutliche juckreizlindernde Wirkung: Der Juckreiz-Score verringerte sich mit der höchsten Dosis des Antikörpers um 37% im Vergleich zu 16% mit Placebo (p=0,032).
Die Häufigkeit mittelschwerer bis schwerer unerwünschter Ereignisse (AE) war bei der 600-mg-Dosis des Antikörpers und bei Placebo vergleichbar, unerwünschte Ereignisse, die zum Abbruch der Behandlung führten, traten sogar häufiger unter Placebo auf.
Erfreulicherweise wurde nur bei insgesamt 3 mit Eblasakimab behandelten Patienten eine Bindehautentzündung beobachtet, eine davon in der 600-mg-Gruppe. „Es handelt sich um eine kleine Zahl von Patienten und nur 8 Wochen Therapie, aber das Konjunktivitis-Signal scheint geringer zu sein“, sagte Prof. Blauvelt. Aufgrund dieser vielversprechenden Ergebnisse wird nun eine Phase-IIb-Studie mit einer größeren Patientenzahl durchgeführt.
JAK-Inhibitoren: 1-Jahres-Daten zeigen langfristigen Therapieerfolg bei Alopecia areata
Die bisherigen Behandlungsmöglichkeiten der Alopecia areata (AA) sind relativ unbefriedigend – ein Zustand, der sich bald ändern könnte. „Mit jedem Treffen kommen wir der Zulassung von Therapien für unsere Patienten, die schon lange an dieser Krankheit leiden, näher“, sagte Prof. Brett King, Yale School of Medicine, New Haven (USA), mit Blick auf die Alopecia areata.3 Er präsentierte die 52-Wochen-Daten aus den Verlängerungsphasen der Phase-III-Studien BRAVE-AA1 und BRAVE-AA2, in denen der orale selektive JAK1/2-Inhibitor Baricitinib zur Therapie der AA getestet wurde.
In die Phase-III-Studien wurden insgesamt 1200 Erwachsene mit einem Haarausfall von ≥50%, gemessen im „Severity of Alopecia Tool“(SALT)-Score, eingeschlossen. Nach der Randomisierung erhielten sie einmal täglich Placebo bzw. 2mg oder 4mg Baricitinib. In der 4-mg-Gruppe erreichten 34% einen SALT-Score ≤20 und 24,9% einen SALT-Score ≤10. „Wenn man sich die Ausgangssituation der Patienten vor Augen führt, ist ein Haarausfall am Kopf von 10% oder weniger fast eine Eradikation der Krankheit“, kommentierte Prof. King.
Die Ergebnisse der offenen Verlängerungsphase über 52 Wochen, bei der auch die zuvor mit Placebo therapierten Patienten den Wirkstoff erhielten, waren noch vielversprechender: 39% (4mg Baricitinib) und 22,6% (2mg Baricitinib) erreichten einen SALT-Score von ≤20. Ein SALT≤10 wurde bei 28,9% bzw. 15,3% festgestellt. Auch das Nachwachsen von Wimpern und Augenbrauen verbesserte sich. In der Verlängerungsphase stieg der Anteil der Patienten mit einem „clinician-reported outcome“ von 0/1 für Haarausfall von 33,6% (Wimpern) und 33% (Augenbrauen) unter der höheren Dosis von Baricitinib in Woche 36 auf 45,3% und 44,1% in Woche 52.
„In Bezug auf die Sicherheit sahen die 52-Wochen-Daten wie die 36-Wochen-Daten aus“, betonte Prof. King. Die häufigsten unerwünschten Nebenwirkungen in der Verlängerungsphase der Studien waren Infektionen der oberen Atemwege, Nasopharyngitis, Kopfschmerzen und Akne.3
Zusammenfassend lässt sich sagen, dass eine Behandlung mit Baricitinib über einen Zeitraum von bis zu 52 Wochen die Rate der Patienten, bei denen die Haare wieder nachwuchsen, weiter erhöhte. Die begleitenden Sicherheitsbewertungen ergaben keine Unstimmigkeiten mit dem bisher bekannten Profil von Baricitinib.3,4
Add-on-Therapie der Psoriasis mit einer Darmmikrobe?
Sogenannte SINTAX-Medikamente beschreiben ein völlig neues Therapieprinzip. Sie nutzen, dass das Immunsystem des Dünndarms über die mesenterialen Lymphknoten in der sogenannten Darmachse (SINTAX) mit dem Rest des Körpers verbunden ist. So können oral verabreichte Zubereitungen aus Darmmikroben im ganzen Körper antientzündliche Wirkungen entfalten. Beim AAD wurde jetzt die erste Phase-II-Studie mit diesem Prinzip an Patienten mit milder bis mittelschwerer Psoriasis getestet.5 EDP1815 ist ein nicht lebensfähiger Stamm von Prevotella histicola, der aus einer menschlichen Zwölffingerdarmbiopsie gewonnen wurde. Er zielt auf den Dünndarm ab, verändert oder kolonisiert aber das Mikrobiom nicht und führt auch zu keiner systemischen Absorption. Präklinisch hat dieses Präparat bereits entzündungshemmende Wirkung gezeigt.
In der doppelblinden, randomisierten, placebokontrollierten Phase-II-Studie wurden 249 Teilnehmer mit leichter bis mittelschwerer Psoriasis (PASI ≥6 und ≤15) 16 Wochen lang mit 1, 4 oder 10 Kapseln von EDP1815 oder Placebo behandelt. Daran schloss sich eine 24-wöchige behandlungsfreie Nachbeobachtungsphase an.
In Woche 16 wurden in allen 3 Gruppen robuste PASI50-Ansprechen mit der Mikrobenzubereitung beobachtet: 31,9% der Teilnehmer, die 4 Kapseln einnahmen, erreichten ein PASI50-Ansprechen von 31,9% (p<0,05 gegenüber Placebo). In der Gruppe mit 10 Kapseln war das Ansprechen schlechter als in der Gruppe mit 1 Kapsel, es gab also keinen Hinweis auf eine Dosis-Wirkungs-Beziehung.
Das Ansprechen blieb bei 18 von 30 Teilnehmern in der 24-wöchigen Nachbehandlungsphase erhalten, und bei 9 von 20 Teilnehmern verbesserte sich das Ansprechen nach der Behandlung sogar: Sie erreichten am Ende des Nachbeobachtungszeitraums ein PASI75-Ansprechen oder mehr.
Das Nebenwirkungsprofil von EDP1815 war mit dem von Placebo vergleichbar. Es wurden keine schwerwiegenden unerwünschten Ereignisse beobachtet. Auch gastrointestinale Symptome oder Infektionen unterschieden sich nicht von denen unter Placebo. Das Nebenwirkungsprofil der Responder (d. h. derjenigen, die einen PASI-Wert von 50 oder mehr erreichten) entsprach demjenigen der übrigen Kohorte.
Dr. Douglas Maslin (Evelo Biosciences, MA, USA) kam zu dem Schluss, dass EDP1815 das Potenzial hat, eine Basis-Psoriasisbehandlung für alle Stadien der Krankheit zu sein. Mit diesem ersten SINTAX-Medikament kann eine signifikante und klinisch bedeutsame Verbesserung des PASI50- und des PGA-0/1-Ansprechens erreicht werden. Trotz dieser starken Wirkung weist das Mikrobenpräparat eine placeboähnliche Sicherheit und Verträglichkeit auf.
„Meiner Meinung nach kann das Behandlungsergebnis eine gewisse Langlebigkeit aufweisen, da auch die T-regulatorischen Zellen durch EDP1815 beeinflusst werden“, sagte Dr. Douglas.
In der anschließenden Diskussion betonte Prof. Blauvelt, dass SINTAX-Medikamente den Vorteil der oralen Verabreichung aufweisen. Zudem sind sie äußerst sicher und erschwinglich. Trotz der geringeren Wirkstärke könnten sie in Zukunft eine Rolle bei der Psoriasisbehandlung spielen, z.B. in Kombination mit Biologika.
Quellen:
1 Silverberg JI et al.: Efficacy and safety of lebrikizumab in moderate-to-severe atopic dermatitis: results from two Phase 3, randomized, double-blinded, placebo-controlled trials. AAD 2022 Annual Meeting, 25-29 March, Boston, USA; S026
2 Blauvelt A: Eblasakimab, a human IL-13 Rα1 monoclonal antibody, in adult patients with moderate-to-severe dermatitis: a randomized double-blind, placebo-controlled proof-of-concept study. AAD 2022 Annual Meeting, 25-29 March, Boston, USA; S026
3 King B: Long-term efficacy of baricitinib in patients with severe alopecia areata: week-52 results from BRAVE-AA1 and BRAVE-AA2. AAD 2022 Annual Meeting, 25-29 March, Boston, USA; S026
4 King B, et al.: Integrated safety analysis of baricitinib in adults with severe alopecia areata from two randomized clinical trials. AAD 2022 Annual Meeting, 25-29 March, Boston, USA; P33966
5 Maslin D: A phase 2 study investigating the effect of EDP1815, an oraly-delivered, anti-inflammatory, gut-restricted commensal microbe in the treatment of mild and moderate plaque psoriasis. AAD 2022 Annual Meeting, 25-29 March, Boston, USA; S026
Das könnte Sie auch interessieren:
Narbenbehandlung ohne Devices
Für die Behandlung von Narben hat sich der Einsatz moderner Lasertechnologien als effektiv erwiesen. Doch wie kann man den Betroffenen helfen, wenn kein ablativer fraktionierter CO2- ...
Update atopisches Ekzem
In den vergangenen Jahren haben sich das Verständnis des atopischen Ekzems (AE) sowie die therapeutischen Möglichkeiten deutlich weiterentwickelt. Und der Weg ist noch nicht zu Ende ...
Coaching für Ärzt:innen: Klarheit finden, an Stärke gewinnenEinblicke in den Coachingprozess
Die Anforderungen an Ärztinnen und Ärzte in Kliniken und Praxen sind enorm. Neben fachlichem Können werden täglich auch persönliche Ressourcen wie Resilienz und Entscheidungsstärke ...