Biomarker für die Melanomtherapie
Autorinnen:
Nina Zila, BSc, MSc
Ass. Prof.in Priv.Doz.in Dr.in Verena Paulitschke, PhD
Medizinische Universität Wien
Universitätsklinik für Dermatologie
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim metastasierenden Melanom haben Immuntherapien bahnbrechende Erfolge erzielt, jedoch spricht nur die Hälfte der Patienten auf sie an. Resistenzen frühzeitig zu erkennen ist daher von großer Bedeutung. Wir berichten, wie mit Biomarkern „Responder“ erkannt und unwirksame Therapien verhindert werden können.
Keypoints
-
Ein einzelner Marker scheint nicht auszureichen, um das Ansprechen verlässlich vorherzusagen. Erklären lässt sich das durch die komplexe Wechselwirkung zwischen Tumorzellen und -mikroumgebung sowie die Heterogenität und Plastizität von Tumoren.
-
Eine Kombination von Markern könnte zielführend sein. Diese müssten auch das Tumormilieu abbilden, wie etwa Immunzellen, Tumormutationslast, Neoantigene, das Mikrobiom und die Faktoren des Krebs-Immunogramms.
-
Multi-Omics-Studien von Tumorzellen, Immunzellen, der Mikroumgebung oder des Darmmilieus könnten ein möglichst umfassendes Bild liefern.
Die Immuntherapie maligner Tumore hat die klinische Behandlung des metastasierten Melanoms enorm beeinflusst, insbesondere durch Immun-Checkpoint-Inhibitoren (ICI). Mit ICI kann das Immunsystem moduliert werden, indem T-Zellen aktiv den Tumor bekämpfen. Die ersten Immun-Checkpoint-Targets waren CTLA-4 (Cytotoxic T-lymphocyte-associated protein 4), PD-1 (Programmed cell death protein 1) und sein Ligand PD-L1. Die Bindung von CTLA-4 (CD152) an die Liganden CD80 (B7-1) und CD86 (B7-2) liefert ein negatives Signal zur T-Zell-Aktivierung1, während die Bindung von PD-1 (CD279) an seine Liganden PD-L1 und PD-L2 (CD273, B7-DC) die Aktivierung und Funktion von T-Zellen unterdrückt und dadurch die adaptive Immunantwort herunterreguliert2,3.
In den letzten Jahren hat sich dadurch das mediane Überleben von Melanompatienten auf 32,7 Monate verlängert.4 Trotz der guten klinischen Ergebnisse bei einem Teil der Patienten liegt die Rate des Ansprechens auf Immuntherapie jedoch nur bei etwa 50%, da oftmals eine intrinsische oder erworbene Resistenz gegen ICI vorliegt.5 Daher sind Patienten potenziell unnötigen Nebenwirkungen ausgesetzt, verlieren wertvolle Zeit und verpassen möglicherweise ihr Behandlungsfenster.6 Um eine individualisierte Therapie zu ermöglichen und unwirksame Behandlungen und deren Toxizität zu vermeiden, wird an Biomarkern geforscht, welche im besten Fall eine genaue Vorhersage des Ansprechens von Patienten ermöglichen und frühzeitig eine entstehende Resistenz erkennen sollen (prädiktive und pharmakodynamische Marker).7 Mehrere Biomarkerstrategien wurden bereits entwickelt und darauf untersucht, ob sie das Ansprechen auf eine Immuntherapie beim fortgeschrittenen Melanom vorhersagen können.8
Expression von PD-L1
Im Hinblick auf das Ansprechen auf eine Anti-PD-1-Therapie ist vermutlich der erste Gedanke und die logische Wahl die Bestimmung der PD-L1-Expression direkt auf den Tumorzellen. Während einige Studien darauf hindeuten, dass PD-1 und PD-L1 nützliche Biomarker sein könnten,9 weisen andere sie eher als korrelative, aber nicht prädiktive Marker aus, da auch Patienten ohne PD-L1-exprimierende Tumoren mit einer Anti-PD-1/PD-L1-Therapie einen Überlebensvorteil erzielen können.10 Daher ist die Identifizierung potenzieller neuer Marker von entscheidender Bedeutung. Diese Marker können entweder vom Tumor stammen, wie LDH, S100, lösliches PD-L1, zirkulierende Tumorzellen, zirkulierende Tumor-DNA/RNA und vom Tumor stammende extrazelluläre Vesikel, oder sie können vom Individuum stammen, wie das C-reaktive Protein (CRP), Zytokine/Chemokine, Autoantikörper, HLA- und Immunzellsubtypen.
Analyse der Immunzellen
Darüber hinaus wurden verschiedene Immunzellsubtypen als potenzielle Prädiktoren für das klinische Ergebnis untersucht. So ist beispielsweise die Zunahme von Neutrophilen im Verhältnis zu Lymphozyten (neutrophil-to-lymphocyte ratio, NLR) bei Melanompatienten, die eine Anti-PD-1-Monotherapie erhalten, mit einem Therapieversagen verbunden.12 Die Häufigkeit von PD-1+CD56+-T-Zellen scheint ein weiterer unabhängiger prädiktiver Faktor für den klinischen Erfolg einer PD-1-Blockade zu sein,13 während eine massenzytometrische Analyse von Tumorbiopsien ergab, dass ein EOMES+CD69+CD45RO+-Effektor-Gedächtnis-T-Zell-Phänotyp bei Respondern im Vergleich zu Non-Respondern deutlich häufiger vorkommt.14 Die Analyse von Immunzelluntergruppen auf Einzelzellebene im peripheren Blut von Patienten mit fortgeschrittenem Melanom vor Anti-PD-1-Immuntherapie ergab, dass die Häufigkeit von CD14+CD16-HLA-DRhi-Monozyten ein starker Prädiktor in Bezug auf das progressionsfreie Überleben (PFS) und das Gesamtüberleben (OS) ist.15
Tumormikroumgebung
Eine weitere Strategie zur Vorhersage des klinischen Nutzens von ICI ist die Bewertung der angeborenen und adaptiven Immunantworten innerhalb der Tumormikroumgebung. Der T-Zell-entzündete Tumorphänotyp ist ein positiver Prädiktor für die Anti-PD-1-Therapie und zeichnet sich durch das Vorhandensein aktivierter CD8+-T-Zellen sowie die Expression von Chemokinen und Indikatoren für die Aktivierung des Immunsystems aus, wie z.B. eine Transkriptionssignatur von Typ-I-Interferon (IFN). Der T-Zell-arme Tumorphänotyp als negativer Prädiktor sieht nicht entzündet aus und weist neben Tumorzellen auch vermehrt Angiogenese, Zellen der Makrophagenlinie und Fibroblasten auf.16 Der Ausgangszustand der Tumor-infiltrierenden Lymphozyten (TIL) im Tumor könnte ebenfalls als prädiktiver Marker für eine Checkpoint-Inhibitor-Therapie dienen.8 Die Sequenzierung des T-Zell-Rezeptor(TCR)-Repertoires zeigte, dass die Ausgangs-TIL der Responder-Gruppe eine klonalere und daher weniger vielfältige TCR-Kette aufwiesen. Darüber hinaus zeigte die Analyse des TCR-Repertoires im peripheren Blut, dass eine höhere Klonalität und ein Mangel an TCR-Diversität bei Melanompatienten ein längeres PFS und ein gutes Ansprechen auf PD-1-Blockade voraussagen.6 Ergänzend dazu könnte die Bewertung der Phänotypen von Tumor- und Immunzellen und ihrer räumlichen Verteilung durch Immunhistochemie(IHC)-Strategien einen zusätzlichen Einblick in den Immunstatus der Tumormikroumgebung geben. Ein multispektraler IHC-Ansatz, bei dem CD3, CD8, FOXP3, CD163 und PD-L1 auf Melanomgewebe analysiert wurden, konnte erfolgreich vorhersagen, bei welchen Patienten eine Tumorinfiltration durch Lymphozyten für eine adoptive Zelltherapie zu erwarten war. Darüber hinaus konnte gezeigt werden, dass das Vorhandensein von CD8+-T-Zellen allein für die Vorhersage unzureichend war, während das Verhältnis von CD8+-T-Zellen zu CD3+FOXP3+-regulatorischen T-Zellen stark mit dem erfolgreichen Wachstum von TIL assoziiert war.17 Außerdem können in der Tumormikroumgebung mehrere immunsuppressive Mechanismen gleichzeitig vorhanden sein, darunter CTLA-4, PD-L2, LAG3, IDO1 und IL-10,18,19 die sich zu wichtigen neuen Targets in der Immun-Checkpoint-Therapie entwickeln.20
Tumormutationslast und Neoantigene
Neoantigene, die durch somatische Mutationen in Passagiergenen von Tumorzellen entstehen, wurden in präklinischen Studien als primäre Auslöser adaptiver Anti-Tumor-Immunantworten identifiziert.8,21,22 Es hat sich gezeigt, dass die Wirksamkeit der Immuntherapie mit hoher Mutationslast steigt, da die Mutationen immunogen sind und somit eine tumorspezifische Immunantwort induzieren können.23 Erwartungsgemäß spricht das Melanom, als Tumorentität mit einer hohen Anzahl von Neoantigenen und einer hohen Mutationslast, sehr gut auf ICI an.24 Mehrere Studien zeigten, dass eine hohe Mutations- oder Neoantigenbelastung als prognostischer Faktor dienen und/oder den klinischen Nutzen einer Immuntherapie vorhersagen kann, da sie Rückschlüsse auf die allgemeine Antitumoraktivität des Immunsystems zulässt.25 Darüber hinaus induziert die Behandlung Veränderungen in der Mutationslast von Tumoren, da sich klonale T-Zell-Populationen proportional zur Anzahl der verlorenen Neoantigene ausbreiten.28
Weitere Ansätze
Die Erstellung von Genexpressionsprofilen von Tumorbiopsien vor Therapie ergab eine erhöhte Expression immunbezogener Genmarker insbesondere für zytotoxische T-Zellen, Th1-Zytokine/Chemokine und MHC-Klasse II, die mit einem längeren OS assoziiert sind.29 In einer retrospektiven Studie mit Melanompatienten zeigte eine entzündliche IFN-Immun-Signatur (charakterisiert durch Interferon gamma, Granzyme A und B, Perforin 1, IDO1 und LAG3) eine signifikante Korrelation mit dem besten Gesamtansprechen und dem PFS.30 Weiters konnte in präklinischen Mausmodellen gezeigt werden, dass das Darmmikrobiom das Ansprechen des Tumors auf ICI beeinflusst. Die Analyse des Mund- und Darmmilieus von Melanompatienten, welche eine Anti-PD-1-Immuntherapie erhielten, ergab signifikante Unterschiede in der Diversität und Zusammensetzung des Darmmikrobioms von Respondern und Non-Respondern. Ebenso deuteten die Immunprofile von Respondern mit einem günstigen Darmmikrobiom auf eine verbesserte systemische und antitumorale Immunität hin.31
Kombination von Markern
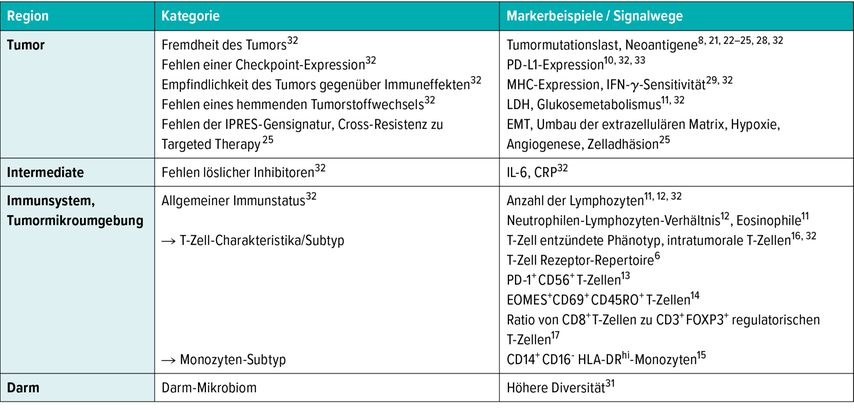
Einzelne Biomarker sind nur selten aussagekräftig, wohingegen die Kombination mehrerer Marker zu einem validierten Biomarker-Panel die Möglichkeit bietet, dieses Problem zu überwinden. Beispielsweise überlebten Melanompatienten mit hoher Eosinophilen- und Lymphozytenzahl, niedrigem LDH-Wert und fehlender Metastasierung insgesamt länger.11 Darüber hinaus konnte eine Untergruppe mit ausgezeichneter Prognose identifiziert werden, wenn alle vier Faktoren in Kombination vorlagen, was verdeutlicht, dass die Kombination von Markern die Vorhersage stärkt. Um die Suche nach Biomarkern zu fokussieren, werden im Krebs-Immunogramm („cancer immunogram“) die Interaktionen zwischen Krebs und dem Immunsystem beschrieben. Dies baut auf zwei wichtigen Beobachtungen auf. Zum einen basieren die Interaktionen zwischen Krebs und Immunsystem auf einer Reihe von weitgehend unverbundenen Parametern, zum anderen können sich die Werte dieser Parameter innerhalb einzelner Patienten deutlich unterscheiden. Die Autoren kommen ebenfalls zum Schluss, dass aufgrund des multifaktoriellen Charakters eine Kombination aus mehreren Biomarkern erforderlich ist.32 Eine Zusammenschau von potenziellen Kategorien bzw. Markern zum Ansprechen auf die Immuntherapie beim Melanom ist in Tabelle 1 zusammengestellt.
Tab. 1: Auswahl potenzieller Kategorien bzw. Marker zum Ansprechen auf die Immuntherapie beim Melanom
Schlussfolgerung
Die gleichzeitige Bewertung mehrerer Immunvariablen könnte eine genaue Vorhersage des Ansprechens auf verschiedene Immun-Checkpoint-Therapien ermöglichen. Durch genomische und transkriptomische Analysen wurden die molekularen Auswirkungen der Anti-PD-1-Therapie und die Faktoren, die die angeborene Empfindlichkeit und Resistenz gegenüber der Behandlung beeinflussen, untersucht. In der Studie von Hugo et al. wurden genomische und transkriptomische Merkmale des Ansprechens auf eine Anti-PD-1-Therapie bei metastasiertem Melanom untersucht. Die Autoren beschreiben in ihrer Arbeit „IPRES“ oder die angeborene Anti-PD-1-Resistenz, welche durch eine hochregulierte Expression von Genen gekennzeichnet ist, die an der Regulierung der epithelial-mesenchymaler Transition (EMT), der Zell-Adhäsion, des Umbaus der extrazellulären Matrix, Angiogenese etc. beteiligt sind. Dies sind ähnliche Mechanismen, die von der Resistenz gegen die Targeted Therapie beim Melanom bekannt ist. Hier liegt die Vermutung nahe, dass die MAPKi-Resistenz eine Cross Resistenz zur PD-1-Therapie vermittelt.25
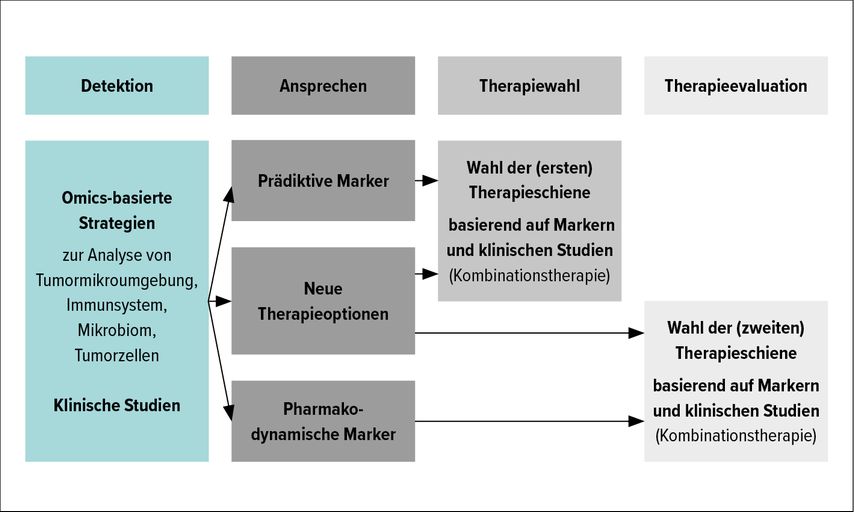
Obwohl es zahlreiche Studien zur Bewertung potenzieller Biomarker gibt, wird derzeit kein Marker in der klinischen Praxis verwendet, da diese in größeren Kohorten evaluiert werden müssen und bislang die meisten Marker lediglich die positive Population anreichern. Eine Möglichkeit, dieses Problem zu überwinden, ist die Verwendung einer Kombination mehrerer Marker, die vom Tumor selbst und/oder von der Mikroumgebung des Tumors stammen. Durch Omics-basierte Strategien, welche insbesondere zur Analyse der Tumormikroumgebung, des Immunsystems, des Mikrobioms und der Tumorzellen dienen, könnten neue Targets und Therapieoptionen identifiziert und in klinischen Studien evaluiert werden. Basierend auf diesen prädiktiven und pharmakodynamischen Markern könnte künftig das Ansprechen der Patienten sowohl vorab als auch zur Therapieevaluation laufend überprüft werden (siehe Abb. 1).
Immun-Checkpoint-Inhibitoren triggern die Abwehrreaktion von T-Zellen (gelb) gegen Tumorzellen
Literatur:
1 Chen L: Nat Rev Immunol 2004; 4: 336-47 2 Berger KN, Pu JJ: Gene 2018; 638: 20-5 3 Latchman Y et al.: Nat Immunol 2001; 2: 261-8 4 Robert C et al.: Lancet Oncol 2019; 20: 1239-51 5 Yi M et al.: J Hematol Oncol 2018; 11: 47 6 Hogan SA et al.: Cancer Immunol Res 2019: 7: 77-85 7 Hogan SA et al.: Front Oncol 2018; 8: 178 8 Gibney GT et al.: Lancet Oncol 2016; 17: e542–e551 9 Ugurel S et al.: Ann Oncol 2020; 31: 144-52 10 Strudel M et al.: Curr Med Chem 2020; 27: 2792-813 11 Weide B et al.: Clin Cancer Res 2016; 22: 5487-96 12 Bartlett EK et al.: Cancer 2020; 126: 76-85 13 Bochem J et al.: PLoS One 14, e0221301 2019; 14 Gide TN et al.: Cancer Cell 2019; 35: 238-55.e6 15 Krieg C et al.: Nat Med 2018; 24: 144-53 16 Spranger S, Gajewski T: JImmunother Cancer 2013; 1: 16 17 Feng Z et al.: J Immunother Cancer 2015; 3: 47 18 Matsushita H et al.: Cancer Immunol Res 2016; 4: 463-71 19 Taube JM et al.: Clin Cancer Res 2015; 21: 3969-76 20 Zila N et al.: Memo 2021; 14: 135-42 21 Castle JC et al.: Cancer Res 2012; 72: 1081-91 22 Matsushita H et al.: Nature 2012; 482: 400-4 23 Rooney MS et al.: Cell 2015; 160: 48-61 24 Schumacher TN et al.: Science 2015; 348: 69-74 25 Hugo W et al.: Cell 2016; 165: 35-44 26 McGranahan N et al.: Science 2016; 351: 1463-9 27 Rizvi NA et al.: Science 2015; 348: 124-8 28 Riaz N et al.: Cell 2017; 171: 934-49.e16 29 Ji RR et al.: Cancer Immunol Immunother 2012; 61: 1019-31 30 Ribas A et al.: JCO 2015; 33: 3001 31 Gopalakrishnan V et al.: Science 2018; 359: 97-103 32 Blank C et al.: Science 2016; 352: 658-60 33 Ugurel S et al.: Ann Oncol 2020; 31: 144-52
Das könnte Sie auch interessieren:
Behandlungspfad „Atopische Dermatitis“
Das Netzwerk onkoderm hat seine Empfehlungen für die ambulante Versorgung von Patienten mit atopischer Dermatitis aktualisiert: Der onkoderm-Behandlungspfad 2025 sowie weitere Tools ...
Perianale Dermatosen
Perianale Dermatosen sind ein klinisch vielgestaltiges und herausforderndes Krankheitsbild, das sowohl dermatologische als auch proktologische Kompetenzen erfordert. Dieser Überblick ...
Wege zur korrekten Diagnose
Patientinnen und Patienten mit verhärteter Haut können an sehr unterschiedlichen Erkrankungen leiden. Im Zentrum steht immer ein Fibroblast, eine mesenchymale Vorläuferzelle, die durch ...