Einfluss von Sexualhormonen auf rheumatische Erkrankungen
Bericht:
Mag. pharm. Irene Senn, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Östrogene, Androgene und Progesteron beeinflussen das Immunsystem auf vielfältige Weise. Dabei bestimmen die Hormonkonzentration und der Krankheitskontext, ob entzündungsfördernde oder -hemmende Effekte überwiegen. Neue Forschungsergebnisse deuten zudem darauf hin, dass epigenetische Mechanismen die geschlechtsspezifischen Unterschiede bei Autoimmunerkrankungen erklären könnten.
Hormonelle Regelkreise bestimmen Krankheitsverlauf
Hormonelle Regelkreise prägen den Verlauf entzündlicher Erkrankungen. Östrogene, Androgene und Progesteron werden – wie Cortisol – aus Cholesterin synthetisiert und besitzen ein gemeinsames Steroidgrundgerüst.1 Ihre immunmodulatorischen Effekte entstehen jedoch vor allem durch die Bindung an nukleäre Rezeptoren: Östrogenrezeptoren (ERα/β), Androgenrezeptoren (AR) und Progesteronrezeptoren (PR) wirken nach Ligandenbindung als Transkriptionsfaktoren. ER sind in vielen Immunzellpopulationen nachweisbar, für AR und PR ist die Expression bislang nur in einzelnen Zelltypen beschrieben.2 Die Aktivierung dieser Rezeptoren moduliert Zytokinprofile, die Lymphozytenproliferation und die Differenzierung regulatorischer T-Zellen. Am besten belegt ist dies für Östrogene, während Daten zu Androgenen und Progesteron noch begrenzt sind.3
Konzentrationsabhängige Östrogeneffekte
Die Wirkung von Östrogenen auf das Immunsystem ist konzentrationsabhängig und kontextspezifisch. Niedrige bis moderate Konzentrationen (0,1–0,6nmol/L) verstärken die B-Zell-Aktivität und Autoantikörperproduktion und wirken damit proinflammatorisch. Hohe Konzentrationen (10–30nmol/L) hingegen, wie sie im zweiten und dritten Schwangerschaftstrimester auftreten, unterdrücken die T-Zell-Aktivierung und fördern regulatorische T-Zellen mit antiinflammatorischen Effekten.2
Die unterschiedlichen Östrogenrezeptoren spielen dabei gegensätzliche Rollen: Der Östrogenrezeptor alpha (ERα) wirkt vorwiegend proinflammatorisch. Bei Patienten mit systemischem Lupus erythematodes (SLE) ist ERα in T-Zellen vermehrt exprimiert und fördert die Interferon-Produktion, B-Zell-Hyperaktivität sowie die Th2-Aktivierung über NF-κB und TLR-Signalwege. Der Östrogenrezeptor beta (ERβ) hingegen zeigt antiinflammatorische Eigenschaften. Im Synovialgewebe von Patienten mit rheumatoider Arthritis (RA) reduziert ERβ die IL-1β-Freisetzung und fördert die Expansion regulatorischer T-Zellen.2
Progesteron als Immunregulator
Progesteron zeigt durchweg antiinflammatorische und immunregulierende Eigenschaften. Es hemmt Th1- und Th17-Antworten, unterdrückt die Aktivierung angeborener Immunzellen (Makrophagen, Neutrophile, NK-Zellen) und fördert die Differenzierung regulatorischer T-Zellen. Die Autoantikörperproduktion wird durch Hemmung des Klassenwechsels in B-Zellen reduziert. Proinflammatorische Zytokine wie TNF, IL-6 und IL-1β werden supprimiert.2Die immunmodulatorische Wirkung vonProgesteron ist besonders in der Frühschwangerschaft von Bedeutung, wo es maßgeblich zur Etablierung der mütterlichen Toleranz gegenüber dem Fetus beiträgt.
Androgene als endogene Entzündungshemmer
Androgene, insbesondere Testosteron, wirken überwiegend immunregulierend und entzündungshemmend. Sie unterdrücken die T-Zell-Proliferation, hemmen Th1- und Th17-Signalwege und reduzieren die Produktion proinflammatorischer Zytokine wie TNF, IL-1β und IL-6. Gleichzeitig erhöhen sie die IL-10-Produktion und die Aktivität regulatorischer T-Zellen durch FOXP3-Induktion.2,3
Ein wichtiger Mechanismus ist der gewebespezifische intrakrine Metabolismus: In entzündeten Geweben wird Testosteron durch die von Zytokinen induzierte Aromatase vermehrt zu Östrogen umgewandelt, wodurch die protektive Wirkung verloren geht. Dieser Mechanismus erklärt teilweise das Paradoxon, warum Männer trotz höherer Androgenspiegel bei bestimmten rheumatischen Erkrankungen schwerere Verläufe zeigen können. Die lokale Konversion zu Östrogenen in entzündeten Geweben hebt den protektiven Effekt der Androgene auf und kann sogar zu einer Verstärkung der Entzündung führen.
Geschlechtsspezifische Krankheitsverläufe
Die Wechselwirkungen zwischen Hormonen und Immunsystem sind komplex und manifestieren sich klinisch in deutlichen geschlechtsspezifischen Unterschieden. Frauen sind von vielen Autoimmunerkrankungen bis zu 10-fach häufiger betroffen als Männer.4 Eine Beobachtungsstudie zeigte, dass Männer mit Hypogonadismus ein signifikant erhöhtes Risiko für die Entwicklung von RA und systemischem Lupus erythematodes (SLE) haben.5 Paradoxerweise zeigen Männer mit SLE oft schwerere Krankheitsverläufe als Frauen. Dies erklärt sich durch Polymorphismen in X-chromosomalen Genen wie TLR7, erhöhte Neutrophilenaktivierung und verstärkten oxidativen Stress. Zudem ist bei männlichen SLE-Patienten häufig ein Hypoandrogenismus mit erniedrigtem Testosteron und erhöhtem LH nachweisbar, der die natürlichen immunsuppressiven Mechanismen schwächt.6
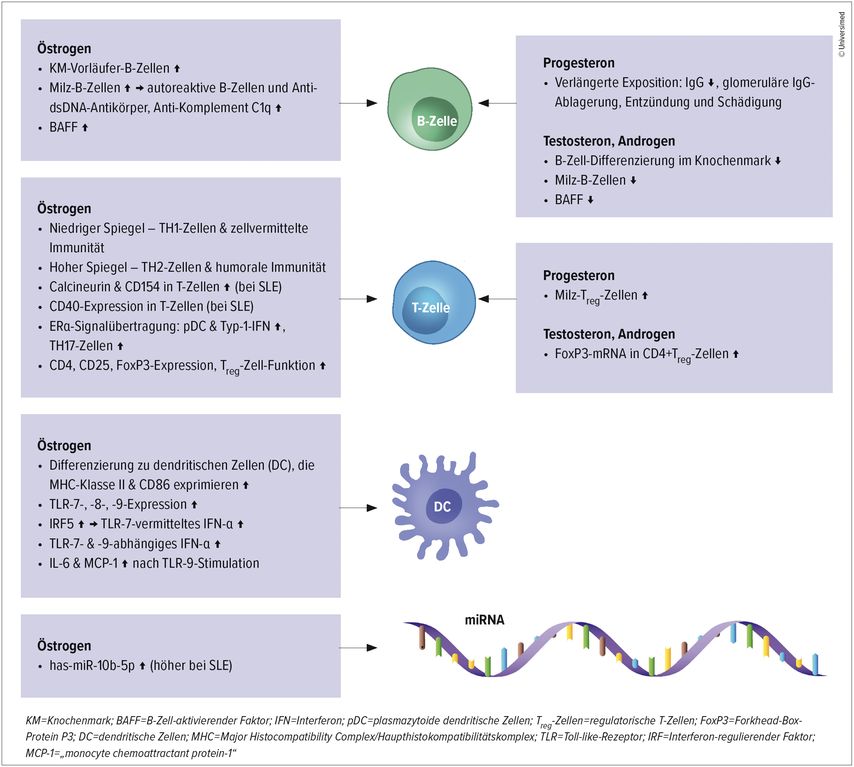
Östrogene, Progesteron und Androgene zeigen bei SLE vielfältige Effekte auf verschiedene Immunzelltypen (Abb.1). Östrogene fördern über ERα die B-Zell-Aktivierung und Autoantikörperproduktion, während sie gleichzeitig die Th2-Antwort verstärken. Progesteron wirkt überwiegend antiinflammatorisch durch Hemmung von Th1- und Th17-Antworten sowie Förderung regulatorischer T-Zellen. Androgene zeigen hauptsächlich immunsuppressive Eigenschaften durch Unterdrückung proinflammatorischer Zytokine und Verstärkung der IL-10-Produktion
Abb. 1: Wirkung von Geschlechtshormonen auf Immunzellen bei SLE (modifiziert nach Kim JW et al. 2022)6
Epigenetische Regulation durch Geschlechtshormone
Ein spannendes Forschungsfeld ist die epigenetische Modulation durch Sexualhormone. Diese beeinflussen das Immunsystem nicht nur über direkte Signalwege, sondern auch durch dauerhafte Veränderungen der Genexpression via DNA-Methylierung, Histonmodifikation und microRNA-Regulation.7 Liu et al. konnten zeigen, dass bei RA- und SLE-Patienten der ERα-Promotor häufiger demethyliert ist als bei Gesunden, was zu einer verstärkten ERα-Expression und damit zu einer östrogengetriebenen Immundysregulation führt.8 Zusätzlich reduzieren Östrogene die Expression des AIRE-Gens im Thymus durch Promotor-Methylierung, was die zentrale Toleranz schwächt und Autoimmunität fördert.9
Die epigenetischen Veränderungen gelten als stabil und können über längere Zeiträume bestehen bleiben. Dies erklärt möglicherweise, warum hormonelle Ereignisse wie Schwangerschaft oder Menopause langfristige Auswirkungen auf den Krankheitsverlauf haben können.
Schwangerschaft: Plazenta als immunologisches Schaltzentrum
Während der Schwangerschaft durchläuft das mütterliche Immunsystem tiefgreifende funktionelle und epigenetische Veränderungen. Sexualhormone und Vitamin D fungieren als epigenetische Modulatoren und kontrollieren über DNA-Methylierungsänderungen in Dezidua- und Plazentazellen die Expression von microRNAs wie C14MC und C19MC.1011 Diese plazentaspezifischen microRNAs werden über extrazelluläre Vesikel exportiert und modulieren mütterliche Immunzellen. Bei SLE führt die östrogeninduzierte Hypomethylierung zu einer erhöhten miR-155-Expression, die mit verstärkter Interferon-Signatur und Autoantikörperproduktion assoziiert ist.12 Die Plazenta fungiert dabei nicht nur als passive Barriere, sondern als aktives immunologisches Organ, das bidirektionale Signale zwischen Mutter und Fetus vermittelt. Die dabei freigesetzten extrazellulären Vesikel konnten mitunter auch noch nach der Geburt im mütterlichen Kreislauf nachgewiesen werden und beeinflussen möglicherweise die postpartale Krankheitsaktivität.
Fazit und Ausblick
Die Interaktion zwischen Sexualhormonen, Epigenetik und Entzündung ist hoch dynamisch und kontextabhängig. Östrogene können je nach Konzentration und Krankheitskontext entzündungsfördernd oder -hemmend wirken, während Androgene und Progesteron überwiegend antiinflammatorische Effekte zeigen. Die aktuellen Erkenntnisse unterstreichen die Notwendigkeit, in der Präzisionsmedizin geschlechtsspezifische Immunregulationsmechanismen zu berücksichtigen. Besonders bei hormonellen Übergängen – Menarche, Schwangerschaft, Menopause – sollten Rheumatologen auf mögliche Veränderungen der Krankheitsaktivität achten und ihre Therapiestrategien entsprechend anpassen.
Quelle:
„The influence of sex hormones on the course of autoimmune rheumatic diseases“, Vortrag von Dr. Elvis Hysa, Genua, im Rahmen der 13th International Conference on Reproduction, Pregnancy and Rheumatic diseases (RheumaPreg 2025) vom 8.–10. Mai 2025 in Wien
Literatur:
1 Payne AH et al.: Endocr Rev 2004; 25(6): 947-70 2 Cutolo M et al.: Nat Rev Rheumatol 2020; 16(11): 628-44 3 Hughes GC et al.: Nat Rev Rheumatol 2014; 10(12): 740-51 4 Valeff NJ et al.: Front Endocrinol (Lausanne) 2023; 14: 1233883 5 Baillargeon J et al.: Clin Rheumatol 2016; 35(12): 2983-7 6 Kim JW et al.: Front Med (Lausanne) 2022; 9: 906475 7 Gotelli E et al.: Clin Exp Rheumatol 2024; 42(11): 2131-40 8 Liu HW et al.: Mol Immunol 2014; 61(1): 28-37 9 Dragin N et al.: J Clin Invest 2016; 126(4): 1525-37 10 Pacini G et al.: Autoimmun Rev 2020; 19(12): 102685 11 Kovács T et al.: Int J Mol Sci 2020; 21(9): 3177 12 Morales-Prieto DM et al.: Placenta 2020; 102: 27-33
Das könnte Sie auch interessieren:
Noch immer ein Thema?
Auch mehrere Jahre nach der eigentlichen Covid-Pandemie ist die Frage, ob Covid und Autoimmunerkrankungen sich gegenseitig beeinflussen, immer noch sehr aktuell. Befragt man PubMed, so ...
Neue Lupustherapien in der Schwangerschaft
Innovative Biologika (bDMARD) und zielgerichtete Therapien (tsDMARD) bieten Kliniker:innen neue therapeutische Werkzeuge bei der Behandlung des systemischen Lupus erythematodes (SLE). Im ...
Spondyloarthritis: Schäden sind bei frühzeitiger Therapie reversibel
Das alte Konzept der nichtradiografischen axialen Spondyloarthritis und der radiografischen ankylosierenden Spondylitis wird zunehmend verlassen und in der Diagnose axiale ...