CARs bei T-Zell-Lymphomen: Geht das?
Autoren:
Dr. Philipp Lückemeier
Prof. Dr. Marco Herling
Universitätsklinikum Leipzig AöR, Leipzig
Korrespondenz:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
CAR-T-Zellen haben die Therapie vieler Lymphome revolutioniert, aberausgerechnet bei den ohnehin schlecht therapierbaren T-Zell-Lymphomen gab es diesbezüglich noch keine Zulassungen. Der Grund steckt schon im Namen. Die Lösung auch?
Keypoints
-
Periphere T-Zell-Lymphome sind eine seltene, heterogene Gruppe von Erkrankungen entarteter T-Zellen. Trotz großer Fortschritte in der Grundlagenforschung gab es kaum Neuerungen in der Therapielandschaft und keine signifikante Besserung der Prognose der meisten PTZL in den letzten 30 Jahren.
-
CAR-T-Zellen repräsentieren eine revolutionäre Therapie, die besonders bei den B-NHL deutliche Prognosebesserungen erzielen konnte. PTZL profitierten bisher nicht von diesem Fortschritt. Das liegt an einzigartigen Hürden wie dem Mangel an universellen Zielantigenen und gesunden autologen T-Zellen sowie der Machbarkeit großer klinischer Studien.
-
Innovative CAR-Konzepte bei PTZL beinhalten neue Zielantigene, umfassende gentechnische Veränderungen von allogenen und autologen CAR-T-Zellen sowie neue CAR-tragende Immunzellen wie NK-Zellen und Makrophagen.
Periphere T-Zell-Lymphome (PTZL) sind verhältnismäßig selten und trotzdem sehr heterogen: Sie machen etwa 10% aller Lymphome weltweit aus und bestehen laut aktueller WHO-2022-Klassifikation aus über 25 Entitäten. Das macht groß angelegte Studien zu neuen Therapeutika schwierig, teuer und langwierig.
Während es bei weniger seltenen hämatologischen Neoplasien zuletzt rasante therapeutische Entwicklungen gegeben hat, wurde die Standardtherapie der meisten PTZL („CHOP“) seit nunmehr 47 Jahren nur vereinzelt in ihrer Wirkung geschlagen.1 Ein Meilenstein war lediglich die Zulassung des Immunkonjugates Brentuximab Vedotin als BV-CHP-Erstlinienregime beim anaplastisch-großzelligen T-Zell-Lymphom (ALCL). Da überrascht es wenig, dass retrospektive und prospektive Daten zu aggressiven PTZL weiterhin eine 5-Jahres-Überlebensrate von etwa 30% zeigen – ein Wert, den wir seit mindestens 30 Jahren nicht signifikant verbessern konnten.2–4
Dabei gab es durchaus deutliche Fortschritte in der Erforschung der Pathogene-se und verfeinerten Diagnostik der verschiedenen PTZL-Entitäten. Die Identifikation von Treibermutationen und Dysregulationsprozessen in epigenetischen Regulatoren (TET2, IDH2, DNMT3A), Signalwegen des T-Zell-Rezeptors (PLCG1, CD28, PIK3) und anderen häufigen Treibern (STAT3, GATA3, TP53) bietet zudem Rationalen für neue Therapieansätze wie hypomethylierende Substanzen (z.B. Azacitidin), Histon-Deacetylase-Inhibitoren (z.B. Belinostat) oder PI3K-Inhibitoren (z.B. Duvelisib).
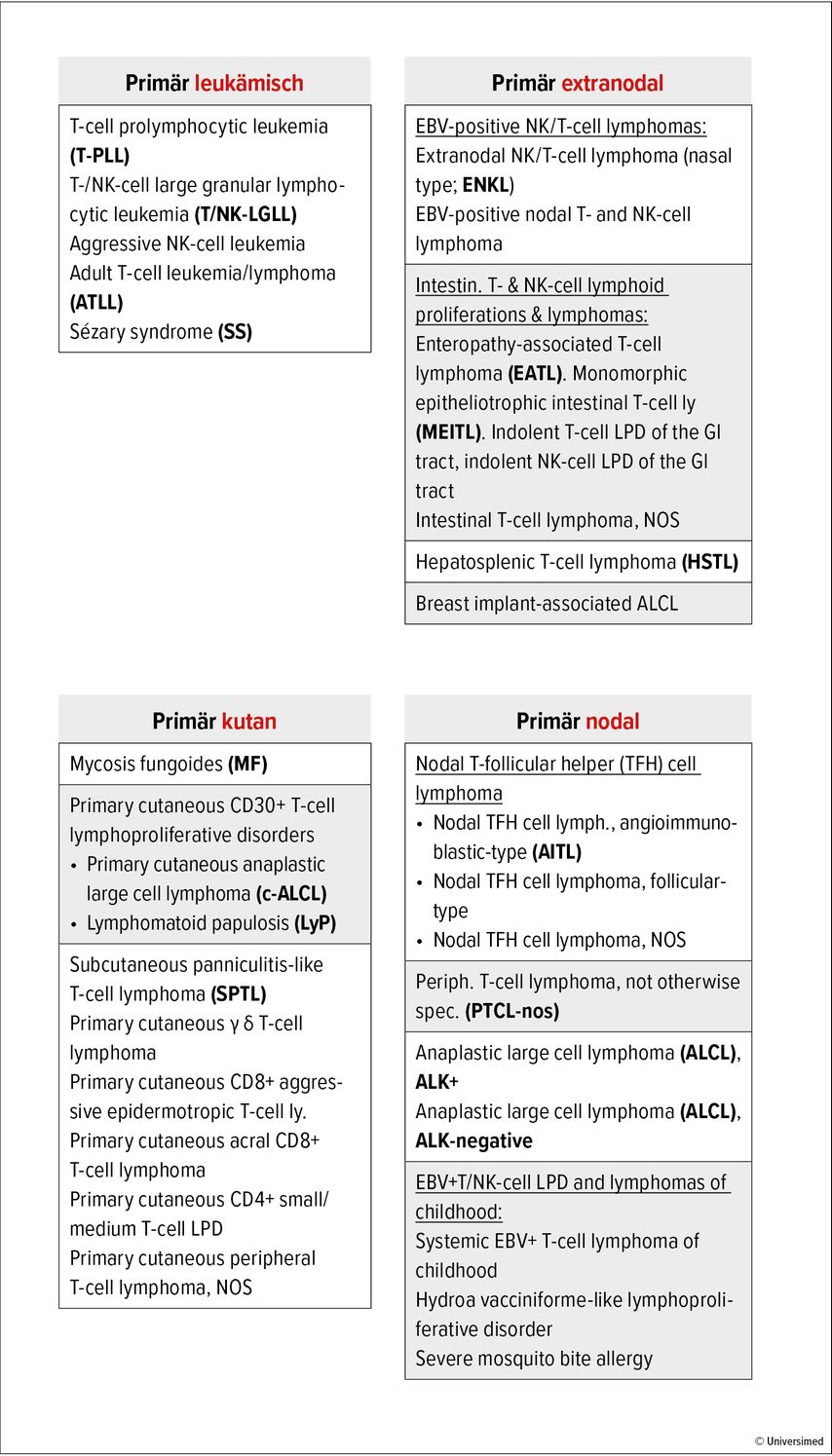
Abb. 1: WHO-Klassifikation der PTZL, 2022. Über 25 PTZL-Entitäten lassen sich voneinander abgrenzen, von denen die Mehrheit jedoch auf die primär nodalen Formen entfällt: Etwa 30% aller PTZL sind nodale T-follikuläre Helferzellen-Lymphome (u.a. auch das AITL), weitere 25% sind die nicht anders spezifizierbaren PTZL (PTCL-NOS) und weitere 20% die anaplastisch großzelligen Lymphome (ALCL) in ihrer ALK-positiven und -negativen Form. Aufgrund der Heterogenität und Seltenheit der einzelnen Erkrankungen sollte bei Diagnosestellung möglichst immer eine referenzpathologische Begutachtung erfolgen und die Patient:innen sollten in ein Register eingeschlossen werden (z.B. die T-PLL- und T-LGLL-Register der DCLLSG oder das T-NHL-Register der GLA und OSHO)
Immuntherapien, Zelltherapien undImmunzelltherapien
Der Siegeszug von Antikörpertherapien wie Rituximab bei B-Zell-Lymphomen ließ sich für die PTZL nicht replizieren. Das liegt u.a. am Fehlen von breit und stabil exprimierten Zielantigenen im PTZL, dessen oft unbestimmter Immunphänotyp eher Verluste von pan-T-Antigenen auf-weist.
Vereinzelt konnten Immuntherapeutika wie Alemtuzumab (gegen CD52, v.a. in der T-Zell-Prolymphozytenleukämie) oder Mogamulizumab (gegen CCR4, v.a. bei den kutanen T-Zell-Lymphomen Mycosis fungoides und Sézary-Syndrom) Erfolge erzielen, aber eine breite Wirksamkeit über viele PTZL-Entitäten hinweg blieb aus. Auch Immuncheckpoint-Inhibitoren konnten nur in Ausnahmen wie den extranodalen NK/T-Zell-Lymphomen gute Ansprechraten erreichen, während sie bei anderen PTZL gar einen Progress auslösen können.5
Dass immunzelluläre Therapien jedoch hochwirksame Therapien für PTZL sein können, beweist schon seit Jahrzehnten die allogene Stammzelltransplantation: Diese kann – anders als die autologe Stammzelltransplantation – anhaltende Remissionen bei einem großen Teil der Patient:innen auslösen, die sie erhalten.6 Das Gros der therapeutischen Wirkung wird dabei den allogenen Immunzellen zugeschrieben, dem Graft-versus-Lymphoma-Effekt.
Eine Weiterentwicklung antikörper- und zellbasierter Konzepte sind die CAR-T-Zellen: Hier werden isolierte T-Lymphozyten ex vivo gentechnisch verändert, sodass sie fortan einen chimären Antigenrezeptor (CAR) tragen. Dieser besteht aus dem Fragment eines definierten Antikörpers, das nach Bindung seines Antigens eine ähnliche Signalkaskade in der T-Zelle auslöst wie die Antigenbindung des T-Zell-Rezeptors. So werden diese CAR-T-Zellen „umprogrammiert“, um die Zellen anzugreifen, die das Antigen der Wahl exprimieren.
Das Problem der CAR-T-Zellen beiPTZL
CAR-T-Zellen konnten besonders bei B-Zell-Neoplasien erstaunliche Erfolge erzielen. T-Zell-Neoplasien hingegen haben bisher kaum von dieser Neuentwicklung profitiert. Das liegt zum einen erneut an der Wahl der Antigene: PTZL verlieren häufig ihre Pan-T-Antigene und zeigen eine heterogene Mischung aus Immunphänotypen über die verschiedenen Entitäten hinweg. Außerdem wäre eine anti-T-Zell-CAR-induzierte prolongierte Aplasie der gesamten T-Zell-Reihe klinisch deutlich schwieriger zu kompensieren (immens hohes Risiko für opportunistische Infekte) als die mittlerweile häufig beobachtete CAR-T-Zell-vermittelte B-Zell-Aplasie.
Zum anderen lässt sich schon am Namen erkennen, dass CAR-T-Zellen in PTZL deutlich schwieriger zu entwickeln sind. Ein Anti-T-Zell-CAR kann in transduzierten T-Zellen einen Fratrizid auslösen, also ein sich gegenseitiges Abtöten der CAR-tragenden Effektor-T-Zellen. Das kann bereits in vitro passieren, weil der CAR nicht tumorzellspezifisch ist. Somit wären eine Zellprodukt-Herstellung (Expansion) und eine ausreichende Vermehrung und Effizienz in Patient:innen unmöglich gemacht.
Darüber hinaus haben PTZL-Patient:innen nach vorangegangenen Chemotherapien oft stark depletierte T-Zell-Reserven, sodass eine ausreichende Absammlung von autologen T-Zellen häufig aussichtslos ist. Des Weiteren können leukämische T-Zellen diese autologen Apheresate kontaminieren und durch den Prozess der viralen Transduktion mit dem CAR ausgestattet werden und so sogar noch neue Wachstumsstimulationen erhalten.7 Auch vermeintlich gesunde T-Zellen können durch die Transduktion mit dem CAR eine neue T-Zell-Neoplasie provozieren; vermutlich begünstigt durch bereits vorangelegte Mutationen.8
Zur Herstellung der autologen CAR-T-Produkte vergehen oft ca. 4–6 Wochen, während derer sich viele Patient:innen mit refraktären PTZL ohne zusätzliche Brückentherapien kaum stabilisieren lassen. Allogene T-Zellen hingegen tragen das Risiko einer Graft-versus-Host-Disease (GvHD) durch das Erkennen von gesundem Empfängergewebe mit ihrem erhaltenen T-Zell-Rezeptor.
Ist unter all diesen Umständen eine CAR-Therapie gegen PTZL überhaupt möglich?
Aktuelle CAR-T-Zell-Ansätze bei PTZL
Eine weit vorangetriebene Strategie ist die Herstellung von autologen CD5-CAR-T-Zellen, die einige der o.g. Limitationen in Kauf nimmt, aber für eine Untergruppe von Patient:innen mit CD5-positiver T-Zell-Erkrankung und erhaltener gesunder T-Zell-Reserve entwickelt wird. Der Fratri-zid soll durch eine CAR-vermittelte (also iatrogen modulierte) Reduzierung von CD5 auf den transduzierten T-Zellen vermindert werden. Tatsächlich zeigte eine „first-in-human“ Phase-I-Studie (NCT0308190) eine Gesamtansprechrate (ORR) von 44% mit kompletten Remissionen (CR) bei zwei Patient:innen.9 Hauptproblem neben den fast ubiquitären Panzytopenien waren jedoch die meist rasch progredienten Erkrankungen.
Etwas personalisierter ist die Entwicklung von autologen CAR-T-Zellen, die gegen eine der zwei möglichen konstanten Regionen der Beta-Kette im T-Zell-Rezeptor (TRBC1 oder TRBC2) gerichtet sind.10 Während der T-Zell-Reifung wird eine der beiden Regionen nahezu zufällig ausgewählt und ein später entarteter „Gründer-T-Zell-Klon“ des PTZL kann seine konstante Region nicht wechseln. Daher kann ein CAR-T-Zell-Produkt, das nur eine der beiden Regionen bindet, das PTZL gezielt angreifen und etwa die Hälfte des gesunden T-Zell-Pools verschonen. Eine Phase-I-Studie mit entsprechendem CAR-T-Zell-Produkt ist aktiv (NCT03590574).
Ein sehr komplexer Ansatz ist die multiple gentechnische Veränderung von allogenen T-Zellen, um einen CD7-CAR einzubringen und gleichzeitig CD7, den TZR und CD52 auf den CAR-tragenden Zellen auszuschalten.11 Mit diesem Ansatz gelingt es, fast alle der zuvor genannten Hürden zu umgehen und noch dazu eine hohe Verfügbarkeit zu gewährleisten, da nicht jedes Produkt für die individuellen Patient:innen einzeln hergestellt werden muss („off-the-shelf“). Der Knock-out von CD52 erlaubt zusätzlich den Einsatz eines konditionierenden CD52-Antikörpers, wodurch ein temporäres Depletieren Patient:innen-eigener T-Zellen (tragen in der Regel CD52) und dadurch eine Abstoßung der Patient:innen-fremden therapeutischen CAR-T-Zellen erreicht wird, ohne die CAR-T-Zellen dabei zu beeinträchtigen. Die Verläufe bei den ersten Patient:innen mit T-ALL erscheinen vielversprechend mit Zeichen des Ansprechens in allen drei Fällen.
Weitere Zielantigene im Fokus der Forschung sind CD4 und CD8 (stabile T-Zell-Marker mit seltenem Antigenverlust), CD30 (u.a. erprobtes Zielantigen von Brentuximab Vedotin), CD37 (generelles Leukozytenantigen) und SLAMF7 (u.a. erprobtes Zielantigen von Elotuzumab).
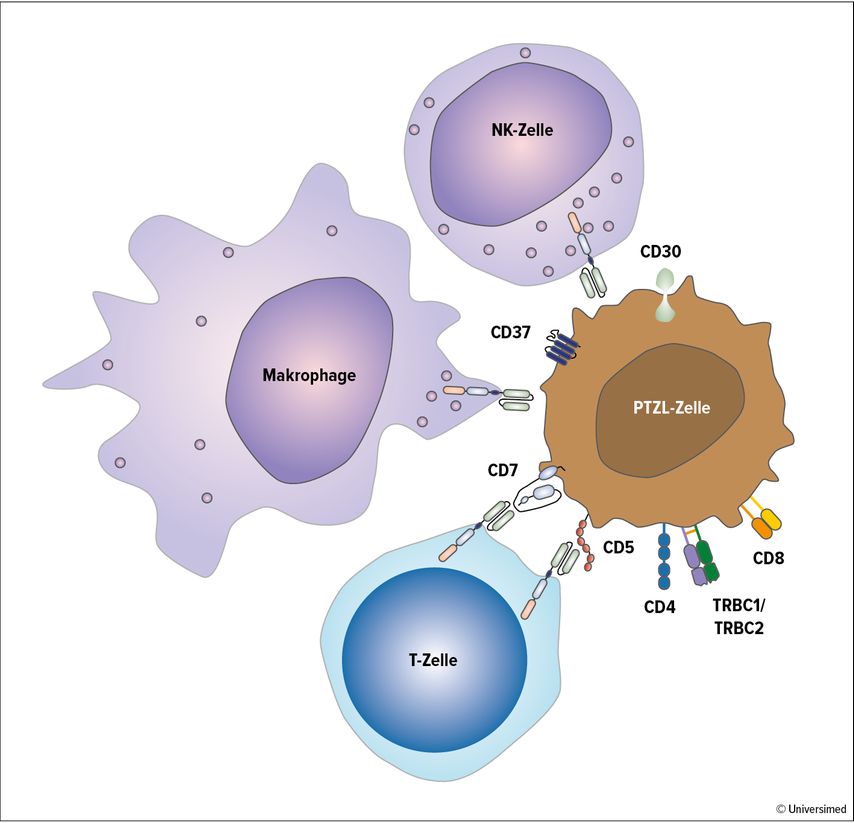
Abb. 2: Neue CAR-Konzepte bei PTZL. Die klinische Entwicklung von CAR im PTZL ist insbesondere für autologe CD5-CAR-T-Zellen, autologe TRBC1-CAR-T-Zellen sowie allogene CD7-CAR-T-Zellen weit vorangeschritten. Weitere Zielantigene mit entsprechenden aktiven klinischen CAR-T-Studien umfassen u.a. CD4, CD30 und CD37. Innovative CAR-Konzepte setzen auch auf weitere Immunzellen wie NK-Zellen und Makrophagen, um insbesondere Probleme der Kontamination durch PTZL-Zellen, verringerten T-Zell-Pool und Fratrizid im autologen Kontext sowie GvHD im allogenen Kontext zu umgehen. Außerdem versprechen einzigartige Eigenschaften wie CAR-unabhängige Tumorerkennung oder Antigen-Präsentation sowie potenziell günstigere Nebenwirkungsprofile eine bessere Effektivität und Sicherheit dieser alternativen CAR-tragenden Anti-T-Effektorzellen gegenüber bisherigen CAR-T-Zell-Strategien bei PTZL
Ausblick auf weitere CAR-Konzepte
Ein Teil der Lösung des CAR-T-Zell-Problems könnte der Wechsel hin zu anderen Immuneffektorzellen sein. NK-Zellen bringen viele der Vorteile von T-Zellen als CAR-Träger mit sich und umgehen viele der o.g. Hürden: Sie haben ein vergleichbares Effektorpotenzial, zusätzliche Eigenschaften der Tumorerkennung, sie exprimieren selbst nur wenige der potenziellen Zielantigene (demnach kein Fratrizid), sie stammen aus allogenen Quellen, sind demnach in der Anwendung umgehend beziehbar und lösen keine GvHD aus. Allogene CAR-NK-Zellen wurden in einigen Studien zu B-Zell-Lymphomen bereits erfolgreich getestet und zeigten sogar ein überlegenes Sicherheitsprofil gegenüber CAR-T-Zellen.12
Auch Makrophagen sind eine attraktive Effektorzell-Alternative. Sie haben vergleichbare Vorteile gegenüber CAR-T-Zellen wie die CAR-NK-Zellen, wenngleich Makrophagen eine geringere direkte Zytotoxizität zugeschrieben wird und sie sich nicht mehr teilen können. Dafür bieten sie allerdings einzigartige Fähigkeiten zur Penetranz von Tumormilieus, Einbindung weiterer Immunzellen, u.a. durch Antigen-Präsentation nach Phagozytose, und zur Freisetzung inflammatorischer Zytokine. Da sie die neueste Entwicklung der CAR-Immunzellen darstellen, gibt es bisher wenig klinische Daten. Die erste Phase-IStudie zu CAR-Makrophagen bei HER2-positiven soliden Tumoren zeigt jedoch schon ein gutes Sicherheitsprofil.13
Der große Vorsprung der T-Zellen als CAR-Effektoren bedeutet einen großen Nachhol- und Forschungsbedarf für diese alternativen CAR-Immunzellen. Sie haben jedoch ein großes Potenzial, speziell im CAR-T-Zell-armen Feld der PTZL, und könnten in Verbindung mit gut gewählten Zielantigenen zu einer deutlichen Verbesserung der bisher immer noch schlechten Prognosen führen.
Literatur:
1 McKelvey EM et al.: Hydroxyldaunomycin (adriamycin) combination chemotherapy in malignant lymphoma. Cancer 1976; 38(4): 1484-93 2 Coiffier B et al.: Peripheral T-cell lymphomas have a worse prognosis than B-cell lymphomas: a prospective study of 361 immunophenotyped pa-tients treated with the LNH-84 regimen. The GELA (Groupe d’Etude des Lymphomes Agressives). Ann Oncol 1990; 1(1): 45-50 3 Gisselbrecht C et al.: Prognostic significance of T-cell phenotype in aggressive non-Hodgkin’s lymphomas. Groupe d’Etudes des Lymphomes de l’Adulte (GELA). Blood 1998; 92(1): 76-82 4 Iqbal J et al.: Gene expression signatures delineate biological and prognostic subgroups in peripheral T-cell lymphoma. Blood 2014; 123(19): 2915-23 5 Wartewig T et al.: PD-1 is a haploinsufficient suppressor of T cell lymphomagenesis. Nature 2017; 552(7683): 121-5 6 Rohlfing S et al.: The impact of stem cell transplantation on the natural course of peripheral T-cell lymphoma: a real-world experience. Ann Hematol 2018; 97(7): 1241-50 7 Ruella M et al.: Induction of resistance to chimeric antigen receptor T cell therapy by transduction of a single leukemic B cell. Nat Med 2018; 24(10): 1499-503 8 Ghilardi G et al.: T cell lymphoma and secondary primary malignancy risk after commercial CAR T cell therapy. Nat Med 2024; 30(4): 984-89 9 Hill LC et al.: Antitumor efficacy and safety of unedited autologous CD5.CAR T cells in relapsed/refractory mature T-cell lymphomas. Blood 2024; 143(13): 1231-41 10 Maciocia PM et al.: Targeting the T cell receptor β-chain con-stant region for immunotherapy of T cell malignancies. Nat Med 2017; 23(12): 1416-23 11 Chiesa R et al.: Base-edited CAR7 T cells for relapsed T-cell acute lymphoblastic leukemia. NEngl J Med 2023; 389(10): 899-910 12 Marin D et al.: Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: aphase 1/2 trial. Nat Med 2024; 30(3): 772-84 13 Reiss KA et al.: A phase 1, first-in-human (FIH) study of the anti-HER2 CAR macrophage CT-0508 in subjects with HER2 overexpressing solid tumors. J Clin Oncol 2022; 40: 2533
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...