«Treat-to-target» in der Asthmatherapie
Bericht: Reno Barth
Medizinjournalist
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Management des schweren Asthma bronchiale stellt nach wie vor eine Herausforderung dar. Ein Konsensusdokument fordert nun die Übernahme des «Treat-to-target»-Konzepts aus der Rheumatologie, um zukünftig besser und früher intervenieren und damit die Entstehung von schwerem Asthma verhindern zu können.
Schweres Asthma bedeute im klinischen Alltag meist eine «End stage»-Situation, von der sich Patienten nur selten vollständig erholen, so Prof. Celeste Porsbjerg vom Bispebjerg Hospital in Kopenhagen. Daher sei es von grosser Bedeutung, eine Progression zum schweren Asthma zu verhindern. Dazu sei ein vertieftes Verständnis jener Mechanismen, die zur Entwicklung eines schweren Asthma führen, entscheidend. Wichtige Informationen, die bei der Beantwortung dieser Frage behilflich sein könnten, liefert die Tasmanian Health Population Study, die anhand einer grossen Kohorte unterschiedliche Asthmaverläufe («trajectories») identifizierte.1 Unter anderem wurde bei Patienten mit frühem Krankheitsbeginn («early onset asthma») ein deutlich erhöhtes COPD-Risiko im späteren Leben gefunden. Bei anderen Asthmaformen bestand zwar ebenfalls ein im Vergleich zur Normalbevölkerung erhöhtes Risiko, eine permanente Atemwegsobstruktion zu entwickeln, doch war dieses bei Weitem nicht im selben Mass erhöht wie bei «early onset asthma». Als Ursache wird eine beeinträchtigte Lungenentwicklung bei Kindern mit Asthma angenommen. Demgegenüber zeigte sich bei «late onset asthma» eine gehäufte Assoziation mit Diabetes, Dyslipidämie und anderen Komorbiditäten.
Chronische Veränderungen der Atemwege
Entscheidend für diese erhöhten Risiken ist die Tatsache, dass Asthma nicht nur durch episodische, sondern auch durch zunehmende kontinuierliche Atemwegsobstruktion gekennzeichnet ist, die zu Exazerbationen prädisponiert.2 Als wichtiger Risikofaktor konnte eine besondere Empfindlichkeit gegenüber viralen Infektionen identifiziert werden, die für die schweren Exazerbationen, die manche Asthmapatienten durchmachen, verantwortlich ist. Ursache ist eine verstärkte Immunoreaktivität der Atemwege, die sich analog zur Hyperreagibilität entwickelt und die für die schweren entzündlichen Schübe im Verlauf von Asthmaexazerbationen verantwortlich zeichnet. Dieser Effekt bleibt, so Porsbjerg, bei Patienten mit stabilem, gut behandeltem Asthma aus. Es sei daher im klinischen Alltag wichtig, Asthmapatienten zu fragen, wie sie mit banalen Infektionen zurechtkommen und ob ihre Therapie Einfluss darauf hat.
Aktuelle Studien liefern auch wertvolle Hinweise auf Veränderungen des Atemwegsepithels, die zu einer Verstärkung der Symptomatik beitragen können. So führt anhaltende T2-Inflammation zu einer Zunahme mukusproduzierender Zellen sowie zu einer Dysfunktion epithelialer Reparaturmechanismen und damit zu einer eingeschränkten Abheilung von Entzündungen. Solche Phänomene wurden bei verschiedenen Asthmaformen nachgewiesen. Das Ergebnis kann ein Teufelskreis mit zunehmender Inflammation, verstärkter Mukusproduktion und letztlich langfristiger Einschränkung der Lungenfunktion sein.3 Damit stelle sich die Frage, wie diese neuen Erkenntnisse den praktischen Umgang mit der Erkrankung beeinflussen können. Porsbjerg betont in diesem Zusammenhang die Bedeutung der neuen Biologika, die einen gezielten Eingriff in ausgewählte inflammatorische Pathways ermöglichen.
Auf der Suche nach einer Definition von Remission
Alles in allem weise die Evidenz in Richtung langfristiger positiver Effekte einer möglichst effektiven Asthmakontrolle. Damit biete sich das aus der Rheumatologie bekannte Prinzip «treat-to-target» auch für die Pneumologie an. «Treat-to-target» bedeutet, dass die Therapie auf das Erreichen definierter Ziele innerhalb eines definierten Zeitrahmens abzielen soll. Werden Ziele – vorzugsweise Remission – nicht erreicht, soll die Therapie eskaliert oder, wenn die Möglichkeiten der Eskalation ausgeschöpft sind, variiert werden. Ziel dieses Vorgehens ist die langfristige Prävention struktureller Schäden. In der Rheumatologie steht zu diesem Zweck mittlerweile eine grosse Zahl sogenannter krankheitsmodifizierender Medikamente (DMARD) zur Verfügung. In der Asthmatherapie ist die Auswahl noch deutlich geringer. Auch ist Remission noch kein etabliertes Therapieziel, so Porsbjerg. Entsprechend fehlen aktuell auch allgemein anerkannte Definitionen von Remission.
Ein kürzlich publiziertes Konsensus-Statement soll Klarheit schaffen. Dazu wurden zunächst Definitionen von Remission bei anderen entzündlichen Erkrankungen ebenso wie Definitionen spontaner Asthmaremission analysiert. Danach wurde versucht, daraus die klinische Asthmaremission unter Therapie zu definieren. Gefordert werden:
-
mindestens 12 Monate ohne signifikante Symptome und Exazerbationen (wobei validierte Instrumente herangezogen werden sollten),
-
Optimierung und Stabilisierung der Lungenfunktion,
-
übereinstimmendes Feststellen von Remission durch Patient und Behandler,
-
keine Anwendung systemischer Kortikosteroide.
Darüber hinaus gibt es auch eine neue Definition der vollständigen Remission, für die zusätzlich eine stabile Kontrolle der Entzündungsmarker und ein negativer Provokationstest gefordert werden. Diese Definitionen sollen künftig auch als Endpunkt für klinische Studien herangezogen werden.4 Die komplette Remission bedeute eine komplette Kontrolle der T2-Inflammation, so Porsbjerg. Die Validierung dieser Kriterien in klinischen Studien stehe allerdings noch aus. Zum gegenwärtigen Zeitpunkt habe man noch mehr Fragen als Antworten. Vor allem sei offen, wie viel Remission benötigt werde, um die langfristige Prognose zu verbessern.
GINA: schrittweise Eskalation und Deeskalation
Ganz im Sinne des «Treat-to-target»-Konzepts unterstreicht Prof. Marco Idzko von der Medizinischen Universität Wien die Bedeutung der Inflammation für die Entstehung und Entwicklung des Asthma bronchiale. Da Inflammation hinter der Hyperreagibilität der Atemwege und hinter den Asthmasymptomen steht, ist es erforderlich, diese Entzündung möglichst früh im Krankheitsverlauf möglichst gut unter Kontrolle zu bekommen. Aus diesem Grund sei die aktuelle Empfehlung der Global Initiative for Asthma (GINA), inhalative Kortikosteroide (ICS) vom Beginn der Erkrankung an einzusetzen, von besonderer Bedeutung. Sehr kritisch sind in diesem Zusammenhang kurz wirksame Bronchodilatatoren (SABA) zu sehen, die das Risiko für asthmatische Spätreaktionen und chronische Inflammation erhöhen. Der Einsatz von ICS zur Symptomkontrolle reduziert hingegen diese langfristigen Effekte und damit auch das Risiko für schwere Exazerbationen. Idzko rät generell und ausnahmslos vom Einsatz von SABA ab.
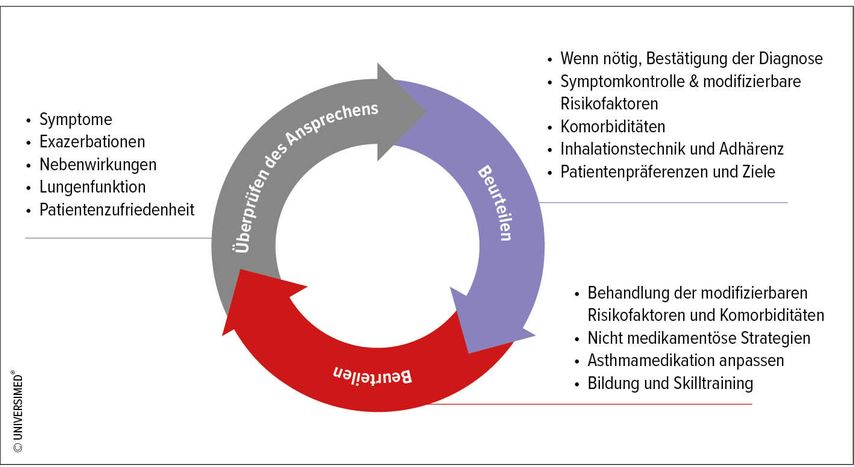
Für die Behandlung von Asthma hat GINA 2020 den «asthma management cycle» definiert,5 der dem «Treat-to-target»-Konzept nicht unähnlich ist und Anpassungen der Therapie in Abhängigkeit von Symptomen, Exazerbationen, Lungenfunktion etc. vorsieht (Abb. 1). Auch die Diagnose muss in diesem Zyklus immer wieder hinterfragt und überprüft werden. Die Anpassungen der Therapie erfolgen nach dem GINA-Stufenschema, wobei auch die nicht medikamentösen Massnahmen mehr und mehr betont werden. GINA empfiehlt dabei nicht nur die Eskalation der Therapie, falls dies erforderlich wird, sondern auch die Deeskalation, sofern dies möglich ist. Verschlechtert sich bei dieser Deeskalation die Asthmakontrolle, so muss die Therapie abermals eskaliert werden. Zudem ist zu hinterfragen, ob nicht neu aufgetretene Faktoren, wie beispielsweise die Exposition gegenüber Allergenen, zur Verschlechterung der Symptomatik beitragen.
Idzko betont dabei die einfache Umsetzung der GINA-Empfehlungen auf den Stufen eins bis vier. Wenn mit einem ICS bzw. ICS plus LABA (lang wirksamer Beta-Agonist) keine ausreichende Kontrolle erreicht wird, soll die Therapie um ein LAMA (lang wirksames Anticholinergikum) erweitert werden. Zusätzlich besteht die Empfehlung für Leukotrien-Rezeptor-Antagonisten, wobei Idzko auf die geringe Evidenz für diese Substanzen in Kombination mit LAMA/LABA hinweist und betont, dass er sie in dieser Indikation nicht einsetzt.
Schweres Asthma vs. schwer zu behandelndes Asthma
Wird mit ICS/LABA/LAMA keine Asthmakontrolle erreicht bzw. müssen orale Kortikosteroide eingesetzt werden, so spricht man von schwerem Asthma (GINA-Stufe 5). Auf dieser Stufe empfiehlt GINA allerdings zunächst eine Differenzierung zwischen schwerem Asthma und schwer zu behandelndem Asthma. Letzteres liegt vor, wenn hinter der mangelnden Kontrolle beispielsweise mangelnde Adhärenz oder Fehler bei der Inhalationstechnik stehen. Können derartige Limitationen ausgeschlossen werden und handelt es sich tatsächlich um schweres Asthma, so besteht der nächste Schritt in einer Phänotypisierung anhand von Biomarkern, die die Voraussetzung für den Einsatz gezielter Therapien darstellt. Unterschieden wird zwischen schwerem allergischem – «high T(h)2» – Asthma und nicht allergischem eosinophilem T2-Asthma, wobei Ersteres unter anderem durch hohe IgE-Spiegel auffällt und bei Zweiterem die Eosinophilenzahl permanent und saisonunabhängig erhöht ist. Darüber hinaus wird noch ein «Low T2»-Asthma angenommen, dessen Existenz als eigenständige Entität jedoch in letzter Zeit in Diskussion geraten ist. Schweres allergisches Asthma wird mit dem IgE-Antikörper Omalizumab behandelt. Beim eosinophilen Asthma kommen der IL-5-Rezeptor-Antikörper Benralizumab oder die IL-5-Antikörper Mepolizumab und Reslizumab infrage. Eine relativ neue Option sowohl beim allergischen als auch beim nicht allergischen eosinophilen Asthma stellt der gegen die Alpha-Kette des IL-4-Rezeptors (IL-4Ra) gerichtete Antikörper Dupilumab dar. Die Behandlung des «Low T2»-Asthmas ist schwierig. Mögliche Optionen sind Immunmodulatoren wie Acithromycin oder die aus der Behandlung der COPD bekannten PDE-4-Inhibitoren.
Quelle:
Virtuelle ERS Satellites, 2. März 2021
Literatur:
1 Bui DS et al.: Lancet Respir Med 2021; 9: 387-96 2 Gauvreau GM et al.: Eur Respir J 2015; 46: 819-31 3 Vieira Braga FA et al.: Nat Med 2019; 25: 1153-63 4 Menzies-Gow A et al.: J Allergy Clin Immunol 2020; 145: 757-65 5 https://ginasthma.org/ ; letzter Aufruf 30.3.2021
Das könnte Sie auch interessieren:
Therapieansprechen beurteilen, aber wie?
Wie werden Asthmasymptome beurteilt? Welcher Fragebogen ist dazu geeignet und spielt es eine Rolle, ob er von den Behandelnden oder den Betroffenen ausgefüllt wird? Wie wird das ...
Lungenembolie: Engramme für den Behandlungspfad
Die Lungenembolie ist ein häufiges und potenziell lebensbedrohliches Krankheitsbild. Die Diagnose bleibt herausfordernd – immer noch zählt die Lungenembolie zu den Diagnosen, die am ...