Zelltherapie aus Fettgewebe in der Arthrosebehandlung
Autoren:
Dr. Markus Neubauer, PhD
Prof. Dr. Stefan Nehrer
Zentrum für Regenerative Medizin, Donau-Universität Krems Universitätsklinik für Orthopädie, Universitätsklinikum Krems, Karl Landsteiner Privatuniversität für Gesundheitswissenschaften
Korrespondierender Autor:
Prof. Dr. Stefan Nehrer
E-Mail: Stefan.nehrer@donau-uni.ac.at
„All the success of orthopedic surgeons are little more than a reflection of the body’s amazing ability to heal itself.“ (Dr. Henry Mankin)
Arthrose – Gelenksdegeneration – ist eine in der Gesamtbevölkerung weitverbreitete, belastende Erkrankung. Die Inzidenz steigt mit dem Alter, 70–80% aller Menschen über 70 weisen Zeichen von Arthrose auf, 10–30% davon haben zudem auch Symptome.
Das Hauptziel der Orthopädie ist es, Mobilität zu erhalten. Arthrose ist eine Hauptursache für die graduelle Abnahme von Mobilität. Daher liegt Arthrose im Fokus der orthopädischen Versorgung.
Das momentane Verständnis der Ätiologie der Erkrankung umfasst ein komplexes Zusammenspiel von intrinsischen und extrinsischen Faktoren, die alle zum Beginn und Fortschreiten von Arthrose beitragen. Das „Dreieck“ Alter – Degeneration – Inflammation liegt im Zentrum dieses Prozesses.1 Alter ist in diesem Fall mit erhöhter Knorpeldichte, verringerter Anzahl an Proteoglykanen, verringerter Kollagendichte und der Dedifferenzierung von Zellen assoziiert.2
Ein durch die gesamte orthopädisch-wissenschaftliche Gemeinschaft gehender Konsens besteht darüber, dass osteochondrale Läsionen (OCL) zum Auftreten von Arthrose führen.3
Der Begriff „regenerative“ Therapien ist in diesem Zusammenhang nicht ganz zutreffend. Therapien wie Blutprodukte und Zelltherapien sollen die Erkrankung vorrangig durch eine Verbesserung der Gelenkshomöostase beeinflussen und nicht tatsächlich hyalinen Knorpel regenerieren. Tatsächliche Regeneration wird vor allem bei OCL, die von gesundem Knorpel umgeben sind, angestrebt. Besonders die klinische Anwendung von Transplantationen körpereigener Chondrozyten – zum ersten Mal im Jahr 1994 publiziert4 – hat sich zu einer etablierten chirurgischen Methode entwickelt, auch weil es für die Wirksamkeit dieser Technik die meisten wissenschaftlichen Daten gibt. Schuette et al. konnten in einem systematischen Review eine signifikante Überlegenheit dieser Technik im Bereich der klinischen Resultate nach 5 Jahren zeigen.5 Zudem gibt es Belege dafür, dass Gelenksdegeneration verzögert bzw. sogar gestoppt werden konnte.6 Ein unabhängiges Health Technology Assessment stufte die Transplantation von körpereigenen Chondrozyten als kostengünstige Behandlung ein.7
Diese Erfolge machen die Orthopädie zu einem Bereich, der in der klinischen Anwendung regenerativer Medizin führend ist. Allerdings sind diese Techniken vor allem dafür geeignet, umschriebene OCL in Gelenken zu behandeln, die noch keine Arthrose entwickelt haben.8
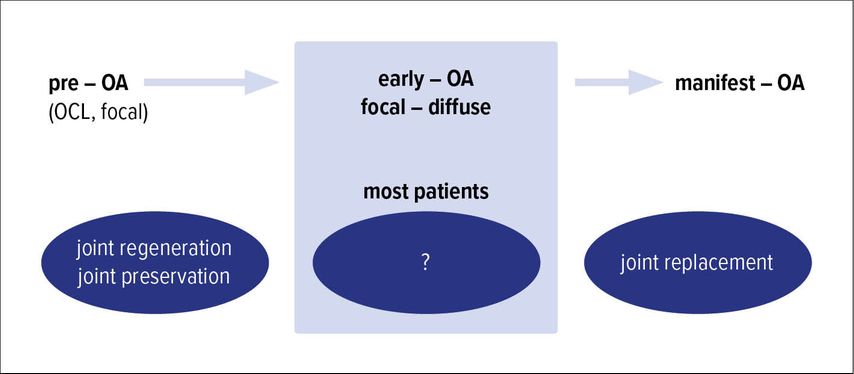
Während bereits manifeste Arthrosen eine eindeutige Kontraindikation darstellen, sind Fälle von Früharthrose („Early onset“-Arthrose) ein noch weitgehend unklarer Bereich. Es konnte gezeigt werden, dass – sogar wenn eine erfolgreiche Behandlung stattfand – die Fehlerrate bei früh einsetzenden degenerativen Läsionen, die mit regenerativen Ansätzen behandelt wurden, doppelt so hoch war wie bei traumatischen OCLs.9,10 Die demografische Belastung zeigt sich auch deutlich in den Daten des deutschen Knorpelregisters der DGOU. 80% der dort erfassten Defekte weisen eine degenerative Ätiologie auf.11
Um ein Versagen der Behandlung mit regenerativen chirurgischen Methoden zu vermeiden, ist eine korrekte Diagnose notwendig. Eine deutsche Arbeitsgruppe hat sich kürzlich dieser Tatsache angenommen und die radiologischen Anzeichen von Früharthrose zusammengefasst.12 Ein weiterer Meilenstein für die exakte und frühe Arthroserkennung wird zudem der Einsatz von künstlicher Intelligenz in der Radiologie werden.13
Wenn somit klassisch regenerative Methoden bei Früharthrose ungeeignet scheinen, bleibt zu fragen, wie Patienten in diesem Arthrosestadium zu behandeln sind (Abb. 1).
Das Wundermittel? Stammzellen in der Orthopädie und ihre möglichen Wirkungsmechanismen
Früharthrosen könnte einer der Bereiche sein, in dem der Einsatz von sogenannten mesenchymalen Stammzellen (MSC) sinnvoll ist. In der Vergangenheit gab es immer wieder viele Missverständnisse rund um „Stammzellentherapie“. Bedauerlicherweise hat der weitverbreitete Fehlgebrauch dieses Begriffs zu einer negativen Konnotation geführt.14 Ein wichtiges Ziel dieses Artikels ist es, diese Missverständnisse durch datenbasierte Information aufzuklären und somit auch den sinnvollen Einsatz von MSC in der orthopädischen Behandlung zu fördern.
Caplan et al. kreierten den Begriff in den frühen 1990er-Jahren.15 Allerdings forderte Caplan im Jahr 2017 die Änderung des Namens.16 Der Grund für die Debatte um die Terminologie des Begriffs liegt einerseits in den Wirkungsmechanismen, andererseits an der Herkunft der MSC. Das damals vielsprechende Verständnis therapeutischer Anwendungen von MSC basierte darauf, dass sie potenziell in viele unterschiedliche Zellarten differenziert werden können. Dieses vielseitige Differenzierungspotenzial in Adipozyten, Chondrozyten, Osteozyten und viele andere ist ein eindeutiges Charakteristikum von MSC.17 Daher wurden die therapeutischen Einsatzmöglichkeiten von MSC in diesem Potenzial verortet. Sie sollten als Zellmasse zur Regeneration von neuem Gewebe bei spezifischen Anwendungen, wie etwa Knorpelläsionen, dienen. Allerdings wurde im Laufe von Jahrzehnten andauender Forschung die Rolle der „parakrinen“ Eigenschaften von MSC, die das Zielgewebe durch Immunmodulation, Apoptoseveränderung und viele andere Effekte beeinflussen, immer offensichtlicher.18 Diese Effekte scheinen die postulierten therapeutischen Eigenschaften prominenter zu vermitteln als die Rolle von MSC als Zellmasse, die in verletztes Gewebe integriert werden kann. MSC scheinen den regenerativen Prozess zu „orchestrieren“, indem sie die Gelenkshomöostase auf eine positive Art und Weise beeinflussen und verändern.
MSC können aus vielen unterschiedlichen Geweben gewonnen werden, wie beispielsweise aus Nabelschnur, Fruchtwasser, Knochenmark, Fettgewebe oder Synovialflüssigkeit.17,19
MSC sind einfach verfügbar – warum nutzen wir Fettgewebe?
Die traditionell am häufigsten verwendete Gewebsquelle in der orthopädischen Verwendung ist das Knochenmark.17 Dieses Gewebe eignet sich vor allen wegen der minimal notwendigen Zellmanipulation und der Möglichkeit der Point-of-Care-Anwendung.20 Allerdings besitzen aus Fettgewebe gewonnene MSC, sogenannte „adipose tissue-derived MSC“ (ASC), dieselben Vorteile, ohne die Komorbidität von Knochenmarksentnahmen – besonders aus dem Beckenkamm. Aus diesem Grund gewinnen ASC als Quelle für MSC in der klinischen Anwendung immer mehr an Bedeutung.
Fettgewebezellen (ASC): immer dasselbe und dennoch anders?
Einige Faktoren beeinflussen die biologischen Eigenschaften der verwendeten ASC. Eine Strategie, um potenziell negative Einflüsse zu umgehen und die therapeutischen Eigenschaften von ASC zu unterstützen, war, sie mit Blutprodukten zu kombinieren. Diese Vorgehensweise wurde seit Beginn der ersten klinischen Studien mit ASC vor etwa einem Jahrzehnt im Jahr 2011 verfolgt.21,22 Grund dafür war, das Wachstum der ACS zu unterstützen und deren Lebensfähigkeit zu fördern.23–25
Allerdings beeinflusst auch die Wahl des Ursprungsgewebes mit seinem speziellen Platz im Organismus das Differenzierungspotenzial. Ein Beispiel dafür sind die Hinweise darauf, dass ASC, die aus Fettgewebe des Hoffa-Fettkörpers stammen, ein deutlich höheres chondrogenes Differenzierungspotenzial aufweisen als jene aus subkutanem Fettgewebe.26–28
In den meisten Fällen ist die sogenannte „stromal vascular fraction“ (SVF) gemeint, sobald der Begriff ASC genutzt wird. Hierbei wird meistens Kollagenase für die enzymatische Verdauung dem entnommenen Gewebe hinzugefügt.29–31 Danach wird das Enyzm entfernt. Das entstandene Endprodukt wird als SVF bezeichnet. Diese enthält neben ASC auch eine große Anzahl an Zelltypen, wie unter anderem Fibroblasten oder weiße Blutkörperchen.29–31
Man kann also daraus schließen, dass ASC nicht gleich ASC sind. Wünschenswert ist ein einfach anwendbarer Ansatz bei möglichst wenig Zellmanipulation. Um dies erreichen zu können, müssen biologische Eigenschaften, Wirtschaftlichkeit, klinische Untermauerung und die Komplexität der klinischen Anwendung ausbalanciert werden, um die Umsetzung innovativer effektiver Therapien zu beschleunigen.
Kommt es auf die Größe an? Die MSC-Zellzahl aus Fettgewebe
Die Zellzahl – pro Gramm von entnommenem Gewebe – wird intuitiv mit dem im vorigen Teil vorgestellten Wirkungsmechanismen in Verbindung gebracht: Mehr Zellen führen zu größeren Effekten – oder doch nicht?
Die Ergebnisse einer Proof-of-Concept-Studie von Jo et al. unterstützen diesen intuitiven Schluss. Die Forschergruppe injizierte drei unterschiedliche Zelldosen in Knie mit Arthrose, beginnend bei 10×106 über 50×106 bis zu 100×106 Zellen. Höhere Zelldosen brachten signifikant bessere klinische Ergebnisse.32 Eine Nachfolgeuntersuchung zwei Jahre später zeigte ebenfalls, dass die positiven klinischen Effekte in der Gruppe mit der höchsten Dosis signifikant stärker waren. Allerdings wurden seither auch exakt gegenteilige Resultate in der Literatur berichtet. Pers et al. zeigten im Jahr 2016, dass autologe ASC mit der geringsten Dosis, nämlich einer Zellausbeute von 2×106 als einzige Gruppe zu signifikanten Verbesserungen der klinischen Ergebnisse führte, im Gegensatz zu den beiden Gruppen mit größeren Zellzahlen mit jeweils 10×106 und 50×106 Zellen.33
Wir dürfen daraus schließen, dass es tatsächlich auf die Größe ankommt – wir können allerdings noch nicht sicher sein in welche Richtung: Vielleicht ist weniger mehr.
Behandle deine Zellen gut oder sie werden dich nicht gut behandeln (oder gar nicht behandeln?)
Die Viabilität von Zellen ist entscheidend. Zellen, die ihre inerten Kapazitäten verlieren, verlieren ihr regeneratives Potenzial. Es wurden bereits viele Faktoren ermittelt, welche dieses Potenzial beeinflussen. Besonders relevant dürfte im Kontext von Arthrose die Zellexposition mit Kortikosteroiden sein. Diese reduzieren nachweislich die Überlebensfähigkeit von MSC-Zellen im Gegensatz zu Hyaluron, das den gegenteiligen Effekt zu haben scheint.34,35
Unsere Forschungsgruppe am Zentrum für regenerative Medizin in Krems konnte kürzlich zeigen, dass eine Kombination mit Blutprodukten vorteilhafte Effekte auf die Überlebensfähigkeit von MSC hat. Diese Ergebnisse untermauern das Prinzip der Kombination von MSC mit Blutprodukten.25
Interessanterweise scheint das Alter an sich nicht so hinderlich für das regenerative Potenzial von ASC zu sein, wie man das intuitiv annehmen würde. Allerdings verlieren aus Knochenmark gewonnene MSC nachweislich mit größerer Wahrscheinlichkeit ihre Kapazitäten abhängig vom Alter.36
Außerdem soll erwähnt werden, dass die Art und Weise, wie die Zellen verwendet werden, eine wichtige Rolle spielt. Eine Point-of-Care-Verwendung mit möglichst wenig Kontakt zu einer fremden Umgebung ist empfehlenswert. Werden Zellen aus dem Körper und damit auch aus ihrer ursprünglichen Umgebung extrahiert, sind sie – auch wenn sie danach nicht einem weiteren Medium ausgesetzt sind – per definitionem einer fremden Mikroumgebung ausgesetzt, in der die Zellen ihre Biologie ändern.
Die Verwendung von Zellen oder Produkten aus Zellen – wie Sekretome oder Exosomen in einer „zellfreien“ regenerativen Medizin – erfordert eine Neugestaltung der Bedingungen, unter denen die Gewebeentnahme, -speicherung, -vermehrung und -reapplikation dieser medizinischen Stoffe stattfinden können. Dieses Umdenken kann zur Herausforderung werden, da diese speziellen Anforderungen grundlegend von jenen für traditionelle medizinische Substanzen abweichen, deren Handhabung grundsätzlich anders, meist einfacher, ist.
Klinische Anwendungen von ASC bei (Knie-)Arthrosen
Koh et al. veröffentlichten zwei Artikel, in denen ASC im klinischen Setting untersucht wurden. In beiden Studien wurden unkultivierte ASC in Kombination mit plättchenreichem Plasma („platelet-rich plasma“, PRP) verwendet.37,38 Im Jahr 2012 verwendete die Forschergruppe ASC aus Fettgewebe aus dem Hoffa-Fettkörper. 2014 wurden die Patienten nach einem durchschnittlichen Follow-up von 24,4 Monaten abermals untersucht. Die Hauptintervention dieser Studie war eine Umstellungsosteotomie. Die Patienten in der Verumgruppe erhielten zusätzlich ASC in Kombination mit PRP, die Kontrollgruppe erhielt die gleiche Behandlung ohne PRP oder ASC. Die Resultate von VAS und KOOS mit den Subskalen Schmerz und klinische Symptome waren signifikant besser für die Gruppe, die MSC erhalten hatte.38 Eine „Second-look“-Arthroskopie zeigte auch homogene(re) Knorpeloberflächen. Allerdings war dieser Befund nicht signifikant.38
Die praktische Seite: Entnahme, Verarbeitung und (Re)applikation von Fettgewebe
Es gibt eine unterschiedliche Auswahl an kommerziell erhältlichen Kits und Prozeduren. Zumeist besteht der Prozess jedoch aus drei Schritten: Entnahme – Verarbeitung – Applikation.
Während der Entnahme erhalten die Patienten eine Lokalanästhesie. Häufig wird hier eine Mischung aus Kochsalzlösung, Lidocain und Adrenalin verabreicht. Die Entnahmenadeln unterscheiden sich typischerweise stark, je nach Hersteller. Gleiches gilt für die beigefügten Spritzen, die im Idealfall für jeden weiteren Verarbeitungsschritt verwendbar sein sollten. Der nächste Schritt der weiteren Verarbeitung ist die Reinigung des entnommenen Gewebes von Zellrückständen, Blut und anderen unerwünschten Komponenten. Üblicherweise wird hierfür das Gewebe mit Kochsalzlösung gewaschen. Danach muss das Fettgewebe zerstückelt werden. Das kommerziell erhältliche Set Lipogems® beispielsweise verwendet dazu Metallkügelchen und keine enzymatischen Verdauungsprozesse, was in einer überlegenen Zelllebensdauer zu resultieren scheint und die regenerative Kapazität der Zellen erhält.39 Ein weiteres Argument, das gegen die Verwendung von enzymatischer Verdauung spricht, ist der Erhalt der normalen Fettgewebsstruktur, die als Gitter für die späteren ACS dient, damit diese ihre Effekte besser entfalten können. Diese Art der Applikation steht im Kontrast zu den weiter oben erwähnten und häufig genutzten SVF.
Zuletzt wird das verarbeitete Gewebe wieder dem Patienten an der notwendigen Stelle per Injektion verabreicht. Da Besondere dabei ist, dass der oben beschriebene Prozess leicht in Point-of-Care-Verwendung, d.h. entweder in einer chirurgischen Umgebung oder in einer Praxis unter sterilen Bedingungen, durchgeführt werden kann.
Aussichten und Herausforderungen in der Anwendung von ASC bei der Versorgung von Arthrose
Damit sich regenerative Therapien etablieren können, sind neben den oben diskutierten Themen, wie etwa biologische Eigenschaften und klinische Anwendbarkeit, auch ethische Fragen und gesetzliche Vorschriften auf dem Weg zur klinischen Anwendung von zentraler Bedeutung.
Ein breiter Konsens in der wissenschaftlichen orthopädischen Gemeinschaft besteht – unter Berücksichtigung der Sicherheit der Patienten – darüber, dass MSC- Applikationen sicher sind und Teratome oder Neoplasien keine Rolle spielen, was ein Hauptunterscheidungsmerkmal zu embryonalen Stammzellen darstellt.40
In Hinblick auf legistische Regulierungen ist beispielsweise das Quellgewebe der Zellen entscheidend. Die legalen Rahmenbedingungen betonen die Unterscheidung zwischen gleichartiger und nicht gleichartiger Zellverwendung. Damit wäre etwa eine Transplantation von Zellen von gelenkfernen Geweben in Gelenke nicht erlaubt – was jedoch bei der Transplantation von ASC aus subkutanem Fettgewebe in Gelenke passiert.41
Diese Beispiele sollen die Komplexität der klinischen Translation aufzeigen, die über die Biologie und die klinische Medizin an sich hinausgeht.
Ausblick und Fazit
ASC-Therapien sind eine vielversprechende Strategie in der Behandlung von Arthrose. Die Notwendigkeit solider Daten für evidenzbasierte Empfehlungen ist Voraussetzung für die seriöse Anwendung. Allerdings sollte dieses Bekenntnis nicht Bremse für Innovationen sein.
Eine elegante Lösung für die oben in Kürze dargestellten Herausforderungen – wie Point-of-Care-Verwendung, einfache klinische Anwendung, Wirtschaftlichkeit, ethische und gesetzliche Voraussetzungen etc. – könnten ASC sein, die aus dem Fettgewebe des Hoffa-Körpers gewonnen wurden. Diese Idee könnte in Standardbehandlungsalgorithmen integriert werden. Vor dem Hintergrund, dass 40% aller arthroskopischen Knieoperationen von einfachen Meniskusrissen Zeichen von Arthrose oder Früharthrose zeigen, kann argumentiert werden, regenerative Therapien wie die Applikation von ASC aus dem Hoffa-Körper als Standard in die Routinebehandlung zu integrieren.42
Diese und ähnliche Perspektiven sind vielversprechend und spannend. Innovation ist notwendig, um das Potenzial von MSC zu erschließen und kreativ die aufgezeigten Herausforderungen zu meistern. Die Aufgabe, dieses komplexe Puzzle zu lösen, sollte nicht entmutigen, sondern anspornen. Die Wahrscheinlichkeit klinischer Translation korreliert mit der Menge an Innovation, die auf soliden Daten basiert.
Literatur:
1 Sacitharan PK, Vincent TL: Cellular ageing mechanisms in osteoarthritis. Mammalian Genome 2016; 27: 421-9 2 Lotz M, Loeser RF: Effects of aging on articular cartilage homeostasis. Bone 2012; 51(2): 241-8 3 Gaissmaier C et al.: Cartilage defects: epidemiology and natural history. Osteosynthesis Trauma Care 2006; 14(3): 188-94 4 Brittberg M et al.: Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med 1994; 331(14): 889-95 5 Schuette HB et al.: Matrix-assisted autologous chondrocyte transplantation in the knee: a systematic review of mid- to long-term clinical outcomes. Orthop J Sports Med 2017; 5(6): 2325967117709250 6 Jungmann PM et al.: Magnetic resonance imaging score and classification system (AMADEUS) for assessment of preoperative cartilage defect severity. Cartilage 2017; 8(3): 272-82 7 Mistry H et al.: Autologous chondrocyte implantation in the knee: systematic review and economic evaluation. Health Technology Assess 2017; 21(6): 1-294 8 Niemeyer P et al.: Stellenwert der autologen Chondrozytentransplantation (ACT) in der Behandlung von Knorpelschäden des Kniegelenks – Empfehlungen der AG Klinische Geweberegeneration der DGOU. Z Orthop Unfall 2013; 151(1): 38-47 9 Angele P et al.: Defect type, localization and marker gene expression determines early adverse events of matrix-associated autologous chondrocyte implantation. Injury 2015; 46(Suppl 4): S2-9 10 Angele P et al.: Chondral and osteochondral operative treatment in early osteoarthritis. Knee Surg Sports Traumatol Arthrosc 2016; 24(6): 1743-52 11 Niemeyer P et al.: Cartilage repair surgery for full-thickness defects of the knee in Germany: indications and epidemiological data from the German Cartilage Registry (KnorpelRegister DGOU). Arch Orthop Trauma Surg 2016; 136(7): 891-7 12 Madry H et al.: Early osteoarthritis of the knee. Knee Surg Sports Traumatol Arthrosc 2016; 24(6): 1753-6 13 Nehrer S et al.: Automated knee osteoarthritis assessment increases physicians’ agreement rate and accuracy: data from the osteoarthritis initiative. Cartilage 2019; doi: 10.1177/1947603519888793. Online ahead of print 14 Kuhn G: Warnung vor dubiosen Stammzell-Therapien. Kurier 2017; https://kurier.at/wissen/wie-die-notlage-von-schwerkranken-ausgenuetzt-wird-warnung-vor-stammzell-therapien/283.878.668 15 Caplan AI: Mesenchymal stem cells. J Orthop Res 1991; 9(5): 641-50 16 Caplan AI: Mesenchymal stem cells: time to change the name! Stem Cells Transl Med 2017; 6(6): 1445-51 17 Stoltz JF et al.: Stem cells and regenerative medicine: myth or reality of the 21th century. Stem Cells Int 2015; 2015: 734731 18 Barry F, Murphy M: Mesenchymal stem cells in joint disease and repair. Nat Rev Rheumatol 2013; 9(10): 584-94 19 Lee EH, Hui JHP: The potential of stem cells in orthopaedic surgery. J Bone Joint Surg Br 2006; 88(7): 841-51 20 Neubauer M et al.: Bone-marrow-aspirate-concentrate for chondral defects: surgical techniques, clinical applications and basic science. Ann Jt 2018; 3: 107 21 Pak J: Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. J Med Case Rep 2011; 5(1): 296 22 Pak J et al.: Cartilage regeneration in humans with adipose tissue-derived stem cells and adipose stromal vascular fraction cells: updated status. Int J Mol Sci 2018; 19(7): 2146 23 Pak J et al.: Cartilage regeneration in human with adipose tissue-derived stem cells: current status in clinical implications. Biomed Res Int 2016; 2016: 1-12 24 Hart PH et al.: Comparison of the suppressive effects of interleukin-10 and interleukin-4 on synovial fluid macrophages and blood monocytes from patients with inflammatory arthritis. Immunology 1995; 84(4): 536-52 25 Neubauer M et al.: The effect of blood-derived products on the chondrogenic and osteogenic differentiation potential of adipose-derived mesenchymal stem cells originated from three different locations. Stem Cells Int 2019; 2019: 1-20 26 Park JS et al.: The promotion of chondrogenesis, osteogenesis, and adipogenesis of human mesenchymal stem cells by multiple growth factors incorporated into nanosphere-coated microspheres. Biomaterials 2011; 32(1): 28-38 27 Mochizuki T et al.: Higher chondrogenic potential of fibrous synovium- and adipose synovium-derived cells compared with subcutaneous fat-derived cells: distinguishing properties of mesenchymal stem cells in humans. Arthritis Rheum 2006; 54(3): 843-53 28 Wickham MQ et al.: Multipotent stromal cells derived from the infrapatellar fat pad of the knee. Clin Orthop Relat Res 2003; 412(412): 196-212 29 Zuk PA et al.: Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell 2002; 13(12): 4279-95 30 Zuk PA et al.: Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng 2001; 7(2): 211-28 31 Pak J et al.: Regeneration of cartilage in human knee osteoarthritis with autologous adipose tissue-derived stem cells and autologous extracellular matrix. Biores Open Access 2016; 5(1): 192-200 32 Jo CH et al.: Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: A proof-of-concept clinical trial. Stem Cells 2014; 32(5): 1254-66 33 Pers YM et al.: Adipose mesenchymal stromal cell-based therapy for severe oosteoarthritis of the knee: a phase I dose-escalation trial. Stem Cells Transl Med 2016; 5(7): 847-56 34 Wyles CC et al.: Differential cytotoxicity of corticosteroids on human mesenchymal stem cells. Clin Orthop Relat Res 2015; 473(3): 1155-64 35 Wong TY et al.: Hyaluronan keeps mesenchymal stem cells quiescent and maintains the differentiation potential over time. Aging Cell 2017; 16(3): 451-60 36 Beane OS et al.: Impact of aging on the regenerative properties of bone marrow-, muscle-, and adipose-derived mesenchymal stem/stromal cells. PLoS One 2014; 9(12): e115963 37 Koh YG, Choi YJ: Infrapatellar fat pad-derived mesenchymal stem cell therapy for knee osteoarthritis. Knee 2012; 19(6): 902-7 38 Koh YG et al.: Comparative outcomes of open-wedge high tibial osteotomy with platelet-rich plasma alone or in combination with mesenchymal stem cell treatment: A prospective study. Arthroscopy 2014; 30(11): 1453-60 39 De Francesco F et al.: A non-enzymatic method to obtain a fat tissue derivative highly enriched in adipose stem cells (ASCs) from human lipoaspirates: preliminary results. Int J Mol Sci 2018; 19(7): 2061 40 Hernigou P et al.: Cancer risk is not increased in patients treated for orthopaedic diseases with autologous bone marrow cell concentrate. J Bone Joint Surg Am 2013; 95(24): 2215-21 41 Raposio E, Ciliberti R: Clinical use of adipose-derived stem cells: European legislative issues. Ann Med Surg 2017; 24: 61-4 42 Pihl K et al.: Signs of knee osteoarthritis common in 620 patients undergoing arthroscopic surgery for meniscal tear. Acta Orthop 2017; 88(1): 90-5
Das könnte Sie auch interessieren:
Periphere Nervenkompressionssyndrome der oberen Extremität
Periphere Nervenkompressionssysteme der oberen Extremitäten sind verhältnismäßig häufig, insbesondere der Nervus medianus und der Nervus ulnaris sind oft im Bereich des Hand- bzw. ...
Konservative Behandlungsmöglichkeiten bei peripheren Nervenläsionen
Eine periphere Nervenläsion erfordert nicht nur eine Dekompression, Naht oder Rekonstruktion. Um Gelenke beweglich zu erhalten, eine Atrophie der Muskulatur zu verhindern und die ...
Bildgebende Diagnostik des peripheren Nervensystems
Die komplexen Nerventopografien machen die Nervenbildgebung zu einer fordernden Aufgabe, die allerdings eine wichtige Rolle dabei spielt, eine funktionelle Wiederherstellung der ...