<p class="article-intro">Weichteilsarkome sind hochaggressive Tumoren, die oftmals nur unspezifische Symptome verursachen. Oft fehlen Schmerzen und die Größe nimmt nur langsam zu. Die Behandlung sollte unbedingt an einem Tumorzentrum erfolgen, wo nach bioptischer Verifizierung eine weite En-bloc-Resektion durchgeführt werden kann. Zusätzlich können abhängig von der Entität eine Radiotherapie und/oder eine Chemotherapie notwendig werden.</p>
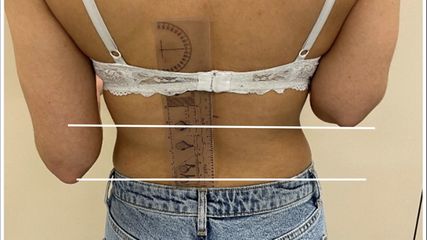
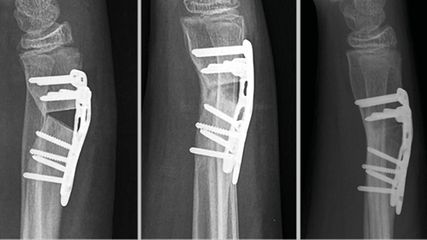
<p class="article-content"><div id="keypoints"> <h2>Keypoints</h2> <ul> <li>Patienten mit Tumoren mit einem Durchmesser größer als 4cm sowie Läsionen, die tief zur Muskelfaszie lokalisiert bzw. schmerzhaft und/oder größenprogredient sind, müssen so schnell wie möglich an das nächste Tumorzentrum zugewiesen werden.</li> <li>Gerade im Hüft- und Gesäßbereich können die Symptome ein primäres Hüftleiden oder Radikulopathien vortäuschen, weshalb im Zweifelsfall eine MRT vor jeglicher weiterer Intervention durchgeführt werden sollte.</li> <li>Im Tumorzentrum werden nach bioptischer Verifizierung des Tumors eine weite Resektion, bei der der Tumor umhüllt von einer Schicht an gesundem Gewebe entnommen wird, sowie optional eine Radiotherapie des Operationsgebietes bzw. eine adjuvante Chemotherapie bei Hochrisikopatienten durch­geführt.</li> </ul> </div> <p>Weichteilsarkome (WTS) sind eine seltene, aber hochaggressive Tumorentität. Sie sind klinisch oft schwer von benignen Weichteiltumoren, wie Lipomen und Fibromen, zu unterscheiden. Daher sind akzidentelle Resektionen von WTS relativ häufig: Knapp 40 % der WTS-Patienten, die an Tumorzentren zugewiesen werden, sind auswärts – in der Annahme des Vorliegens eines benignen Tumors – bereits inadäquat voroperiert worden.<sup>1</sup> Infolge derartiger onkologisch meist inkorrekter Resektionen ist das multidisziplinäre Team am Tumorzentrum mit mehreren Problemen konfrontiert: Das Fehlen adäquater präoperativer Bildgebung, aber auch Unklarheiten über die Resektionsränder (welche bei WTS unter allen Umständen im Gesunden sein sollten) und unsachgemäße operative Zugänge erschweren die weitere Behandlung (Abb. 1).<sup>2</sup></p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2018_Jatros_Ortho_1801_Weblinks_s20_1.jpg" alt="" width="2149" height="589" /></p> <p>Da Patienten mit Weichteiltumoren nicht grundsätzlich bei einem spezialisierten, tumororthopädischen Zentrum vorstellig werden, wurden folgende Richtlinien für die Abklärung entwickelt:<sup>3</sup> Alle palpatorisch mehr als etwa golfballgroßen, verdächtigen Läsionen sollen primär mittels MRT mit Kontrastmittel untersucht werden, während bei kleineren Tumoren die Sonografie als primäre Bildgebung ausreicht. Alle Tumoren, die in der Bildgebung größer als 4cm im Durchmesser oder tief zur Muskelfaszie lokalisiert sind, müssen in weiterer Folge primär an ein Tumorzentrum zugewiesen werden. Bei kleineren, gutartig imponierenden Tumoren kann eine Inzisions- oder Exzisionsbiopsie durchgeführt werden. Sollte sich histologisch wider Erwarten ein maligner Tumor bestätigen, erfolgt als nächster Schritt die Überweisung an das nächstgelegene Tumorzentrum.<br />Bestehen zusätzlich zu den beschriebenen Kriterien der tiefen Lokalisation und Größe über 4cm im Durchmesser anamnestisch außerdem Größenprogredienz und/oder Schmerzen, sollte sofort eine Überweisung an ein Tumorzentrum erfolgen.<sup>4</sup></p> <h2>WTS der Hüfte und Gesäßregion</h2> <p>WTS kommen zwar am häufigsten im Oberschenkel vor, gelegentlich entstehen sie aber auch in der Inguinalregion, an der lateralen Hüfte und im Bereich des M. gluteus maximus. Gerade dort können WTS durch Schwellung und Schmerzen ein primäres Hüftproblem oder Radikulopathien vortäuschen.<sup>5</sup> Aus diesem Grund kommt es nicht selten zu einer verzögerten Überweisung an ein Tumorzentrum.<sup>6</sup> In unserem Kollektiv von 531 WTS, die zwischen 1998 und 2016 reseziert wurden, fanden sich 49 Fälle (9,2 % ) im Bereich des Beckens und der Hüfte. In einer anderen Studie waren von über 2000 WTS nur 73 Tumoren (3,6 % ) – und damit weniger als in unserem Kollektiv – in der Gesäßregion lokalisiert. Von den über 50 bekannten histologischen Subtypen der WTS fanden sich in unserem Kollektiv bei 17 der Becken- und Hüft-WTS Myxofibrosarkome (34,7 % ) und bei 10 Liposarkome (20,4 % ). Mehr als die Hälfte der WTS in Becken und Hüfte wiesen einen hohen Malignitätsgrad auf (n=28; 57,1 % ), während nur 9 WTS intermediär (18,4 % ) und 12 (24,5 % ) niedrig maligne waren. <br />Der bioptische Zugang bei WTS der Hüft- und Gesäßregion hängt davon ab, ob Gefäße und/oder Nerven kompromittiert sind. Prinzipiell ist die Biopsie möglichst durch das Kompartment mit der kürzestmöglichen Distanz zum Tumor unter Schonung von Nerven und Gefäßen durchzuführen. Die Kontamination des umliegenden Gewebes kann dadurch minimiert werden. Eine assistierende Bildgebung während der Biopsie (Sonografie oder Computertomografie) kann etwa bei Tumoren in der Inguinalregion hilfreich sein, um die nächstgelegenen Strukturen zu schonen. Dasselbe gilt insbesondere für tief lokalisierte Tumoren der Glutealregion, wo auch Probenmaterial bildgebungsgestützt entnommen werden kann.<br />In einer Studie von Behranwala wurde eine im Vergleich zu Sarkomen anderer Regionen erhöhte Lokalrezidivrate beobachtet (35,4 % ).<sup>5</sup> Diese Tatsache lässt sich dadurch erklären, dass weite Resektionsränder in der Gesäßregion aufgrund der engen Beziehung zur Gefäß-Nerven-Straße nur schwer einzuhalten sind.<sup>5</sup> Die gleichen Probleme treten inguinal auf, wo WTS oft knapp an den vaskulären Strukturen (A. iliaca externa, A. femoralis) anliegen oder diese infiltrieren.<sup>7</sup> Brooks et al. berichten etwa über 88 WTS in der Inguinalregion. Bei 17 Patienten (19 % ) lag eine Infiltration großer Gefäße oder Nerven vor, weshalb 5 Patienten aus dieser Subgruppe letztlich amputiert werden mussten.<sup>8</sup></p> <h2>Therapie</h2> <p>Der Goldstandard der Therapie von WTS ist die vollständige Resektion des Tumors mit Resektionsrändern weit im Gesunden in sogenannter „No-touch“-Technik. Die korrekte Weite des Resektionsabstandes ist allerdings noch Gegenstand von Diskussionen.<sup>9, 10</sup> Nur bei atypischen lipomatösen Tumoren – ein Synonym für gut differenzierte (G1) Liposarkome in chirurgisch gut zugänglichen Lokalisationen an Rumpf und Extremitäten – können Resektionsränder knapp im Gesunden entlang der bzw. bei intakter Tumorkapsel akzeptiert werden.<br />Bei WTS der Hüft- und Gesäßregion gestaltet sich die Resektion nicht nur wegen der engen Beziehung zum N. ischiadicus meist schwierig, sondern auch wegen der Tendenz dieser Tumoren, sich in Richtung Perineum und Becken auszubreiten.<sup>5</sup> Eine Infiltration des Knochens, etwa des proximalen Femurs, kann dessen Resektion und die Rekonstruktion unter Verwendung einer Tumorendoprothese nach sich ziehen. Autologe Gefäßtransplantate können erforderlich werden, wenn Gefäße vom Tumor eingeschlossen bzw. infiltriert sind und daher en bloc mit dem Präparat entfernt werden müssen.<sup>11</sup><br />Bei weiten Resektionen in der Inguinalregion müssen oft Muskellappen zur Rekonstruktion der resultierenden Weichteildefekte eingesetzt werden.<sup>12</sup> Beckenteilresektionen können bei kleineren Tumoren ausreichen, um weite Resektionsgrenzen einzuhalten (Abb. 2). In seltenen Fällen bleibt als Ultima Ratio eine Hemipelvektomie, sollten Nerven und Gefäße nicht zu erhalten sein.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2018_Jatros_Ortho_1801_Weblinks_s20_2.jpg" alt="" width="992" height="1315" /></p> <p>Radiotherapie kann sowohl präoperativ als auch postoperativ verabreicht werden. Vor allem bei höhergradigen (G2 und G3) malignen Tumoren, eine Größe von 5cm übersteigenden und tief zur Muskelfaszie lokalisierten WTS ist die postoperative Bestrahlung des Operationsfeldes indiziert. Dies kann aufgrund der engen anatomischen Beziehung zu großen vaskulären und neuronalen Strukturen gerade im Bereich der Hüfte und der Gesäßregion zu Problemen führen.<br />Zwar kann eine Chemotherapie bei lokalisiertem WTS der Erwachsenen das krankheitsfreie Überleben verlängern, ein positiver Einfluss auf das gesamte Langzeitüberleben konnte dagegen bisher nicht nachgewiesen werden.<sup>13, 14</sup> Wie bei der Radiotherapie profitieren auch bei der Chemotherapie besonders jene Patienten, bei denen große, tief lokalisierte und hochgradig maligne Tumorvarianten vorliegen.<sup>15, 16</sup></p> <p>Postoperative Wundheilungsstörungen sind eine gefürchtete Komplikation nach Resektion von WTS. Gerade nach weiten Resektionen großer Tumoren resultieren oft erhebliche Weichteildefekte, die nicht ohne plastisch-chirurgische Verfahren verschlossen werden können. Die Heilungssituation ist in diesen Fällen oft prekär. Postoperative adjuvante Radiatio erhöht zusätzlich das Risiko für Wundheilungsstörungen. Aber auch die Lokalisation des WTS spielt eine Rolle; so sind etwa in der Inguinalregion Wundheilungsstörungen per se häufiger zu beobachten als an den Extremitäten oder am Stamm.<sup>7</sup></p> <p>Die Prognose von WTS ist vor allem von den Faktoren Patientenalter, anatomische Lokalisation, histologischer Typ und Malignitätsgrad des jeweiligen Tumors sowie von der Weite des Resektionsabstandes abhängig.<sup>17, 18</sup> Hochgradig maligne, in der Tiefe lokalisierte, sehr große WTS entwickeln in rund 60 % Fernmetastasen, während nur 10 % der niedrig malignen WTS metastasieren.<sup>17</sup> Das Auftreten von Metastasen senkt die Überlebenswahrscheinlichkeit von Patienten mit WTS dramatisch. Durch die Entwicklung von neueren Behandlungsstrategien mit einem multimodalen Ansatz hat sich aber generell das Überleben auch dieser Patienten in den letzten 20 Jahren verbessert. Die Resektion der Metastasen – welche am häufigsten in der Lunge lokalisiert sind – sowie Chemotherapie und palliative Radiotherapie können die Prognose dieser Patienten positiv beeinflussen.<br />Die Inzidenz von Lokalrezidiven ist dagegen unmittelbar von der Resektionstechnik abhängig. Für WTS, die an einem Tumorzentrum adäquat operiert wurden, liegen die 5-Jahres-Lokalrezidivraten zwischen 12 und 26 % . Dieselben Faktoren, welche die Entstehung von Lokalrezidiven und Fernmetastasen beeinflussen, haben auch einen Einfluss auf das Gesamtüberleben. Während mit einem gut differenzierten Liposarkom eine 5-Jahres-Überlebensrate von 84 % zu verzeichnen ist, beträgt die 5-Jahres-Überlebensrate von Patienten mit beispielsweise epithelioiden Sarkomen nur 49 % .<sup>19</sup></p></p>
<p class="article-footer">
<a class="literatur" data-toggle="collapse" href="#collapseLiteratur" aria-expanded="false" aria-controls="collapseLiteratur" >Literatur</a>
<div class="collapse" id="collapseLiteratur">
<p><strong>1</strong> Smolle MA et al.: Ann R Coll Surg Engl 2015; 97(6): 434-8 <strong>2</strong> Kainhofer V et al.: Eur J Surg Oncol 2016; 42(6): 899-906 <strong>3</strong> Smolle MA et al.: EFORT Open Rev 2017; 2(10): 421-31 <strong>4</strong> Grimer RJ: Ann R Coll Surg Engl 2006; 88(6): 519-24 <strong>5</strong> Behranwala KA et al.: Ann Surg Oncol 2003; 10(8): 961-71 <strong>6</strong> Collin T et al.: Ann R Coll Surg Engl 2010; 92(4): 326-9 <strong>7</strong> Miyamoto S et al.: Ann Plast Surg 2017; 78(4): 443-7 <strong>8</strong> Brooks AD et al.: J Am Coll Surg 2001; 193(2): 130-6 <strong>9</strong> Ahmad R et al.: Oncologist 2016; 21(10): 1269-76 <strong>10</strong> Liu CY et al.: Ann Surg Oncol 2010; 17(8): 2102-11 <strong>11</strong> Radaelli S et al.: Surg Oncol 2016; 25(3): 125-31 <strong>12</strong> Aslim EJ et al.: Arch Plast Surg 2014; 41(5): 556-61 <strong>13</strong> Group ESESNW: Ann Oncol 2014; 25(Suppl 3): iii102-12 <strong>14</strong> Pasquali S, Gronchi A: Ther Adv Med Oncol 2017; 9(6): 415-29 <strong>15</strong> Woll PJ et al.: Lancet Oncol 2012; 13(10): 1045-54 <strong>16</strong> Posch F et al.: Clin Orthop Relat Res 2017; 475(5): 1427-35 <strong>17</strong> Italiano A et al.: Cancer 2014; 120(21): 3361-9 <strong>18</strong> Eilber FC et al.: Ann Surg 2003; 237(2): 218-26 <strong>19</strong> Corey RM et al.: Cancer Med 2014; 3(5): 1404-15</p>
</div>
</p>