Néphrite lupique: détection en temps voulu et traitement adéquat
Auteures:
Dre méd. Stephanie Damm
Pre Dre méd. Britta George
Klinik für Nephrologie
Universitätsspital Zürich
E-mail: stephanie.damm@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La néphrite lupique est l’une des principales manifestations organiques du lupus érythémateux systémique, car elle contribue de manière décisive à la morbidité et à la mortalité de la maladie. Le diagnostic peut être difficile à poser dans la pratique clinique quotidienne, car les paramètres cliniques et sérologiques peuvent être plus ou moins prononcés. Un traitement précoce est toutefois essentiel pour pouvoir stopper la perte de fonction rénale à long terme.
Keypoints
-
La néphrite lupique (NL) est une manifestation organique fréquente et sévère du lupus érythémateux systémique, qui contribue de manière significative à la morbidité et à la mortalité de la maladie.
-
En cas de signes cliniques d’une NL, le diagnostic précoce par biopsie rénale permet d’instaurer rapidement un traitement afin d’éviter des lésions chroniques et donc, à long terme, la perte de la fonction rénale.
-
Le traitement dépend de la classe de la NL, et il existe plusieurs nouveaux agents thérapeutiques dont le bénéfice dépend du profil individuel des patient·es.
-
Un traitement combiné multimodal permet de diminuer rapidement les corticostéroïdes et d’améliorer le contrôle du traitement. Un·e spécialiste doit choisir de manière individualisée quels médicaments combiner parmi ceux disponibles, en tenant compte des préférences des patient·es.
Le lupus érythémateux systémique (LES) fait partie des maladies auto-immunes qui peuvent toucher n’importe quel organe ou partie d’organe. Le processus de la maladie se déroule souvent sur plusieurs années et est marqué par des phases d’activité variable de la maladie.
La cause du LES n’est pas encore claire. Actuellement, on part de l’hypothèse d’un «multiple hit»: il existe probablement une prédisposition génétique qui, associée à des facteurs individuels et environnementaux, conduit au développement de la maladie.1 Chaque groupe ethnique, sexe et groupe d’âge peut être touché, avec une fréquence accrue chez les femmes et le groupe d’âge 18–45.2
Le diagnostic peut être difficile à poser, car l’éventail des symptômes est vaste et les paramètres immunologiques peuvent être différemment prononcés. Les manifestations les plus fréquentes sont des lésions cutanées, des douleurs musculaires et articulaires, de la fièvre, une perte de poids, de la fatigue et une intolérance à l’exercice. On peut observer des symptômes gastro-intestinaux, des troubles pulmonaires ou une atteinte des reins, du cœur ou de la moelle osseuse.3 Les paramètres sérologiques sont les anticorps antinucléaires (ANA), les anticorps anti-ADN double brin (anti-ADNdb) et les anticorps anti-Smith (anti-Sm) ainsi qu’une consommation des compléments C3c et C4.
Selon l’agressivité de la maladie, les atteintes organiques peuvent être légères ou engager le pronostic vital.4 Il est donc important de poser un diagnostic précoce et d’instaurer un traitement pour contrôler la maladie afin d’éviter les lésions chroniques ainsi que la morbidité et la mortalité associées.
Quelle est l’importance de la néphrite lupique et comment est-elle classifiée?
La néphrite lupique (NL) est une manifestation organique importante et nous ne disposons actuellement pas de biomarqueurs appropriés pour le diagnostic, ni dans le sang ni dans les urines, de sorte qu’une biopsie rénale est recommandée pour poser le diagnostic.5
La fréquence d’une NL est influencée par le groupe ethnique. La NL est présente dans environ 20 à 25% des cas chez les patient·es atteint·es de LES caucasien·nes et jusqu’à 50 à 60% des cas chez les patient·es sud-américain·es et africain·es. En conséquence, une biopsie rénale doit être envisagée plus souvent chez ces patient·es.6
Histologiquement, la NL correspond à une glomérulonéphrite à dépôts de complexes immuns et est divisée en 6 classes en fonction de l’étendue et de la localisation de l’inflammation:
-
Classes I et II: atteinte rénale légère avec inflammation dans une seule partie du glomérule (mésangium)
-
Classes III et IV: atteinte rénale sévère avec inflammation marquée dans plusieurs parties du glomérule (mésangium, capillaires, capsule de Bowman)
-
Classe V: forme particulière avec dépôts dans la membrane basale, correspondant à une glomérulonéphrite extramembraneuse
-
Classe VI: phase terminale de la maladie avec lésions majoritairement sclérotiques dans les glomérules
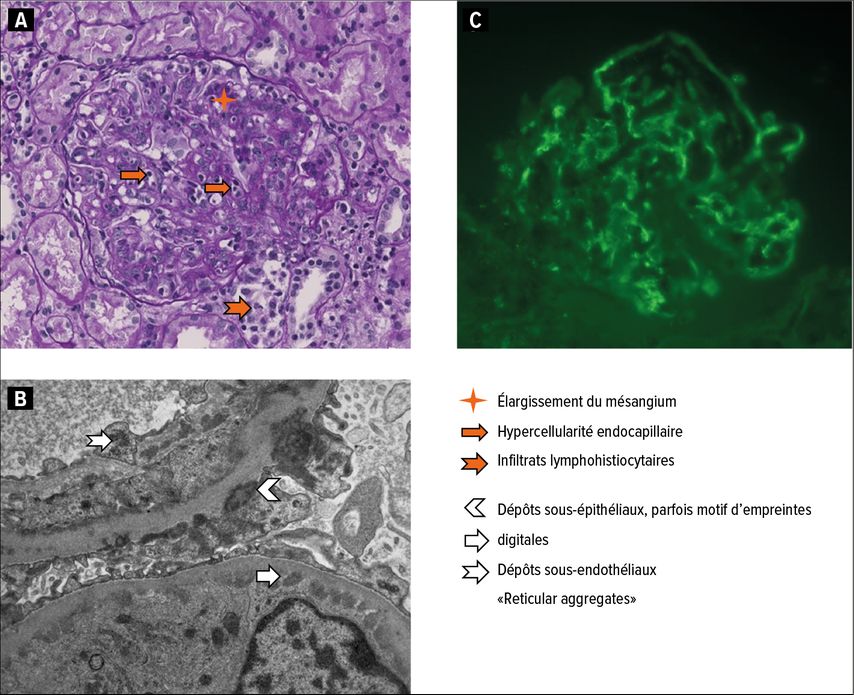
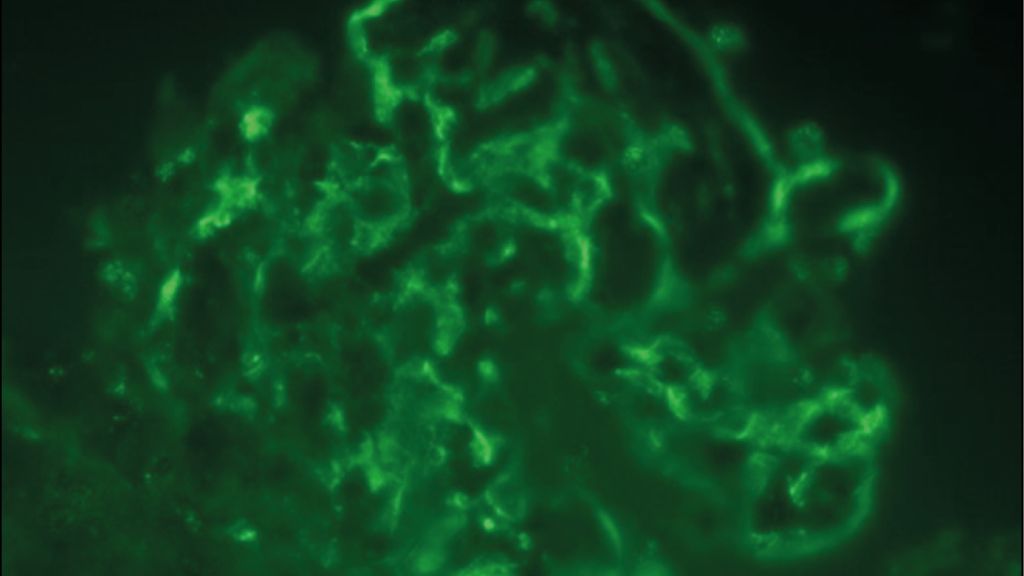
À titre d’exemple, la Figure1 présente des coupes histologiques d’une NL de classe IV et V, dans lesquelles on retrouve les lésions typiques en microscopie optique et électronique ainsi qu’en immunofluorescence. Dans les classes III et IV, un indice standardisé («NIH activity/chronicity index») indique l’étendue des lésions actives/inflammatoires ou chroniques/avec cicatrices.12 L’étendue des lésions chroniques a une importance pronostique et est associée à une survie rénale plus défavorable.13,14
Fig. 1: Les coupes histologiques montrent une néphrite lupique de classe IV et V avec (A) hypercellularité endocapillaire et infiltrat lymphohistiocytaire interstitiel en microscopie optique (MO) ainsi que (B) dépôts denses aux électrons classiques sous-endothéliaux et sous-épithéliaux et «reticular aggregates» en microscopie électronique (ME). (C) À titre d’exemple de la forte positivité de l’immunofluorescence (IF) dans toutes les analyses (IgG, IgA, chaînes légères libres kappa et lambda, facteur du complément C3 et antigène C1q selon le schéma classique «full house»), l’IF pour les IgG
Quand faut-il réaliser une biopsie rénale?
Les directives nationales et internationales en matière de traitement néphrologique et rhumatologique mentionnent la microhématurie glomérulaire et la protéinurie pour poser l’indication d’une biopsie rénale. On s’accorde à dire qu’une biopsie rénale doit être réalisée en cas de microhématurie glomérulaire et de protéinurie>500mg/j (estimée par spot urinaire ou recueil des urines de 24h). Il convient de noter que le contexte de cette recommandation repose sur des considérations d’applicabilité et d’invasivité du diagnostic et ne se fonde sur aucune donnée scientifique.5,7 En revanche, des études menées sur 275 patient·es atteint·es de LES ont montré que jusqu’à 50% présentaient une NL de classe III ou supérieure en cas de protéinurie <500mg/j.8,9 De même, la réduction de la protéinurie dans le sens d’une rémission complète/partielle est faiblement corrélée à l’activité histologique de la maladie dans les reins. Chez les patient·es ayant subi des biopsies rénales répétées au cours de l’évolution de la maladie, seul·es 25% des patient·es en rémission complète ne présentent plus d’activité, même histologique, après 12 mois. Chez les patient·es en rémission partielle, le pourcentage était encore plus faible, avec seulement 17%.10
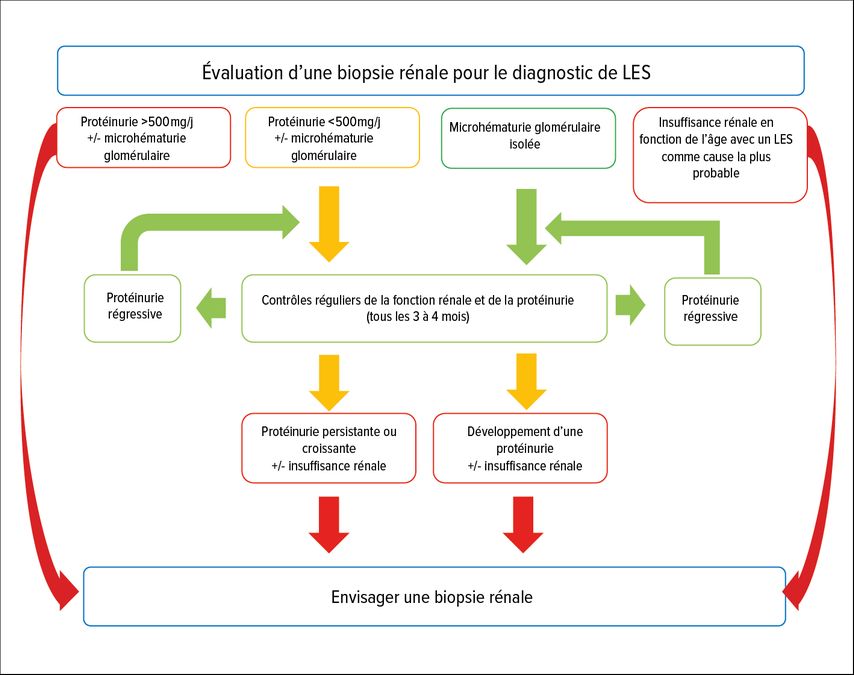
En conséquence, la décision de réaliser une biopsie rénale doit être prise sur une base individualisée plutôt que sur la base de paramètres cliniques individuels. Un algorithme possible au moment de la pose du diagnostic est illustré dans la Figure 2. Outre la pose du diagnostic de LES, d’autres moments importants pour envisager une biopsie rénale sont l’absence de réponse clinique au traitement 3 et 12 à 18 mois après le début du traitement.11
Fig. 2: Algorithme d’évaluation de la nécessité d’une biopsie rénale au moment du diagnostic du lupus érythémateux systémique (LES), sur la base des recommandations internationales de traitement néphrologique (KDIGO 2024 Clinical Practical Guidelines for the Management of Lupus Nephritis)5
Quel traitement doit être discuté avec les patient·es?
L’évaluation des facteurs de risque individuels et spécifiques à la maladie constitue la base de tout traitement du LES. Pour le LES en particulier, il convient de prendre en compte, outre le risque cardiovasculaire général (contrôle optimal de la pression artérielle et des lipides sanguins), le risque accru d’infections, la photosensibilité accrue de la peau ainsi que les risques associés au traitement, tels que l’ostéoporose, une diminution de la fertilité et le développement de tumeurs malignes.5 Sur la base des premières données du monde réel issues d’une vaste étude multicentrique et multinationale, on peut également supposer que les inhibiteurs du cotransporteur glucose-sodium de type 2 (iSGLT2) pourraient jouer un rôle central dans la réduction de la protéinurie en cas de NL, comme dans la maladie rénale chronique d’autres étiologies.22
Le traitement de référence par l’hydroxychloroquine (HCQ) est une pierre angulaire de l’immunomodulation, indépendamment de l’atteinte rénale. La dose recommandée est de 5mg/kgPC, en l’absence de contre-indications et si la préparation est disponible.15 Cette recommandation se fonde sur différents travaux qui ont décrit, sous traitement par l’HCQ, une amélioration de la densité osseuse, une amélioration du profil lipidique, une diminution des lésions chroniques des organes atteints, une réduction du risque cardiovasculaire, y compris des événements thrombotiques chez les patient·es atteint·es du syndrome des antiphospholipides, une amélioration de la réponse au traitement immunosuppresseur, une augmentation de l’obtention de la rémission clinique et une réduction des poussées de la maladie («flares»).4,5,16
Des contrôles ophtalmologiques réguliers doivent être effectués après le début du traitement en raison du potentiel développement d’une rétinopathie sous l’HCQ. En présence de facteurs de risque tels qu’un traitement concomitant par le tamoxifène, un débit de filtration glomérulaire estimé (DFGe) <60ml/min ou une dose d’HCQ >5mg/kgPC, il est recommandé d’effectuer les contrôles 12 mois après le début du traitement, puis chaque année. En l’absence de ces facteurs de risque, le contrôle peut commencer 5 ans après le début du traitement.16 La dose doit également être réduite de 25% dès que le DFGe est <30ml/min.5
Outre l’HCQ, le choix du traitement immunosuppresseur dépend du type et de la sévérité de l’atteinte organique. La présence d’une NL détermine souvent le choix du traitement immunosuppresseur. Dans la grande majorité des cas, une NL de classe I et II n’est pas traitée par un immunosuppresseur, mais par des mesures de soutien générales (contrôle optimal des facteurs de risque cardiovasculaires, réduction de la protéinurie). Un syndrome néphrotique concomitant constitue une exception, car on suppose dans ce cas la présence d’une podocytopathie lupique, qui doit être traitée par des corticostéroïdes à forte dose comme une «minimal change disease».
De manière comparable, une NL de classe V isolée est traitée en premier lieu de manière conservatrice, à condition qu’il n’y ait aucune complication (thrombose, troubles du métabolisme des lipides, œdème prononcé) associées à la protéinurie. Selon l’évolution et la sévérité de la protéinurie (p.ex. en cas de syndrome néphrotique), des schémas thérapeutiques comparables à ceux pour les classes III et IV sont disponibles.
Un traitement combiné multimodal est désormais recommandé pour la NL de classe III et IV. Le mycophénolate mofétil (MMF) et les corticostéroïdes restent la base du traitement de première ligne recommandé et peuvent être complétés de manière individualisée soit par le cyclophosphamide (CYS), le bélimumab ou la voclosporine. Cette dernière est uniquement autorisée en association avec le MMF. Le bélimumab peut être combiné soit au MMF soit au CYS en trithérapie (Fig. 3).5
Fig. 3: Algorithme thérapeutique de la néphrite lupique de classe III/IV. L’ordre des traitements n’indique aucune préférence pour une certaine alternative. Le traitement immunosuppresseur doit toujours être administré en concomitance avec un traitement néphroprotecteur général. Le bélimumab (BEL) peut être combiné avec le mycophénolate mofétil (MMF) ou le cyclophosphamide (CYC) à faible dose pour le traitement d’induction, ou avec l’azathioprine (AZA) ou le MMF pour le traitement d’entretien. L’inhibiteur de la calcineurine voclosporine (VOC) peut être combiné au MMF (adaptée selon Fanouriakis A et al.: Ann Rheum Dis 2024; 83: 15-29)
Cet anticorps monoclonal humain recombinant de type IgG1λ inhibe un facteur d’activation des lymphocytes B. Dans les études, le traitement par le bélimumab a entraîné une réduction de la protéinurie, une légère diminution de la fonction rénale, une augmentation des rémissions cliniques et histologiques, ainsi qu’une baisse de l’incidence des poussées rénales. Cela semble surtout être le cas chez les patient·es présentant une protéinurie <3g/j.19–21 La voclosporine est un inhibiteur de la calcineurine qui contribue à une réduction plus rapide de la protéinurie et donc à une rémission clinique. Les effets sur la fonction rénale n’ont pas encore été démontrés. Son utilisation semble particulièrement efficace chez les patient·es présentant une protéinurie>3g/j.
Pour les évolutions réfractaires, le cyclophosphamide ou le rituximab est recommandé pour l’escalade thérapeutique.4,5 Un grand avantage du traitement combiné est une réduction rapide et précoce du traitement concomitant par des corticostéroïdes, car il a pu être identifié comme un facteur déterminant du développement d’infections et de la mortalité associée.17,18 En conséquence, il est recommandé de suspendre complètement le traitement par des corticostéroïdes oraux au bout de 12 mois, dans la mesure où cela est acceptable du point de vue de l’activité de la maladie.5 D’autres avantages sont une plus grande probabilité de rémission précoce et donc une prévention ou une réduction des lésions chroniques.
Le traitement d’induction doit être suivi d’un traitement d’entretien, de préférence par le MMF ou l’azathioprine (AZA) comme préparation de substitution en cas d’intolérance/de contre-indications. La durée totale du traitement immunosuppresseur doit être d’au moins 3 ans, les directives de traitement rhumatologique exigeant en outre une rémission (complète/partielle) d’au moins 2 ans.4,5
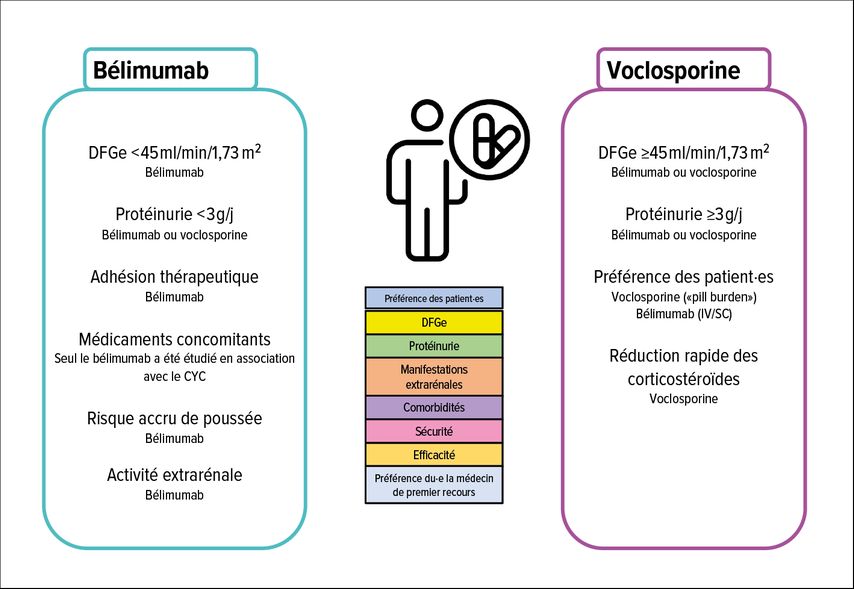
Un meilleur contrôle de l’activité de la maladie implique toutefois pour les patient·es une augmentation du fardeau posologique et du risque d’infections, et s’accompagne d’une augmentation des coûts thérapeutiques pour la collectivité, raison pour laquelle il convient de prendre une décision individualisée sur la combinaison des options thérapeutiques disponibles. Une possibilité de décision individualisée est représentée dans la Figure 4.
Fig. 4: Choix du traitement multicible. Comparaison des options thérapeutiques actuellement disponibles pour l’utilisation d’un traitement multicible. Utilisation privilégiée du bélimumab en cas de débit de filtration glomérulaire estimé (DFGe) <45ml/min/1,73m2, d’activité extrarénale élevée, de risque accru de poussée et de problèmes d’adhésion. Administration privilégiée de voclosporine en cas de protéinurie >3g/j et de nécessité de réduire rapidement les corticostéroïdes (adaptée selon Frangou E et al. 2024)23
Littérature:
1 Pons-Estel GJ et al.: Semin Arthritis Rheum 2010; 39: 257-68 2 Lahita RG: Curr Opin Rheumatol 1999 ; 11: 352-6 3 Cervera R et al.: Medicine (Baltimore) 2003; 82: 299-308 4 Aringer M et al.: Arthritis Rheumatol 2019; 71: 1400-12 5 Rovin BH et al.: Kidney Int 2024; 105: 31-4 6 Alarcon GS et al.: Lupus 2002; 11: 95-101 7 Mucke J, Aringer M et al.: Z Rheumatol 2024; 83: 431-8 8 Christopher-Stine L et al.: J Rheumatol 2007; 34: 332-5 9 Al Arfaj AS, Khalil N: Saudi J Kidney Dis Transpl 2023; 34: 154-609: 38146725 10 Malvar A et al.: Nephrol Dial Transplant 2017; 32: 1338-44 11 Rodriguez-Ramirez S et al.: Kidney Med 2023; 6: 100772 12 Bajema IM et al.: Kidney Int 2018; 93: 789-96 13 Nakagawa S et al.: Lupus 2021; 30: 1739-46 14 Sun YS et al.: Rheumatol (Oxford) 2024; 63: 2467-72 15 Jorge AM et al.: JAMA 2022; 328: 1458-60 16 Peña-Vizcarra ÓR et al.: Rheumatol (Oxford) 2024; 63: 2230-8 17 Obrișcă B et al.: Clin Rheumatol 2021; 40 3285-97 18 Frodlund M et al.: Rheumatol (Oxford) 2024; 63: 1104-12 19 Furie R et al.: N Engl J Med 2020; 383: 1117-28 20 Rovin BH et al.: Kidney Int 2022; 101: 403-13 21 Anders HJ et al.: Nephrol Dial Transplant 2023; 38: 2733-42 22 Caravaca-Fontán F et al.: Nephrol Dial Transplant 2024; 39: 328-40 23 Frangou E et al.: Nephrol Dial Transplant 2024; 39: 727-30
Das könnte Sie auch interessieren:
Les inhibiteurs de CDK4/6 mis en évidence
Le San Antonio Breast Cancer Symposium (SABCS) n’est généralement pas l’endroit où sont présentées des études de grande envergure venant modifier la pratique. Cette année encore, l’ ...
Petites voies respiratoires, grands effets: «small airways disease»
La maladie des petites voies respiratoires («small airways disease», SAD) joue un rôle central dans les maladies respiratoires chroniques telles que la BPCO et l’asthme. Outre le ...
Réactivation du VHB sous traitement immunosuppresseur
En raison des dynamiques migratoires actuelles, la prévalence de l’infection par le virus de l’hépatite B (VHB) est également en hausse en Autriche. Il faut donc être particulièrement ...