Les défis du diabète de type 1
Compte-rendu:
Claudia Benetti
Journaliste médicale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le calcul de la quantité d’insuline constituent d’autres défis, comme l’a expliqué le Pr Dr méd. Roger Lehmann de l’Hôpital universitaire de Zurich.
Le défi du diagnostic
Le diabète de type 1 (DT1) se caractérise par une destruction auto-immune des cellules bêta du pancréas, médiée par les lymphocytes T, qui entraîne un déficit absolu en insuline. «On observe également une tendance à l’acidocétose», explique R.Lehmann. Bien que l’incidence soit la plus élevée à la puberté et dans la petite enfance, le DT1 peut aussi seulement se déclarer à l’âge adulte.
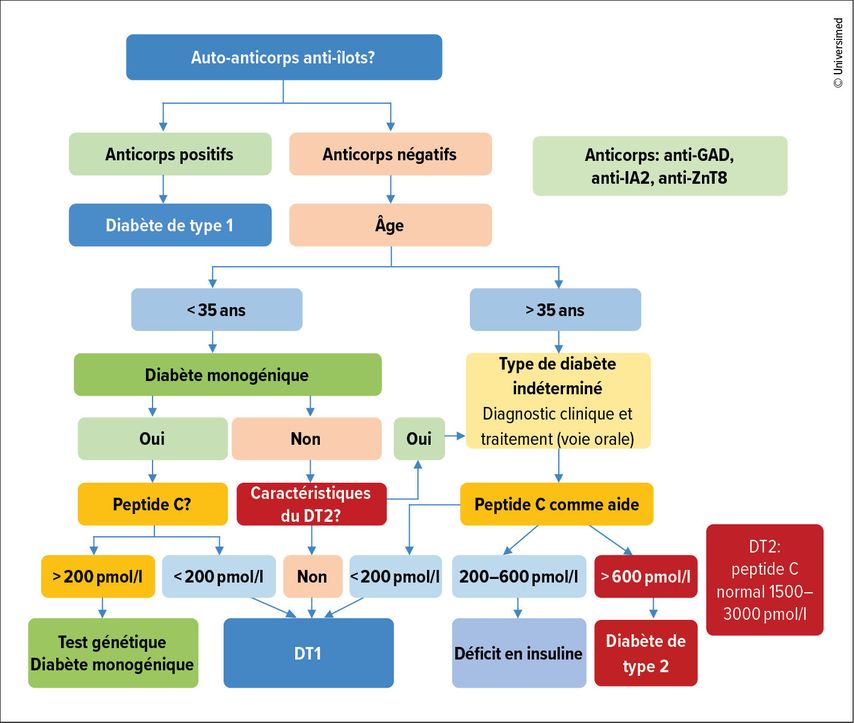
La pose du diagnostic peut être difficile à l’âge adulte. Très souvent, un DT1 survenant après l’âge de 30 ans est en premier lieu interprété à tort comme un diabète de type 2 (DT2) et traité comme tel. Il n’existe aucune caractéristique clinique qui confirme de manière isolée un DT1. La caractéristique la plus pertinente est le jeune âge au moment du diagnostic (<35ans), bien qu’un IMC faible (<25kg/m2), une perte de poids involontaire, une acidocétose et une glycémie >20mmol/l lors de la consultation puissent également être évocateurs.1 Il faut toutefois garder à l’esprit qu’il est de plus en plus fréquent que des patient·es en surpoids ou souffrant d’obésité développent un DT2 à un jeune âge, et qu’il existe également des patient·es atteint·es de DT1 qui sont en surpoids ou souffrent d’obésité. Le DT1 est diagnostiqué en raison d’une acidocétose dans une minorité de cas seulement; une acidocétose peut survenir en cas de DT2 dans de rares cas. Un diabète monogénique peut également se présenter sous la forme d’un DT1. Les auto-anticorps anti-îlots – il est recommandé de rechercher les anticorps anti-GAD, anti-IA2 et anti-ZnT8 – n’ont pas non plus une valeur prédictive positive de 100%. Dans 5 à 10% des cas de DT1, ils sont négatifs. L’European Association for the Study of Diabetes (EASD) et l’American Diabetes Association (ADA) ont élaboré un algorithme pour faciliter le diagnostic (Fig. 1).1
Le défi des hypoglycémies
Physiologiquement, la glycémie est maintenue dans une plage étroite de 3,5 à 5,6mmol/l à jeun et de 7,0 à 8,0mmol/l en postprandial. «Un seul gramme de cellules bêta suffit à assurer cette régulation parfaite de la glycémie. En cas d’absence de production d’insuline et de perte du capteur de glucose dans les cellules bêta, il est donc important de rétablir cet équilibre par un traitement», explique R. Lehmann. L’équilibre est toutefois fragile: les glucides, la maladie ainsi que l’obésité augmentent la glycémie et peuvent provoquer une hyperglycémie, tandis que l’insuline, l’exercice ainsi que la privation de nourriture font baisser la glycémie et peuvent provoquer une hypoglycémie. Il est donc très important de surveiller la variabilité de la glycémie et de vérifier les profils glycémiques. «L’HbA1c ne nous renseigne pas sur la variabilité de la glycémie. Même avec une HbA1c située dans la plage cible, la glycémie peut présenter de grandes variations», a souligné l’intervenant.
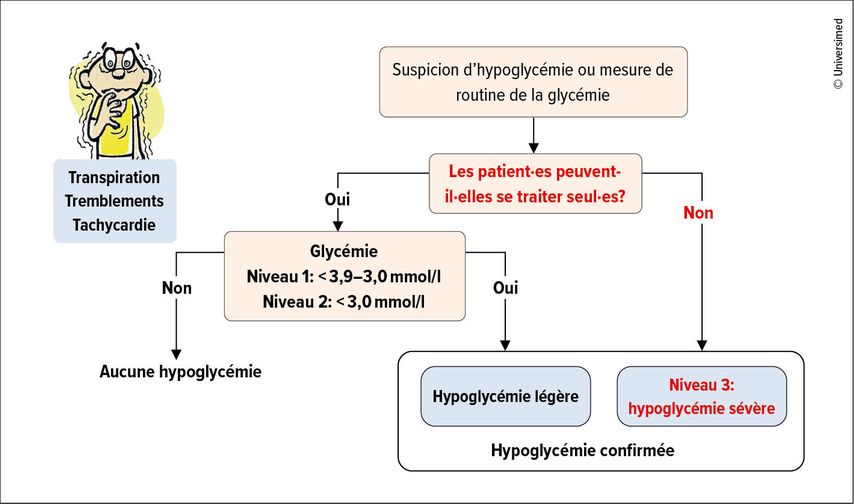
Les hypoglycémies sont une cause fréquente d’hospitalisation d’urgence.» L’incidence des hypoglycémies dépend du type de diabète (DT1 > DT2) et de la durée de l’insulinothérapie. En cas de DT1 et de durée de la maladie supérieure à 15 ans, par exemple, 50% des personnes atteintes présentent une hypoglycémie sévère chaque année.2 On distingue trois niveaux d’hypoglycémie. Aux niveaux 1 et 2, la glycémie baisse respectivement à <3,9mmol/l et <3,0mmol/l, et les personnes concernées sont encore en mesure de se traiter seules. En cas d’hypoglycémie de niveau 3 (sévère), les patient·es ont besoin d’une aide extérieure et peuvent perdre connaissance (Fig. 2).3
Le Diabetes Control and Complications Trial a montré qu’entre 12 et 60 hypoglycémies sévères surviennent pour 100 années de traitement en cas de DT1, en fonction du traitement et de l’HbA1c.4 Deux tiers surviennent la nuit. Plus l’HbA1c est faible, plus les hypoglycémies sont fréquentes. Le traitement par pompe à insuline obtient les meilleurs résultats en termes de risque d’hypoglycémie, suivi par l’insulinothérapie selon le schéma basal-bolus et le schéma à base d’insulines mixtes, qui ne sont toutefois plus guère utilisés aujourd’hui.4
Les symptômes classiques de l’hypoglycémie sont des symptômes adrénergiques comme la transpiration, les tremblements, la tachycardie. Si la baisse de la glycémie est particulièrement forte, une neuroglycopénie peut également survenir, laquelle se manifeste classiquement par une vision floue et une diplopie. Il est également possible d’observer des céphalées, de l’agressivité ou un comportement anormal. «Lorsqu’une neuroglycopénie se produit, les personnes concernées ne réalisent plus qu’elles sont en hypoglycémie, elles deviennent léthargiques et tombent dans le coma. Des convulsions sont également possibles», a déclaré l’intervenant.
Un autre point à prendre en compte est que plus l’HbA1c est faible, plus le risque d’hypoglycémie sévère augmente, mais le taux de progression de la rétinopathie diminue dans le même temps.5 «Sur le plan thérapeutique, il s’agit donc de trouver une valeur seuil avec un taux d’HbA1c raisonnable, associé au nombre d’hypoglycémies sévères et au risque de rétinopathie les plus faibles possible», a expliqué R. Lehmann.
Le défi de l’insulinothérapie
Dans le cas de l’insulinothérapie intensifiée selon le schéma basal-bolus, l’insuline basale empêche l’augmentation de la glycémie à jeun et l’insuline en bolus celle postprandiale. Les insulines se distinguent du point de vue pharmacocinétique en termes de début et de durée d’action. L’absorption par voie sous-cutanée dépend de la façon dont la molécule d’insuline a été chimiquement modifiée.6
La tendance est aux insulines à action ultra-longue et ultra-rapide
Les insulines à action intermédiaire, comme la NPH ou l’insuline régulière (Actrapid®), n’ont pratiquement plus d’importance dans le traitement du DT1. On utilise principalement des insulines basales à action longue et ultra-longue (p.ex. glargine [Lantus®], détémir [Levemir®], glargine 300 [Toujeo®] et dégludec [Tresiba®]) ainsi que des insulines en bolus à action rapide et ultra-rapide (p.ex. lispro [Humalog®], aspart [NovoRapid®], glulisine [Apidra®] et Faster aspart [Fiasp®]). «Cela vaut pour chaque insuline: plus la dose est élevée, plus la durée d’action est longue. Et plus la durée d’action d’une insuline est longue, plus la variabilité du taux d’insuline est faible, plus le pic disparaît rapidement et plus le risque d’hypoglycémie est faible», explique le diabétologue. Les insulines à action ultra-longue sont celles qui provoquent le moins d’hypoglycémies; elles doivent uniquement être injectées une fois par jour, le moment de l’injection ne jouant aucun rôle. En ambulatoire, on utilise donc presque exclusivement des insulines basales injectées une fois par jour (Tresiba®, Toujeo®). Chez les patient·es hospitalisé·es, on utilise parfois encore des insulines basales injectées deux fois par jour, en particulier en cas d’incertitude quant à la dose.
En ce qui concerne les insulines en bolus à courte durée d’action, la tendance est à l’utilisation d’insulines à action rapide et ultra-rapide. L’action débute dans les 15 à 20 minutes pour les premières et dans les 5 à 10 minutes pour les secondes. La durée d’action est de 3 à 4 heures pour toutes. «Pour obtenir des taux de glycémie raisonnables, les patient·es doivent donc veiller à respecter un intervalle correct entre l’injection et le repas», a souligné R. Lehmann. Les insulines à action rapide doivent être injectées environ 30 minutes avant le repas et celles à action ultra-rapide 15 à 20 minutes avant. Si l’intervalle entre l’injection et le repas ne peut pas être respecté, il faut veiller à l’ordre dans lequel les aliments sont consommés: d’abord la salade et les légumes, puis les aliments riches en protéines (viande, poisson, produits laitiers) et à la fin seulement les glucides.7
Calcul des besoins en insuline
Les besoins journaliers en insuline sont généralement de 0,6U/kg PC. Ils sont légèrement plus faibles en cas de DT1 nouvellement diagnostiqué (0,4–0,5U/kgPC) et plus élevés chez les adolescents ainsi que les jeunes adultes jusqu’à l’âge de 25 ans environ (1,0–1,4U/kgPC). La moitié des besoins journaliers en insuline est prescrite sous forme d’insuline basale à action longue, l’autre moitié sous forme d’insuline en bolus à injecter avant chaque repas.
«Sans peser ou estimer correctement la quantité de glucides d’un repas, il est impossible d’obtenir un bon contrôle de la glycémie avec l’insuline», a ajouté R. Lehmann. Dans le cas du DT1, la consultation de nutrition joue donc un rôle central. Les personnes concernées doivent apprendre quelle est la teneur en glucides de chaque aliment et comment calculer la quantité d’insuline nécessaire. Pour 10g de glucides, il faut 1U d’insuline en bolus. En cas de glycémie élevée, il faut en outre injecter de l’insuline de correction à courte durée d’action. Il faut savoir qu’une unité (U) d’insuline de correction fait baisser la glycémie de 2mmol/l pendant la journée et de 4mmol/l pendant la nuit, lorsque la sensibilité à l’insuline est plus élevée. Au moment du coucher et la nuit, la dose d’insuline de correction doit donc être réduite de moitié.
Si un repas est riche en protéines et en matières grasses, la dose d’insuline doit être augmentée au moment du repas et injectée en deux fois (50–75% en bolus initial et 25–50% sur 2,5 heures).8 La règle générale pour calculer les besoins supplémentaires en insuline est la suivante: pour 125kcal sous forme de matières grasses et de protéines, il faut 1U d’insuline (facteur protéines: 30g/1U [120 kcal], facteur matières grasses: 15g/1U [135 kcal]).
Source:
FOMF Diabetes Update Refresher, du 7 au 9 novembre 2024, à Zurich
Littérature:
1 Holt RIG et al.: The management of type 1 diabetes in adults. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2021; 64: 2609-52 2 UK Hypglycaemia Study Group: Risk of hypoglycaemia in types 1 and 2 diabetes: effects of treatment modalities and their duration. Diabetologia 2007; 50: 1140-7 3 Professional Practice Committee: Standards of medical care in diabetes—2022. Diabetes Care 2022; 45(Suppl 1): 83-96 4 Steffes MW et al.: Beta-cell function and the development of diabetes-related complications in the diabetes control and complications trial. Diabetes Care 2003; 26: 832-6 5 The Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-86 6 Mathieu C et al.: Insulin analogues in type 1 diabetes mellitus: getting better all the time. Nat Rev Endocrinol 2017; 13: 385-99 7 Kroger J et al.: AGP and nutrition - analysing postprandial glucose courses with CGM. Diabetes Res Clin Pract 2021; 174: 108738 8 Bell KJ et al.: Optimized mealtime insulin dosing for fat and protein in type 1 diabetes: application of a model-based approach to derive insulin doses for open-loop diabetes management. Diabetes Care 2016; 39: 1631-4
Das könnte Sie auch interessieren:
Traitement de la maladie de Crohn: concepts éprouvés et nouvelles stratégies
Quels sont les objectifs thérapeutiques des médecins qui traitent des patient·es atteint·es de la maladie de Crohn (MC), et ces objectifs coïncident-ils avec ceux des personnes ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...