L’asthme et le rythme circadien
Auteures:
Pre Mag. Dre rer. nat. Eva Böhm
Julia Teppan, MSc
Lehrstuhl für Pharmakologie
Otto Loewi Forschungszentrum für Gefässbiologie, Immunologie und Entzündung Medizinische Universität Graz
E-mail: eva.boehm@medunigraz.at
E-mail: julia.teppan@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage pharmacologique de l’horloge circadienne pourrait être utilisé à l’avenir dans de nouvelles approches thérapeutiques.
Keypoints
-
L’asthme est une maladie inflammatoire chronique qui suit un rythme circadien important.
-
Les données actuelles indiquent une communication et une régulation bidirectionnelles entre les systèmes circadien et immunitaire dans l’asthme.
-
Les approches chronothérapeutiques et le ciblage pharmacologique du système circadien peuvent améliorer la prise en charge thérapeutique des personnes asthmatiques présentant des symptômes nocturnes et une forme réfractaire.
L’asthme est une maladie inflammatoire chronique hétérogène des voies respiratoires, caractérisée par une hyperréactivité bronchique et une obstruction variable des voies respiratoires, et suit un rythme circadien (Fig. 1).1 Les symptômes cliniques de bronchoconstriction et de surproduction de mucus s’aggravent généralement la nuit, environ 90% des crises d’asthme surviennent entre la fin de la soirée et le début de la matinée, ce qui affecte considérablement la qualité du sommeil et de vie des patient·es asthmatiques.2 Les raisons possibles sont la dominance du système nerveux parasympathique pendant le sommeil, qui entraîne un rétrécissement des voies respiratoires3, et la réduction de la sécrétion d’hormones stéroïdiennes pendant la nuit, qui peut aggraver l’inflammation des voies respiratoires.4–6 Outre les variations circadiennes des catécholamines7, de nombreux médiateurs inflammatoires8–10, des hormones circadiennes cortisol et mélatonine11,12, les polymorphismes des récepteurs bêta13 et surtout ce que l’on appelle l’horloge circadienne moléculaire peuvent également jouer un rôle de régulateur important.14
L’asthme et le rythme circadien
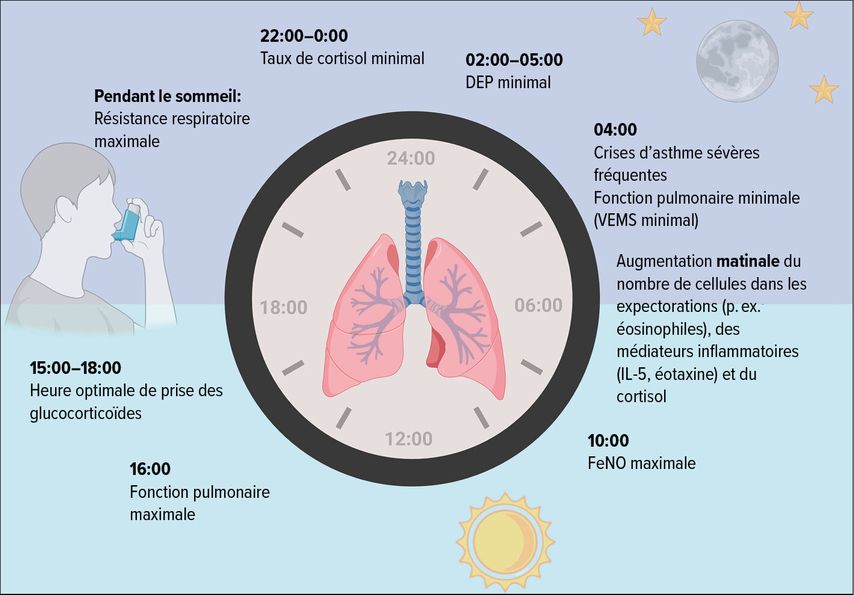
Une enquête représentative menée auprès de patient·es asthmatiques a révélé que 4 heures du matin constitue une phase particulièrement critique pour de nombreuses personnes concernées. 74% des personnes interrogées ont déclaré être réveillées par des crises d’asthme au moins une fois par semaine, voire toutes les nuits à cette heure-là pour 40% d’entre elles. Cette constatation coïncide avec le fait que de nombreux décès liés à l’asthme surviennent également tôt le matin.15,16
Bien qu’il soit prouvé que la fonction pulmonaire varie également sur une période de 24 heures chez les personnes en bonne santé, atteignant son maximum vers 16 heures et son minimum vers 4 heures du matin, la variation est beaucoup plus marquée chez les patient·es asthmatiques.17,18 On suppose que les facteurs suivants contribuent aux variations circadiennes de la fonction pulmonaire:
Les variations diurnes du diamètre des voies respiratoires se reflètent dans les indices de résistance des voies respiratoires tels que le volume expiratoire maximal seconde (VEMS) ou le débit expiratoire de pointe (DEP).17 Le DEP minimal survient typiquement entre 2et 5 heures, et le VEMS minimal vers 4heures. Pendant le sommeil, la résistance des voies respiratoires peut augmenter en raison de l’activation du système nerveux parasympathique.3
Lorsque la résistance des voies respiratoires est maximale, l’être humain montre une tolérance relative à l’accumulation de CO2 et minimise l’effort respiratoire pendant le sommeil.19,20
Outre la fonction pulmonaire, l’inflammation chez les personnes asthmatiques est également soumise à des variations diurnes. On observe une augmentation du nombre d’éosinophiles, de neutrophiles et de lymphocytes T CD4+ dans les expectorations, surtout la nuit et jusqu’aux premières heures du matin, qui s’accompagne de concentrations élevées d’interleukine-5 et d’éotaxine tôt le matin.8,9,21,22 Les mesures des radicaux de l’oxygène endommageant les tissus ont révélé des valeurs significativement plus élevées à 4 heures chez les patient·es souffrant d’asthme nocturne par rapport aux patient·es sans symptômes nocturnes.23 La fraction expirée du monoxyde d’azote (FeNO), qui est un biomarqueur de l’inflammation éosinophile, reflète également ces variations circadiennes. Il est intéressant de noter qu’on observe uniquement un cycle suivant un rythme pour la FeNO chez les personnes asthmatiques, les valeurs maximales étant mesurées à 10 heures et minimales pendant la nuit.24,25
L’horloge circadienne moléculaire
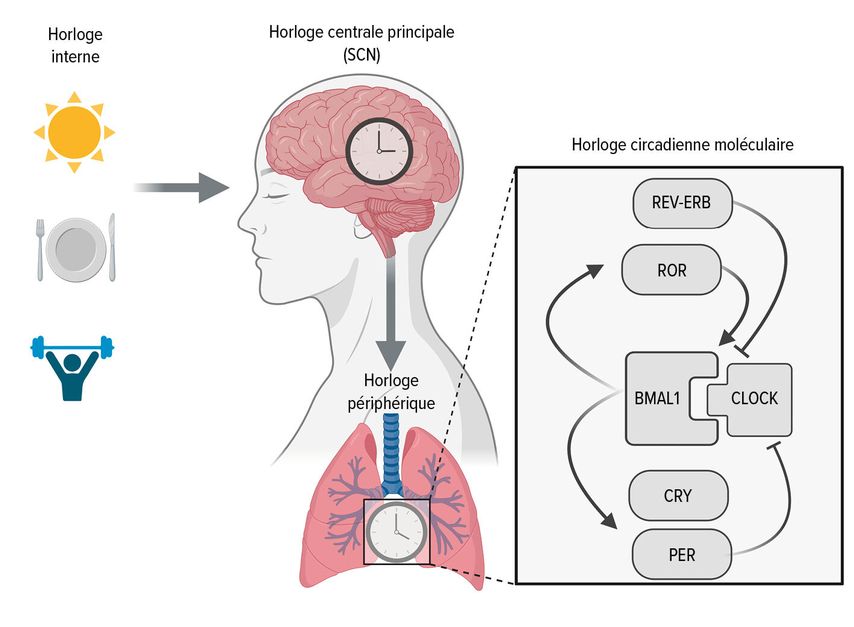
Le rythme circadien (circa diem=environ un jour) est l’horloge interne qui synchronise les processus physiologiques sur une période d’environ 24 heures. Les noyaux suprachiasmatiques (SCN), un petit groupe de cellules nerveuses dans l’hypothalamus, constitue l’«horloge centrale» principale du rythme circadien.26,27 Ils reçoivent des signaux en fonction de la lumière depuis la rétine via le tractus rétinohypothalamique et transmettent ces informations, via des facteurs neuronaux et humoraux, à des «horloges périphériques» autonomes, présentes en principe dans l’ensemble des organes et des cellules de l’organisme (Fig. 2).28 De cette manière, le rythme interne est adapté au cycle veille-sommeil. Le rythme circadien influence donc un grand nombre de processus physiologiques, comme la sécrétion d’hormones, de neurotransmetteurs et de médiateurs inflammatoires. Les perturbations de ce rythme peuvent par exemple favoriser les maladies métaboliques, psychiques, neurodégénératives et inflammatoires.27 Certaines études ont confirmé que les personnes qui travaillent en équipe depuis des années et qui souffrent d’une perturbation du rythme circadien éveil-sommeil, appelée «troubles du sommeil dus au travail posté», présentent un risque accru de développer de l’asthme, indépendamment de leur prédisposition génétique.29,30
Le prix Nobel de médecine ou physiologie a été décerné en 2017 aux chronobiologistes Jeffrey C. Hall, Michael Rosbash et Michael W. Young, qui ont pu décrypter d’importants mécanismes moléculaires du rythme circadien lors d’études sur la mouche du vinaigre Drosophila melanogaster.31 Dans des boucles de rétroaction couplées entre elles, des «clock genes» ou des «clock proteins» contrôlent leur propre transcription dans un cycle de 24 heures. Les éléments positifs de ces boucles de rétroaction sont les facteurs de transcription BMAL1 et CLOCK qui, en tant qu’hétérodimères, régulent eux-mêmes l’expression des gènes PER 1 et 2 ainsi que CRY 1 à 3 de la «core loop» négative, tout comme les répresseurs de la transcription REV-ERBα et β ainsi que les activateurs de la transcription RORα–γ de l’«accessory loop». PER et CRY inhibent eux l’activité de BMAL1; REV-ERBα est le répresseur et RORα le principal activateur de la transcription de BMAL1 (Fig. 2). Il s’ensuit une activation et une désactivation transcriptionnelles périodiques de l’horloge circadienne moléculaire sur une période de 24 heures. Cet équilibre est essentiel pour le fonctionnement du système immunitaire, car BMAL1 est un facteur de transcription important de nombreux gènes pro- et anti-inflammatoires, et REV-ERBα et ROR interviennent également en tant que régulateurs dans les processus inflammatoires.
Les résultats de recherches récentes montrent toutefois que l’expression protéique des différents composants de l’horloge circadienne moléculaire est fortement réduite, en particulier dans les éosinophiles sanguins des personnes asthmatiques, et que les variations circadiennes sont à peine perceptibles.Cela semble être dû à l’inflammation et reflète la sévérité de la maladie, l’obstruction des voies respiratoires et les allergies existantes des patient·es.32
REV-ERBα et RORα
REV-ERBα (ou NR1D1) et RORα (ou NR1F1) sont des récepteurs nucléaires qui se lient à la même séquence d’ADN dans le promoteur du gène BMAL1. REV-ERBα inhibe l’expression de BMAL1, tandis que RORα l’active. Cette action opposée permet une régulation précise de l’expression de BMAL1 et donc du rythme circadien des cellules. Cette interaction est importante pour le contrôle temporel de divers processus physiologiques, y compris la fonction immunitaire, et peut jouer un rôle significatif dans la régulation précise des réactions inflammatoires dans les voies respiratoires.
En tant que répresseur de la transcription de BMAL1 et d’autres gènes pro-inflammatoires, REV-ERBα est considéré comme le lien entre les systèmes circadien et immunitaire. Il inhibe par exemple la transcription de nombreuses cytokines et chimiokines33 ainsi que du facteur de transcription NF-B34, qui sont tous des médiateurs pro-inflammatoires importants dans la pathogenèse de l’asthme. En outre, REV-ERBα peut inhiber la migration des éosinophiles ainsi que des neutrophiles et influencer la polarisation des macrophages, atténuant ainsi l’inflammation chronique dans les voies respiratoires.14,35 Des études ont révélé que l’aggravation nocturne des symptômes d’asthme peut être liée à l’activité de REV-ERBα: si REV-ERBα est inhibé expérimentalement, les variations diurnes de l’hyperréactivité bronchique disparaissent.36
RORα, l’antagoniste de REV-ERBα, favorise la différenciation et la fonction des cellules Th237 et Th1738, qui jouent toutes deux un rôle clé dans l’inflammation de type 2 et les formes d’asthme résistantes aux corticoïdes. L’inactivation expérimentale de RORα entraîne une nette amélioration de l’inflammation des voies respiratoires et a un effet positif sur l’hyperréactivité bronchique.14,32,39 En outre, nous avons pu montrer que l’inhibition pharmacologique de RORα normalise à nouveau l’expression protéique des différents composants de l’horloge circadienne moléculaire, réactive l’«horloge interne» des cellules et entraîne de ce fait une amélioration de l’inflammation bronchique ainsi que de la fonction pulmonaire.32
Signification clinique
La prise en compte du rythme circadien peut être importante pour le diagnostic de l’asthme, par exemple pour l’interprétation des tests de la fonction pulmonaire et des mesures de la FeNO. Durrington et al. ont récemment montré que la sensibilité du dosage de FeNO et du test de bronchospasmolyse augmentait s’ils étaient effectués le matin.25
Une approche chronothérapeutique, dans laquelle on essaie de synchroniser la concentration du principe actif et l’heure de la prise avec le rythme de l’activité de la maladie, peut également améliorer le succès thérapeutique et réduire les effets secondaires. Par exemple, le taux de cortisol est physiologiquement a son maximum entre 6 et 8 heures et à son minimum entre 22 heures et minuit. Plusieurs études ont confirmé que la prise de glucocorticoïdes (systémiques et inhalés) vers 15 heures a une efficacité maximale pour réduire l’inflammation des voies respiratoires et la baisse matinale du VEMS chez les patient·es souffrant d’asthme nocturne, sans provoquer d’insuffisance surrénale.18,40–44
Les bêta-mimétiques peuvent parfois avoir un effet négatif sur le sommeil en raison de leur profil d’effets secondaires, mais des études ont confirmé que les bêta-mimétiques à longue durée d’action, en particulier, ont un effet positif sur la fonction pulmonaire matinale, les symptômes nocturnes et, par conséquent, sur la qualité du sommeil des patient·es.45 Cependant, leur pharmacocinétique et leur pharmacodynamique sont soumises à des variations circadiennes plus importantes, ce qui nécessite des études plus approfondies pour optimiser leur utilisation dans le cadre d’une chronothérapie.
Pour l’antagoniste des récepteurs des leucotriènes montélukast, il a été démontré qu’une dose unique administrée le soir a davantage un effet positif sur la fonction pulmonaire par rapport à une dose administrée le matin.46 En outre, le ciblage pharmacologique de l’horloge circadienne moléculaire pourrait constituer à l’avenir une option thérapeutique anti-inflammatoire et bronchoprotectrice pour les personnes asthmatiques.
Littérature:
1 Krakowiak K, Durrington HJ: Pulm Ther 2018; 4: 29-43 2 Janson C et al.: Eur Respir J 1996; 9: 2132-8 3 Lewis MJ et al.: Respir Med 2006; 100: 1688-705 4 Kraft M: Eur Respir J 1999; 14: 1403-17 5 Calhoun WJ et al.: Am Rev Respir Dis 1992; 145: 577-81 6 Kraft M et al.: Am J Respir Crit Care Med 1999; 159: 228-34 7 Dimitrov S et al.: Blood 2009; 113: 5134-43 8 Durrington HJ et al.: Am J Respir Crit Care Med 2018; 198: 1578-81 9 Kelly EAB et al.: Clin Exp Allergy 2004; 34: 227-33 10 Tang L et al.: Front Immunol 2022; 13: 947067 11 Sutherland ER et al.: J Allergy Clin Immunol 2003; 112: 513-7 12 Durrington HJ et al.: Am J Respir Crit Care Med 2019; 199: 392-4 13 Turki J et al.: J Clin Invest 1995; 95: 1635-41 14 Teppan J et al.: Front Immunol 2024; 15: 1408772 15 Turner-Warwick M: Am J Med 1988; 85: 6-8 16 Durrington HJ et al.: Thorax 2014; 69: 90-2 17 Spengler CM, Shea SA: Am J Respir Crit Care Med 2000; 162: 1038-46 18 Litinski M et a.: Sleep Med Clin 2009; 4: 143-63 19 Nosal C et al.: Annu Rev Physiol 2020; 82: 391-412 20 Spengler CM et al.: J Physiol 2000; 526: 683-94 21 Pick R et al.: Trends Immunol 2019; 40: 524-37 22 Martin RJ et al.: Am Rev Respir Dis 1991; 143: 351-7 23 Jarjour NN et al.: Am Rev Respir Dis 1992; 146: 905-11 24 Wilkinson M et al.: Eur Respir J 2019; 54: 1901068 25 Wang R et al.: ERJ Open Res 2024; 10: 00916-2023 26 Ueyama T et al.: Nat Neurosci 1999; 2: 1051-3 27 Fagiani F et al.: Signal Transduct Target Ther 2022; 7: 41 28 Zhang R et al.: Proc Natl Acad Sci USA 2014; 111: 16219-24 29 Hu B et al.: QJM 2024; 117: 631-7 30 Maidstone RJ et al.: Thorax 2021; 76: 53-60 31 Loudon AS et al.: Trends Genet 2000; 16: 477-81 32 Teppan J et al.: Molecular circadian clock of eosinophils: A potential therapeutic target for asthma. Manuskript eingereicht zur Publikation 33 Durrington HJ et al.: Eur Respir J 2020: 1902407 34 Roberts J et al.: J Immunol 2023; 211: 626-32 35 Wang R et al.: Nat Commun 2021; 12: 76 36 Jaradat M et al.: Am J Respir Crit Care Med 2006; 174: 1299-309 37 Reinberg A et al.: J Allergy Clin Immunol 1983; 71: 425-33 38 Beam WR et al.: Am Rev Respir Dis 1992; 146: 1524-30 39 Toogood JH et al.: J Allergy Clin Immunol 1982; 70: 288-98 40 Pincus DJ et al.: J Allergy Clin Immunol 1997; 100: 771-4 41 Kemp JP et al.: J Allergy Clin Immunol 2000; 106: 485-92 42 Masoli M et al.: Resp Med 2006; 100: 20-5 43 Gunn SD et al.: C Eur J Clin Pharmacol 1995; 48: 23-8 44 D’Alonzo GE et al.: Chest 1995; 107: 406-12 45 Konermann M et al.: Pneumologie 2000; 54: 104-9 46 Noonan MJ et al.: Eur Respir J 1998; 11: 1232-9
Das könnte Sie auch interessieren:
Traitement de la maladie de Crohn: concepts éprouvés et nouvelles stratégies
Quels sont les objectifs thérapeutiques des médecins qui traitent des patient·es atteint·es de la maladie de Crohn (MC), et ces objectifs coïncident-ils avec ceux des personnes ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...