©
Getty Images/iStockphoto
Komplikationen in der Wirbelsäulenchirurgie: wie vermeiden, wie behandeln?
Leading Opinions
Autor:
Prof. Dr. med. Mazda Farshad
Universitätsklinik Balgrist, Zürich<br> E-Mail: mazda.farshad@balgrist.ch
Autor:
Marco Senteler PhD
Autor:
Dr. José Miguel Spirig
30
Min. Lesezeit
23.11.2017
Weiterempfehlen
<p class="article-intro">Im Folgenden soll vor allem auf Details während der Operation, welche zur Vermeidung von Komplikationen beitragen, sowie auf die Behandlung dieser Komplikationen eingegangen werden. Wir fokussieren uns dabei auf die häufigsten Krankheitsbilder, nämlich lumbale Diskushernien und Spinalkanalstenosen sowie lumbale Segmentdegenerationen. Anschliessend werden unsere neusten Forschungsansätze zur Prävention von Sekundärpathologien präsentiert.</p>
<p class="article-content"><div id="keypoints"> <h2>Keypoints</h2> <ul> <li>Einige Komplikationen und Revisionsoperationen können durch sorgfältige Indikationsstellung und technische Ausführung während der Operation vermieden werden.</li> <li>Komplikationen müssen früh erkannt und fachgerecht behandelt werden.</li> <li>Neuste Forschungsansätze zielen darauf ab, patientenspezifische Konfigurationen von Anatomie, Pathologie und Kinematik in einem digitalen Modell miteinzuberechnen und damit Prognosen für den funktionellen Ausgang verschiedener Operationsmethoden zu machen.</li> </ul> </div> <p>Allem voran ist die richtige Indikationsstellung der wichtigste Parameter für einen Therapieerfolg. Zudem können bereits kleinste Fehler in der chirurgischen Technik Komplikationen und Revisionsoperationen verursachen. Unabhängig davon können – trotz richtig gestellter Indikation und technisch korrekt durchgeführter Operation – verschiedene biologische und biomechanische Ursachen dazu beitragen, dass eine Revisionsoperation nötig wird. Um dem entgegenzuwirken, müssen Operationen unter Kenntnis der Anatomie, Pathologie, Biologie und biomechanischen Situation der Wirbelsäule des Patienten sowie der eingriffsassoziierten potenziellen Komplikationen genau geplant und mit Augenmerk aufs Detail durchgeführt werden.</p> <h2>Technische Details während der Operation</h2> <p><strong>Lumbale Diskushernienoperation</strong><br /> Bereits beim Zugang zur Wirbelsäule können Fehler auftreten. So geben 68 % der Wirbelsäulenchirurgen zu, in ihrer Karriere mindestens einmal das falsche Level operiert zu haben.1 Die wichtigste Vermeidungsmassnahme ist die intraoperative fluoroskopische Levelbestimmung, insbesondere nach der Exposition der Wirbelsäule. Ein konsequentes präoperatives «timeout » mit Erwähnung der zu operierenden Seite ermöglicht den Miteinbezug aller an der Operation beteiligten Personen sowie eine Rekapitulation des Operationsplans für den Operateur.<sup>1</sup> Eine möglichst sparsame Laminotomie sowie die Schonung der Facettengelenke vermindern die Gefahr einer postoperativen Segmentinstabilität. Vorsichtige Manipulation der neuralen Strukturen verhindert ein «Battered root»- Syndrom und somit eine postoperative Neuropathie oder eine Duraläsion mit Liquorverlustsyndrom. Die vollständige Sequestrektomie sowie Inspektion des Anulus fibrosus und falls nötig die Entfernung freier Nukleusanteile sorgen für die sichere Dekompression der Nervenwurzel und vermindern das Risiko einer Reherniation. Durch eine zu aggressive Diskektomie können rezidivierende Rückenschmerzen ausgelöst werden, weshalb eine solche möglichst vermieden werden sollte.<sup>1</sup></p> <p><strong>Lumbale Dekompressionsoperation bei Spinalkanalstenosen</strong><br /> Die Laminotomie ist sparsam durchzuführen, eine Laminektomie ist sehr selten nötig. Auch postoperative epidurale Hämatome können durch geringere Knochenresektion tendenziell reduziert werden.<sup>2</sup> Die Rezessotomie sollte nicht 90° zur koronaren Ebene, sondern steiler erfolgen (mit Unterschneiden), um nach Möglichkeit ossäre Strukturen zu sparen und die Facettengelenke zu schonen. Die abgehenden Nervenwurzeln sind darzustellen und die Flavektomie muss vollständig sein, um Reststenosen zu vermeiden. Bei einseitig betonter Claudicatio-Symptomatik kann die Mittellinie (Processi spinosi und Lig. interspinosum) belassen und «over the top» mikrochirurgisch dekomprimiert werden. Die sorgfältige Blutstillung und Einlage einer Redondrainage verringern ebenfalls das Risiko eines postoperativen Hämatoms, das aufgrund des fehlenden Schutzes der Mittellinienstrukturen ein gefährliches Caudaequina- Syndrom hervorrufen könnte.</p> <p><strong>Lumbale Spondylodesen</strong><br /> Der chirurgische Zugang muss vorsichtig erfolgen, um eine Verletzung der Anschlusssegmentfacettengelenke und des interspinösen Ligamentes zu vermeiden. Das Setzen von Pedikelschrauben sollte unter genauer Kenntnis der individuellen Anatomie und einer vorgängig genauen Darstellung der anatomischen Landmarken erfolgen. Vor dem definitiven Setzen der Schrauben muss sichergestellt werden, dass der Pedikel nicht perforiert ist und die Schraube nicht rezessal oder gar foraminal zu liegen kommt. Eine fluoroskopische Kontrolle der Schraubenlage gilt aktuell als Goldstandard. Zusätzliche Hilfsmittel wie die CT-gesteuerte Navigation oder das schablonengeführte Schraubensetzen erhöhen zusätzlich die Genauigkeit der Schraubenlagen.<sup>3, 4</sup> Bei ungenügendem Schraubenhalt im osteoporotischen Knochen ist eine Zementaugmentation zu erwägen.<sup>5, 6</sup> Falls ein interkorporeller Cage eingebracht wird, sind vorgängig die Endplatten vollständig zu entknorpeln, um eine nachfolgende Fusion zu ermöglichen. Für die Fusion müssen genügend Autograft und Allograft vorhanden sein. Im Zweifelsfall sollte zusätzlich Beckenkammknochen entnommen werden, um die Fusion zu unterstützen.<sup>7, 8</sup> Die dadurch zusätzlich verursachte Morbidität sollte jedoch berücksichtigt werden.<sup>9</sup></p> <h2>Behandlung von Komplikationen</h2> <p><strong>Infektionen</strong><br /> Postoperative Infektionen sind im Bereich der Wirbelsäule selten (2 % ),<sup>10</sup> jedoch sehr ernst zu nehmen und bedürfen meist einer sofortigen chirurgischen Revision. Vorgängig wird ein MRI mit Kontrastmittel durchgeführt, um eine frühe Spondylodiszitis, welche einer aggressiveren Therapie bedürfte, auszuschliessen. Antibiotika dürfen erst nach chirurgischer Probenentnahme verabreicht werden.</p> <p><strong>Postoperative Hämatome</strong><br /> Hämatome, welche den Duralsack komprimieren, können eine weite Symptomvarianz von asymptomatisch bis zum akuten Cauda-equina-Syndrom erzeugen. Letzteres macht eine notfallmässige Revisionsoperation notwendig.</p> <p><strong>Liquorverlustsyndrom</strong><br /> Ein inzidentelles Verletzen der Dura wird meist intraoperativ bemerkt. Dabei ist wenn möglich ein sorgfältiger intraoperativer Verschluss mit einer Naht anzustreben. Postoperative posturale Kopfschmerzen sind das Kardinalsymptom eines Liquorverlustsyndroms. Eine frühe Mobilisation des Patienten scheint im Vergleich zur bisher empfohlenen Bettruhe keine Nachteile zu haben.<sup>11</sup> Bei Liquorfluss aus der Wunde ist meist die chirurgische Revision notwendig, um die durale Läsion sauber verschliessen zu können (Abb. 1).</p> <p><strong>Reherniation (Rezidiv)</strong><br /> Bei korrekter Durchführung erzielt eine Diskushernienoperation auch im längerfristigen Verlauf von 8 Jahren sehr zuverlässige Resultate.<sup>12</sup> Eine Reherniation bzw. ein Rezidiv kann jedoch in bis zu einem Viertel der Fälle auftreten,<sup>13–15</sup> auch wenn diese nicht immer symptomatisch sein müssen. Die erste symptomatische Rezidivhernie wird mit den gleichen Prinzipien wie eine erstmalige Diskushernie behandelt. Das heisst zunächst konservatives Vorgehen, falls keine neurologischen Ausfälle vorhanden sind, und erst nach dessen Scheitern oder bei primär neurologischer Symptomatik wird die Indikation zur mikrochirurgischen Revision gestellt. Bei nochmaligem Rezidiv wäre, bei dann meist auftretender Segmentdegeneration, die Spondylodese des Segmentes zu besprechen.</p> <p><strong>Postoperatives Residuum der Hernie</strong><br /> Dies bedeutet, dass eine Diskushernie unzureichend entfernt wurde und eine Reoperation nötig ist. Vorher bedarf es einer erneuten MRI-Untersuchung zur Diagnosestellung.</p> <p><strong>Postoperative Segmentinstabilität</strong><br /> Durch zu aggressive Laminotomie kann die Verbindung zwischen der Lamina und der Pars articularis brechen, das Segment wird instabil und es entsteht eine mechanische Lumbalgie; ebenso bei ausgedehnter Rezessotomie mit Wegnahme der Facetten (>50 % ) oder bei unerkannter, bereits präoperativ vorhandener Instabilität. Es folgen eine Listhese oder eine akzelerierte Segmentdegeneration mit oder ohne Kompression der foraminalen Nervenwurzel. Die chirurgische Behandlung ist dann die Spondylodese des Segmentes.</p> <p><strong>Schraubenfehllage nach Spondylodesen</strong><br /> Fehlgelegte Schrauben, welche eine klinische Konsequenz haben (z.B. postoperative Radikulopathie), müssen revidiert und neu gesetzt werden.</p> <p><strong>Pseudoarthrose und Schraubenlockerung nach Spondylodesen</strong><br /> Eine Pseudoarthrose ist nicht immer symptomatisch, v.a. wenn die Instrumentation intakt ist und die Schrauben nicht gelockert sind. Eine Pseudoarthrose mit einer Schraubenlockerung (Abb. 2) erzeugt jedoch häufig eine mechanische Lumbalgie und bedarf einer Revisionsoperation. Je nach Ausmass der Lockerung muss die Spondylodese verlängert werden. Wenn es gelingt, einen guten Schraubenhalt (mit oder ohne Zementaugmentation) in den voroperierten Segmenten zu erreichen, kann mittels zusätzlicher anteriorer Komponente (interkorporeller Cage) und allenfalls biologischer Unterstützung (z.B. Applikation von «bone-marrow protein») eine zuverlässige Fusion erreicht werden.</p> <p><strong>Anschlusssegmentdegeneration und -erkrankung nach Spondylodese</strong><br /> Eine Anschlusssegmenterkrankung wird primär konservativ mittels Infiltrationen und Analgetika zu therapieren versucht. Beim Scheitern der konservativen Therapie und bei Entwicklung von Anschlusssegmentdeformitäten bedarf es häufig einer Verlängerung der Spondylodese und meistens einer Dekompression (Abb. 3). Selten kann es in kyphotischen Segmenten zu einer sogenannten Anschlusssegmentkyphose, meist durch eine Fraktur, kommen. Dann müssen direkt, ohne konservative Therapieversuche, eine chirurgische Aufrichtung und Korrektur der Kyphose sowie eine Verlängerung der Spondylodese nach kranial durchgeführt werden.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2017_Leading Opinions_Ortho_1704_Weblinks_lo_ortho_1704__s11_abb1-3.jpg" alt="" width="1417" height="1830" /></p> <h2>Neuste Forschung und Technologien</h2> <p>Aktuelle Forschungsschwerpunkte liegen auf der Untersuchung biomechanischer und mechanobiologischer Zusammenhänge in Bezug auf postinterventionelle Sekundärpathologien. Mithilfe entsprechender Technologien können die gewonnenen Erkenntnisse in die klinische Entscheidungsfindung einfliessen und somit direkt in einen Patientenvorteil umgesetzt werden.<br /> Eine stärkere Berücksichtigung der Individualität von Anatomie und Pathologie des Patienten scheint unumgänglich, um Risikofaktoren für postoperative Funktionseinschränkungen und Reoperationen zu erkennen und bereits bei der Planung zu berücksichtigen. Insbesondere die Wirbelsäulenanatomie und deren Bewegungscharakteristik (Kinematik) spielen dabei eine zentrale Rolle. Auch bezüglich des Wissens über degenerative Folgeerkrankungen nach Eingriffen, wie zum Beispiel die Anschlusssegmentdegeneration, bestehen noch immer wesentliche Lücken und die Frage nach der Pathogenese bleibt oftmals ungeklärt, obwohl diese für eine erfolgreiche Verhinderung dieser Folgen von zentraler Bedeutung wäre.</p> <p>Experimentell können Eingriffe wie auch Pathologien mittels radiologischer, optischer und mechanischer Methoden charakterisiert werden. So lassen sich beispielsweise Zusammenhänge zwischen dem Grad einer degenerativen Erkrankung und den damit in Verbindung stehenden kinematischen Änderungen quantifizieren. Kontrollierte Experimente mit künstlich induzierten Degenerationen lassen den Vergleich zwischen gesundem und erkranktem Status an ein und derselben Probe zu, sodass der Einfluss der immensen Variabilität von humanen Spezimina etwas abgeschwächt werden kann. Neuste radiologische Methoden erlauben dynamische In-vivo-Untersuchungen der Kinematik der gesamten Wirbelsäule, mit einer bisher unerreichten Genauigkeit und Auflösung. Postoperative Zustände können ebenso charakterisiert werden wie präoperative pathologiebehaftete als auch gesunde Konditionen.<br /> Experimentelle Forschungsmethoden haben jedoch allesamt den Nachteil, dass sie in der klinischen Praxis nicht direkt angewandt werden können. Eine videofluoroskopische Analyse ist aufgrund des zeitlichen wie auch finanziellen Aufwandes als Standard-Assessment heute noch undenkbar. Jedoch liefert sie wertvolle Hinweise, wie mittels statischer radiologischer Untersuchungen in der Klinik wichtige Rückschlüsse auf die Kinematik der Wirbelsäule gezogen werden können. So konnte z.B. kürzlich erkannt werden, dass Inklinations- und Reklinationsröntgenaufnahmen in statischen Extrempositionen wenig Informationsgehalt bezüglich der Kinematik beinhalten. Stattdessen wird nun an optimierten Ansätzen geforscht, um klinische Protokolle zu verbessern, damit deren Aussagekraft bezüglich der Patientenindividualität maximiert werden kann.<br /> Limitationen existieren auch bei biomechanischen In-vitro-Experimenten mit menschlichen Proben. Sie bedingen ausnahmslos die Vernachlässigung von neuromuskulären Aktivitäten und der damit zusammenhängenden aktiven und passiven Kontrolle des Bewegungsapparates. Damit wird auch die propriozeptive Kapazität von Strukturen, wie sie zum Beispiel in Ligamenten und Bandscheiben vermutet wird, gänzlich unterbunden.</p> <p>Um die aus der Forschung gewonnenen Erkenntnisse im klinischen Alltag anzuwenden und in einen individuellen Patientenvorteil umzusetzen, bedarf es also einer alternativen Strategie. Während in den letzten Jahren numerische muskuloskelettale Modelle in der Forschung ihre Nützlichkeit bewiesen haben, setzen wir nun auf deren Anwendung im Behandlungsablauf. Die aus der klinischen, vorwiegend radiologischen Patientenerfassung gewonnenen Daten werden dabei benutzt, um ein detailliertes Computermodell des Patienten zu erstellen. Das digitale Modell bietet den Vorteil, eine beliebige Anzahl von Eingriffsparametern zu simulieren, während dabei die aktive Kontribution von Muskeln nicht vernachlässigt wird. Es erlaubt uns somit, Prognosen über den funktionellen Ausgang verschiedener Operationsmethoden zu machen und dabei mögliche Risikofaktoren eines Eingriffs frühzeitig zu erkennen. Für den Chirurgen, der bereits in der Planung auf dieses Werkzeug zurückgreifen kann, bietet dies eine zusätzliche, für den Patienten massgeschneiderte Entscheidungsgrundlage zur Festlegung der optimalen Behandlungsstrategie. Dabei werden nicht nur statische anatomische Gegebenheiten, sondern vor allem auch das kinematische Verhalten und die damit zusammenhängende muskuläre Kraftentwicklung in die Entscheidung miteinbezogen (Abb. 4). Wir sind der Überzeugung, dass eine solche individuelle biomechanische Analyse der patientenspezifischen Konfiguration von Anatomie, Pathologie und Kinematik in der Zukunft zu überlegenen orthopädischen Lösungsansätzen führen wird.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2017_Leading Opinions_Ortho_1704_Weblinks_lo_ortho_1704__s12_abb4.jpg" alt="" width="1417" height="1027" /></p></p>
<p class="article-footer">
<a class="literatur" data-toggle="collapse" href="#collapseLiteratur" aria-expanded="false" aria-controls="collapseLiteratur" >Literatur</a>
<div class="collapse" id="collapseLiteratur">
<p><strong>1</strong> Mayer JE et al: Spine J 2014; 14(5): 741-48 <strong>2</strong> Leonardi MA et al: J Spinal Disord Tech 2013; 26(8): 407-14 <strong>3</strong> Farshad M et al: Eur Spine J 2017; 26(3): 738-49 <strong>4</strong> Meng X et al: Neurosurg Rev 2016; 39(3): 385-91 <strong>5</strong> El Saman A et al: Eur J Trauma Emerg Surg 2013; 39(5): 455-60 <strong>6</strong> Sawakami K et al: J Spinal Disord Tech 2012; 25(2): E28-35 <strong>7</strong> Flouzat-Lachaniette C-H et al: Int Orthop 2014; 38(9): 2001-7 <strong>8</strong> Ito Z et al: Eur Spine J 2013; 22(5): 1158-63 <strong>9</strong> Banwart JC et al: Spine 1995; 20(9): 1055-60 <strong>10</strong> Filiz M et al: Clin Rehabil 2005; 19(1): 4-11 <strong>11</strong> Farshad M et al.: SGS Annual Meeting 2017, Nottwil (Switzerland), oral presentation FM86 <strong>12</strong> Lurie JD et al: Spine 2014; 39(1): 3-16 <strong>13</strong> Aichmair A et al: Evid Based Spine Care J 2014; 5(2): 77-86 <strong>14</strong> Keskimäki I et al: Spine 2000; 25(12): 1500-8 <strong>15</strong> Law JD et al: J Neurosurg 1978; 48(2): 259-63</p>
</div>
</p>
Das könnte Sie auch interessieren:
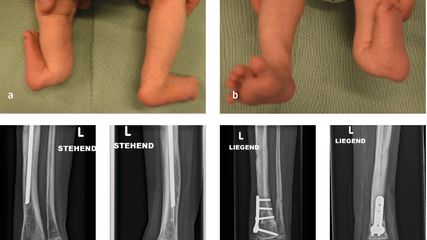
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
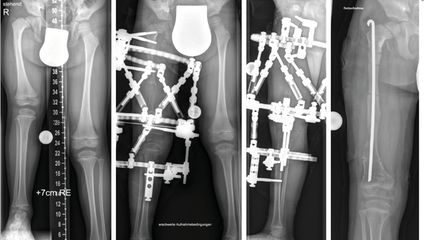
Korrektur assoziierter Gelenkspathologien beim kongenitalen Femurdefekt
Der kongenitale Femurdefekt ist eine der spannendsten und komplexesten angeborenen Fehlbildungen in der Kinderorthopädie und in der klinischen Präsentation sehr vielgestaltig. Während ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...