Die Bedeutung der endoprothesenerhaltenden septischen Gelenkrevision
Autoren:
Dr. med. Petri Bellova
PD Dr. med. Maik Stiehler, PhD
UniversitätsCentrum für Orthopädie, Unfall- & Plastische Chirurgie,
Universitätsklinikum Carl Gustav Carus an der Technischen Universität Dresden
KorrespondierenderAutor:
Dr. med. Petri Bellova
Die periprothetische Infektion (PPI) ist eine der gefürchtetsten Komplikationen in der Endoprothetik und kann weitreichende Folgen für diedavon betroffenen Patienten haben. Für die akute PPI steht die endoprothesenerhaltende Gelenkrevision als vielversprechende, weniger invasive Behandlungsoption zur Verfügung. Im Folgenden wirddieses Therapiekonzept anhand einer Literaturübersicht sowie eigener Erfahrungen behandelt.
Keypoints
-
Die endoprothesenerhaltende septische Gelenkrevision (DAIR) ist – korrekte Indikationsstellung und Durchführung vorausgesetzt – eine Erfolg versprechende Möglichkeit zur Therapie der akuten periprothetischen Infektion.
-
Aufgrund des besseren Outcomes bei kurzer Symptomdauer ist die Indikation zum DAIR zügig zu stellen.
-
Neben der kurzen Symptomdauer sind die frühe postoperative Infektion, der Wechsel der mobilen Endoprothesenkomponenten, das Vorliegen einer primärimplantierten Endoprothese sowie ein gesunder Host wichtige Erfolgsprädiktoren.
-
Die antibiotische Therapie sollte eine Gesamttherapiedauer von mindestens 12 Wochen umfassen und nach Möglichkeit ein biofilmaktives Antibiotikum (Rifampicin, Fluorchinolone) beinhalten.
Hintergrund
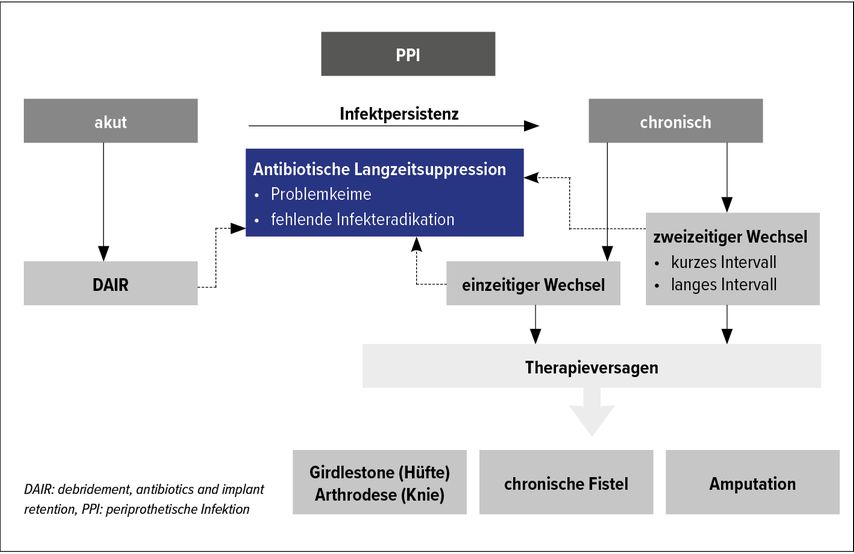
Die PPI kann unbehandelt für Patienten desaströse Folgen haben – Schmerzen, eingeschränkte Funktion, Sepsis und Multiorganversagen bis hin zum Tod sind möglich. Auch die Behandlung kann sich als langwierig und komplex erweisen – neben der endoprothesenerhaltenden offenen Gelenkrevision mit Austausch der mobilen Endoprothesenkomponenten (engl. «debridement, antibiotics and implant retention», DAIR) sowie der ein- und mehrzeitigen Endoprothesenwechsel-OP stehen die suppressive antibiotische Therapie, der ersatzlose Endoprothesenausbau, die Anlage einer kontrollierten permanenten Fistel, die Arthrodese und die Amputation als Rückzugsoptionen zur Verfügung (Abb. 1).
Im Rahmen der Behandlung der chronischen PPI ist der Wechsel des einliegenden Kunstgelenks die Regel. Das international am weitesten verbreitete Konzept zum mehrzeitigen Endoprothesenwechsel umfasst die Endoprothesenexplantation, das Débridement von infiziertem periprothetischem Gewebe sowie die verzögerte Endoprothesenreimplantation nach einem endoprothesenfreien Intervall, während dessen eine antibiotische Therapie erfolgt. Da das Konzept des mehrzeitigen Wechsels mindestens zwei grössere operative Eingriffe erfordert, ist es nicht selten mit prolongierter Hospitalisierung, einem signifikanten Funktionsverlust sowie einer erhöhten Morbidität vergesellschaftet.1 Demgegenüber steht der für den Patienten attraktivere einzeitige Endoprothesenwechsel, der von einigen spezialisierten Endoprothetikzentren routinemässig ausgeführt wird.2,3 Allerdings ist dieser nur in ausgewählten Situationen mit strenger Indikationsstellung (intakter Weichteilstatus, präoperativ bekannter, oral antibiotisch therapierbarer Erreger) eine sinnvolle Therapieoption.
Für einige Konstellationen, die im Folgenden erläutert werden, kommt wiederum DAIR als endoprothesenerhaltendes Therapiekonzept infrage.
«Debridement, antibiotics and implant retention» (DAIR)
Streng genommen gibt es keine absoluten Kontraindikationen für DAIR. Allerdings sind die Erfolgschancen bei einer chronischen Infektion mit reifem Biofilm und den damit assoziierten bakteriellen sogenannten Persister-Zellen sehr gering, sodass in diesem Fall der Wechsel der einliegenden Endoprothese indiziert ist.4
DAIR kommt demnach bei der akuten PPI infrage und ist eine weniger invasive chirurgische Behandlungsmöglichkeit. In einer Metaanalyse von Kunutsor et al. 2018 zeigte sich kumulativ bei 93 eingeschlossenen Studien eine DAIR-Gesamterfolgsrate von etwa 60%.5 Aufgrund der unterschiedlichen Grundvoraussetzungen und Studienbedingungen sind die einzelnen Studien allerdings differenziert zu betrachten.
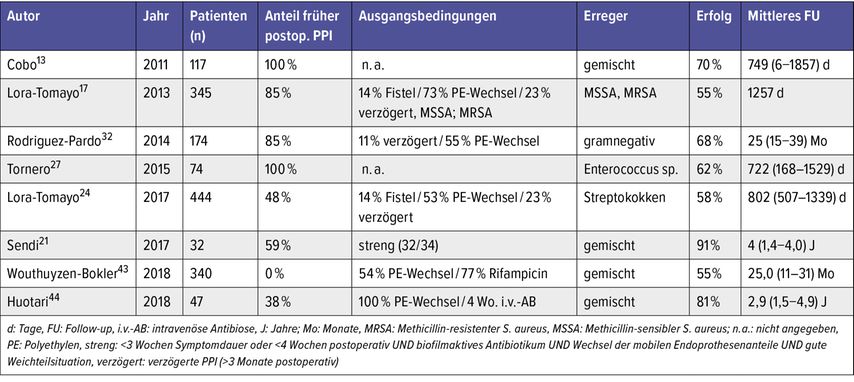
Eine Auswahl an Einzelstudien zeigt höhere Erfolgsraten, gerade in Situationen mit strikten Einschlusskriterien (Tab. 1). Entsprechende Prädiktoren für Erfolg und Versagen werden im Folgenden erläutert.
Tab. 1: Literaturübersicht über ausgewählte DAIR-Studien und deren Erfolgsraten (Infektfreiheit nach entsprechendem Follow-up)
Die akute PPI kann sich als frühe postoperative oder auch als akute hämatogene Infektion darstellen.6 Leider ist die wissenschaftliche Evidenzlage hinsichtlich einer exakten zeitlichen Grenze, ab der DAIR nicht mehr durchgeführt werden sollte, insuffizient. Allerdings sind eine Symptomdauer von weniger als einer Woche7–9 und eine Implantatverweildauer von weniger als 15 Tagen10 mit einer höheren Erfolgsrate assoziiert. Es wird daher empfohlen, bei der PPI-Therapie mittels DAIR eine Symptomdauer von 3 Wochen und eine Implantatverweildauer von mehr als 4 Wochen nicht zu überschreiten.11
Bei frühen postoperativen Infektionen zeigen sich im Vergleich zu akuten hämatogenen Infektionen höhere Erfolgsraten für DAIR.7,12,13 Whouthuyzen-Bakker et al. konnten in einer Multicenter-Studie bei akuten Spätinfektionen ausserdem eine höhere Versagensrate für DAIR (45%) im Vergleich zu einem kompletten Wechsel (24%) nachweisen.14 Eine mögliche Erklärung für diesen Umstand ist häufig die fälschliche Annahme einer akuten hämatogenen Infektion, während bereits ein reifer Biofilm vorliegt. Somit ist eine genaue Anamnese zur Identifikation des tatsächlichen Symptombeginns und der möglichen Infektionsquelle bei der Indikationsstellung essenziell.
Ein weiterer wichtiger Prädiktor für ein DAIR-Versagen ist ein Unterlassen des Austauschs aller mobilen Endoprothesenkomponenten.15 Eine Metaanalyse zeigte ein signifikant besseres Outcome nach DAIR mit Wechsel der mobilen Teile (73,9%) im Vergleich zur alleinigen Gelenkrevison (60,7%).16In einer systematischen Übersichtsarbeit konnte gezeigt werden, dass durch den Wechsel der mobilen Teile die Versagensrate bei Staphylokokken-assoziierten Infektionen um 33% verringert wurde.17 Hintergrund ist einerseits eine möglicherweise erhöhte bakterielle Last des Polyethylens verglichen mit den metallischen Prothesenbestandteilen,18 andererseits erlaubt die temporäre Entfernung der mobilen Teile während der OP einen besseren Zugang zur Gelenkkapsel und dadurch ein gründlicheres Débridement.
Neben einer kurzen Symtomdauer und dem Wechsel der mobilen Teile sind eine fest sitzende Endoprothese, eine gute Weichteilsituation sowie ein immunkompetenter Patient Voraussetzungen für eine erfolgreiche chirurgische Therapie mittels DAIR.1,11
Es sind zwei Scores etabliert worden, die die Versagenswahrscheinlich von DAIR präoperativ einschätzen sollen – der KLIC-Score für frühe postoperative sowie der CRIME80-Score für akute hämatogene PPI.19 Neben Host-Faktoren, wie Leber- und Niereninsuffizienz, COPD, rheumatoider Arthritis, Patientenalter und -geschlecht, beeinflussen die Art der Index-OP (elektive vs. Fraktur-/Revisionsendoprothese) und der präoperative CRP-Wert (Grenzwert: 115mg/l) die Versagensrate. Sowohl Frakturendoprothesen als auch Revisionsendoprothesenimplantationen sind mit einer höheren DAIR-Versagensrate assoziiert als elektive Primäreingriffe.9,20
Weiterhin ist die Lernkurve der Operateure entscheidend für den Erfolg – ein durch spezialisierte Endoprothetiker durchgeführtes DAIR weist eine bis zu 3-mal höhere Erfolgsrate auf.21
Ein wesentlicher Vorteil von DAIR gegenüber allen anderen Therapieoptionen der PPI ist in der Regel ein Funktionserhalt für den Patienten. In einer Studie von Barros et al. zeigte sich kein Unterschied im funktionellen Outcome bei Patienten, die nach elektiver Endoprothesenimplantation keine Komplikation erlitten, und jenen, die zwischenzeitlich einem DAIR unterzogen wurden.22
Insgesamt herrscht wenig Konsens über den Zusammenhang zwischen Erregerart und DAIR-Outcome. Während die Identifikation des Erregers für die konsekutive antibiotische Therapie wichtig ist, sollten Bemühungen um die Erregersicherung die operative Intervention nicht unnötig verzögern. Grundsätzlich ist der Nachweis eines Erregers, der einem Antibiotikum mit Biofilmaktivität bzw. mit Bakterizidität zugänglich ist, prognostisch günstig. Alle Erreger, die diese Kriterien nicht erfüllen, werden als «Difficult to treat»-(DTT)-Erreger bezeichnet.23 Zu diesen gehören Rifampicin-resistente Staphylokokken, Chinolon-resistente gramnegative Erreger sowie Pilze. Auch Streptokokken werden mit ungünstigen Outcomes assoziiert.24 Mahieu et al. konnten trotz frühzeitiger Revision innerhalb von 3–8 Tagen eine Infektpersistenz von 51% nach DAIR bei Streptokokken-assoziierten PPI nachweisen.25 Dabei zeigte sich S. agalactiae als unabhängiger Risikofaktor. Allerdings beobachteten Löwik et al. in einer Multicenter-Studie, dass auch S.-aureus-PPI mit einer 17% höheren DAIR-Versagensrate, verglichen mit PPI-Fällen mit anderen Erregern, assoziiert waren. Dabei zeigte sich insbesondere für akute hämatogene Infektionen ein schlechtes Ergebnis.19,26 Als weiterhin problematisch werden Enterokokken-assoziierte Infektionen angesehen, hier insbesondere solche durch E. faecium.26,27
Bei der akuten PPI ist der Erreger zunächst oft unbekannt, sodass postoperativ eine kalkulierte antibiotische Therapie gestartet wird. Die Anpassung sollte daraufhin resistogrammgerecht erfolgen. Wichtige Therapieprinzipien sind dabei eine prolongierte Therapiedauer sowie die Verwendung eines biofilmaktiven Antibiotikums. Die Dauer der Therapie war lange Zeit umstritten, allerdings zeigte sich in einer jüngst erschienenen randomisiert kontrollierten Studie ein ungünstiges Ergebnis für jene Patientengruppe, die eine 6-wöchige antibiotische Therapie erhielt, verglichen mit jener, die eine 12-wöchige erhielt.28 Seitdem Zimmerli et al. 1998 durch den Zusatz von Rifampicin bei der Behandlung von PPI eine deutliche Outcome-Verbesserung zeigen konnten,29 hat sich diese Substanz bei Staphylokokken-assoziierten PPI etabliert. Unter anderem zeigte sich in einer prospektiven Studie durch Hinzugabe von Rifampicin eine Erfolgszunahme von 40%.30 Die effektivsten Kombinationspartner für Rifampicin sind Fluorchinolone.31 Rifampicin sollte jedoch aufgrund möglicher Resistenzentwicklungen nicht als Monotherapeutikum verwendet werden. Auch gegenüber gramnegativen Erregern zeigen Fluorchinolone, hier insbesondere Ciprofloxacin, die beste Effektivität. In einer spanischen Multicenter-Studie konnte der Therapieerfolg bei PPI-Patienten, die Ciprofloxacin erhielten, von 68% auf 79% gesteigert werden.32 Andere Autoren weisen allerdings darauf hin, dass hoch dosierte Betalaktamantibiotika, die intravenös verabreicht werden, eine ähnliche Effektivität haben.33 Bei DTT-Erregern sowie bei Streptokokken ist in einigen Fällen unter Umständen eine antibiotische Suppressionstherapie über mindestens 1 Jahr zu erwägen.34
Ob das Fehlschlagen von DAIR den Erfolg eines folgenden (ein- oder mehrzeitigen) Wechsels beeinträchtigt, wird kontrovers diskutiert. Sherrel et al. fanden eine höhere Versagensrate für den zweizeitigen Wechsel nach fehlgeschlagenem DAIR im Vergleich zum elektiven zweizeitigen Wechsel,35 während andere Studien diese These widerlegten.36–38 In Letzteren zeigte sich auch die Funktion bei Patienten mit vorausgegangenem DAIR nicht beeinträchtigt. Bezüglich der Durchführung eines wiederholten DAIR bei einmaligem Fehlschlagen ist die Evidenzlage in der Literatur limitiert. In einer Multicenter-Studie von Urish et al. zeigte sich bei Patienten, die wiederholt einem DAIR unterzogen wurden, eine Erfolgsrate von lediglich 28,4%.8 In einer weiteren Studie führte das wiederholte DAIR bei keinem der 24 eingeschlossenen Patienten zur Infekteradikation.39 Zusammenfassend ist festzuhalten, dass nach einem fehlgeschlagenem DAIR der Wechsel der Prothese avisiert werden sollte.
Für die Praxis
In der Diagnosesicherung der frühen postoperativen PPI ist das klinische Erscheinungsbild das primäre Entscheidungskriterium bei der Indikationsstellung zur Operation. In dieser Phase sind weder die laborchemischen noch die synovialen Marker sensitiv. Eine prolongierte Wundsekretion ist daher ein ausreichendes Kriterium für die Indikationsstellung. Bei der akuten hämatogenen Infektion hingegen sichert neben der Klinik die synoviale Leukozytenzahl die Diagnose. Zellzahlen über 3000 Zellen/µl sowie >80% Granulozyten sind dabei nach der aktuellen EBJIS-Klassifikation beweisend.40 Intraoperativ sind nach den aktuellen Empfehlungen mindestens 5 mikrobiologische und 5 histologische Proben mit separaten Instrumentarien zu entnehmen. Falls verfügbar, sollten die mobilen Endoprothesenkomponenten zur Sonikation eingeschickt werden, die eine höhere Sensitivität verglichen mit konventionellen Gewebeproben aufweist.41 Der Nachweis eines identischen Mikroorganismus in 2 verschiedenen Gewebeproben, mehr als 50 koloniebildende Einheiten im Sonikationsüberstand bzw. der Nachweis von mehr als 5 Granulozyten in 5 Mikroskopiefeldern (400x, high power field) sind beweisend für die Infektion.
Das chirurgische Ziel von DAIR ist die mechanische Reduktion der bakteriellen Last. Nekrotisches Gewebe ist grosszügig zu resezieren. Dies beinhaltet in der Regel auch eine vollständige Synovektomie. Um diese Voraussetzungen zu erfüllen, sollte DAIR immer als offene OP durchgeführt werden, da ein arthroskopisches Vorgehen in der Regel kein umfassendes Débridement erlaubt. In einer kürzlich erschienenen Studie zeigte sich das offene Vorgehen auch hinsichtlich des Outcomes als überlegen.42
Der Wechsel der mobilen Endoprothesenkomponenten umfasst beim Hüftgelenk den Wechsel von Aufsteckkopf und PE-Einsatz sowie beim Knie den Wechsel des PE-Einsatzes. Bezüglich der Menge der eingesetzten Spülflüssigkeit durch Jet-Lavage zeigt sich in der Literatur keine eindeutige Evidenz. In den entsprechenden Studien, in denen dieser Parameter mituntersucht wurde, wurden typischerweise Mengen von 6–9l verwendet, sodass dies als allgemeine Empfehlung aufgefasst werden kann. Weiterhin kann eine 5- bis 10-minütige Instillation mit einem Antiseptikum, wie beispielsweise Betaiodlösung oder Natriumhypochlorit, erfolgen. Vor dem Einsatz der neuen mobilen Teile sollten ein Handschuhwechsel sowie eine erneute Abdeckung des Operationsfeldes zur weiteren Reduktion der Erregerlast erfolgen.
Die Entscheidung über die anschliessende antibiotische Therapie sollte stets in Konsultation mit Klinischen Infektiologen getroffen werden. Patienten sollten nach Entlassung engmaschig nachuntersucht werden. Bei Fehlschlagen von DAIR ist die Indikation für einen Wechsel der Endoprothese grosszügig zu stellen.
Literatur:
1 Zimmerli W et al.: Prosthetic-joint infections. N Engl J Med 2004; 351: 1645-54 2 Nguyen M et al.: One-stage exchange arthroplasty for periprosthetic Hip and knee joint infections. Open Orthop J 2016; 10: 646-53 3 Rowan FE et al.:The role of one-stage exchange for prosthetic joint infection. Curr Rev Musculoskelet Med 2018; 11: 370-79 4 Lebeaux D et al.: Biofilm-related infections: bridging the gap between clinical management and fundamental aspects of recalcitrance toward antibiotics. Microbiol Mol Biol Rev 2014; 78: 510-43 5 Kunutsor SK et al.: Debridement, antibiotics and implant retention for periprosthetic joint infections: a systematic review and meta-analysis of treatment outcomes. J Infect 2018; 77: 479-88 6 Tsukayama DT et al.: Infection after total hip arthroplasty. A study of the treatment of one hundred and six infections. J Bone Joint Surg Am 1996; 78: 512-23 7 Kuiper JWP et al.: Prosthetic joint-associated infections treated with DAIR (debridement, antibiotics, irrigation, and retention): analysis of risk factors and local antibiotic carriers in 91 patients. Acta Orthop 2013; 84: 380-6 8 Urish KL et al.: A multicenter study of irrigation and debridement in total knee arthroplasty periprosthetic joint infection: treatment failure is high. J Arthroplasty 2018; 33: 1154-9 9 Byren I et al.: One hundred and twelve infected arthroplasties treated with ‚DAIR‘ (debridement, antibiotics and implant retention): antibiotic duration and outcome. J Antimicrob Chemother 2009; 63: 1264-71 10 Tornero E et al.: Risk factors for failure in early prosthetic joint infection treated with debridement. Influence of etiology and antibiotic treatment. J Appl Biomater Funct Mater 2014; 12: 129-34 11 Osmon DR et al.: Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2013; 56: e1-25 12 Iza K et al.: DAIR (debridement, antibiotics and implant retention) less effective in hematogenous total knee arthroplasty infections. J Orthop Surg Res 2019; 14: 278 13 Cobo J et al.: Early prosthetic joint infection: outcomes with debridement and implant retention followed by antibiotic therapy. Clin Microbiol Infect 2011; 17: 1632-7 14 Wouthuyzen-Bakker M et al.: Timing of implant-removal in late acute periprosthetic joint infection: a multicenter observational study. J Infect 2019; 79: 199-205 15 Uriarte I et al.: Debridement, antibiotics and implant retention for early periprosthetic infections of the hip: outcomes and influencing factors. Hip Pelvis 2019; 3: 158-65 16 Tsang STJ et al.: Outcomes following debridement, antibiotics and implant retention in the management of periprosthetic infections of the hip: a review of cohort studies. Bone Joint J 2017; 99-B: 1458-66 17 Lora-Tamayo J et al.: A large multicenter study of methicillin-susceptible and methicillin-resistant Staphylococcus aureus prosthetic joint infections managed with implant retention. Clin Infect Dis 2013; 56: 182-94 18 Lass R et al.: Bacterial adherence to different components of total hip prosthesis in patients with prosthetic joint infection. Int Orthop 2014; 38: 1597-602 19 Löwik CAM et al.: Predicting failure in early acute prosthetic joint infection treated with debridement, antibiotics, and implant retention: external validation of the KLIC Score. J Arthroplasty 2018; 33: 2582-7 20 Tornero E et al.: KLIC-score for predicting early failure in prosthetic joint infections treated with debridement, implant retention and antibiotics. Clin Microbiol Infect 2015; 21: 786.e9-17 21 Sendi P et al.: Debridement and implant retention in the management of hip periprosthetic joint infection: outcomes following guided and rapid treatment at a single centre. Bone Joint J 2017; 99-B: 330-6 22 Barros LH et al.: Early debridement, antibiotics and implant retention (DAIR) in patients with suspected acute infection after hip or knee arthroplasty - safe, effective and without negative functional impact. J Bone Jt Infect 2019; 4: 300-5 23 Akgün D et al.: Outcome of hip and knee periprosthetic joint infections caused by pathogens resistant to biofilm-active antibiotics: results from a prospective cohort study. Arch Orthop Trauma Surg 2018; 138: 635-42 24 Lora-Tamayo J et al.: The not-so-good prognosis of streptococcal periprosthetic joint infection managed by implant retention: the results of a large multicenter study. Clin Infect Dis 2017; 64: 1742-52 25 Mahieu R et al.: The prognosis of streptococcal prosthetic bone and joint infections depends on surgical management – a multicenter retrospective study. Int J Infect Dis 2019; 85: 175-81 26 Soriano A et al.: Treatment of acute post-surgical infection of joint arthroplasty. Clin Microbiol Infect 2006; 12: 930-3 27 Tornero E, Soriano A: Prosthetic joint infection due to Enterococcus sp treated with debridement, antibiotics and retention of the implant (DAIR). Clin Microbiol Infect 2015; 21: e43-4 28 Bernard L et al.: Antibiotic therapy for 6 or 12 Weeks for prosthetic joint infection. N Engl J Med 2021; 384: 1991-2001 29 Zimmerli W et al.: Role of rifampin for treatment of orthopedic implant-related staphylococcal infections: a randomized controlled trial. JAMA 1998; 279: 1537-41 30 Holmberg A et al.: 75% success rate after open debridement, exchange of tibial insert, and antibiotics in knee prosthetic joint infections. Acta Orthop 2015; 86: 457-62 31 Tornero E et al.: Importance of selection and duration of antibiotic regimen in prosthetic joint infections treated with debridement and implant retention. J Antimicrob Chemother 2016; 71: 1395-401 32 Rodríguez-Pardo D et al.: Gram-negative prosthetic joint infection: outcome of a debridement, antibiotics and implant retention approach. A large multicentre study. Clin Microbiol Infect 2014; 20: O911-9 33 Grossi O et al.: Gram-negative prosthetic joint infections managed according to a multidisciplinary standardized approach: risk factors for failure and outcome with and without fluoroquinolones. J Antimicrob Chemother 2016; 71: 2593-7 34 Renz N et al.: Long-term antimicrobial suppression prevents treatment failure of streptococcal periprosthetic joint infection. J Infect 2019; 79: 236-44 35 Sherrell JC et al.: The Chitranjan Ranawat Award: fate of two-stage reimplantation after failed irrigation and débridement for periprosthetic knee infection. Clin Orthop Relat Res 2011; 469: 18-25 36 Nodzo SR et al.: The influence of a failed irrigation and debridement on the outcomes of a subsequent 2-stage revision knee arthroplasty. J Arthroplasty 2017; 32: 2508-12 37 Brimmo O et al.: Irrigation and debridement before a 2-stage revision total knee arthroplasty does not increase risk of failure. J Arthroplasty 2016; 31: 461-4 38 Kim K et al.: Failed debridement and implant retention does not compromise the success of subsequent staged revision in infected total knee arthroplasty. J Arthroplasty 2019; 34: 1214-20 39 Lizaur-Utrilla A et al.: Debridement with prosthesis retention and antibiotherapy vs. two-stage revision for periprosthetic knee infection within 3 months after arthroplasty: a case-control study. Clin Microbiol Infect 2015; 21: 851(e11-7) 40 McNally M et al.: The EBJIS definition of periprosthetic joint infection. Bone Joint J 2021; 103-B: 18-25 41 Trampuz A et al.: Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med 2007; 16; 357: 654-63 42 Johns BP et al.: Open debridement is superior to arthroscopic debridement for the infected total knee arthroplasty. J Arthroplasty 2020; 35: 3716-23 43 Wouthuyzen-Bakker M et al.: Clinical outcome and risk factors for failure in late acute prosthetic joint infections treated with debridement and implant retention. J Infect 2019; 78: 40-7 44 Huotari K et al.: High cure rate for acute streptococcal prosthetic joint infections treated with debridement, antimicrobials, and implant retention in a specialized tertiary care center. Clin Infect Dis 2018; 67: 1288-90
Das könnte Sie auch interessieren:
Neueste Entwicklungen der spinalen EndoskopieNachhaltige keramische Knochenimplantate bald aus dem 3D-Drucker
Die endoskopische Wirbelsäulenchirurgie hat sich von einer rein perkutanen Technik zu einer hochpräzisen, technisch ausgereiften Methode entwickelt, die ein weites Spektrum degenerativer ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...