Biologische Regeneration bei Früharthrose
Autorin:
Dr. Martina Hauser-Schinhan
Universitätsklinik für Orthopädie und Unfallchirurgie
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Wie Knorpeldefekte zu Arthrose führen und welche Möglichkeiten zur biologischen Regeneration bei Früharthrose bestehen.
Arthrose ist die häufigste Gelenkserkrankung in der westlichen Welt.1 Sie ist gekennzeichnet durch degenerative Chondropathie, subchondrale Sklerose und osteophytäre Anbauten. Eine Arthrose betrifft im Unterschied zu fokalen Knorpelzelldefekten das gesamte Gelenk.
Als kurative Behandlung verbleibt momentan nur der Gelenksersatz durch ein künstliches Gelenk. Dies bringt jedoch gewisse Operationsrisiken mit sich und der endoprothetische Ersatz hat nur eine begrenzte Haltbarkeit, vor allem bei jungen Patienten, die intensiv Sport betreiben. Die Ansprüche bezüglich Regeneration, welche zunehmend auch von älteren Patienten aufgrund ihrer erhöhten Aktivität gestellt werden, können oft nicht mit einem künstlichen Gelenk gedeckt werden.
Knorpelregeneration bei lokalisierten Knorpeldefekten ohne Arthrose unter Anwendung von verschiedenen Methoden je nach Defektgröße ist bereits in breiter klinischer Anwendung. Die autologe Chondrozytentransplantation wurde bereits 1994 durch Brittberg et al. beschrieben.2 Eine Weiterentwicklung davon ist die MACT („matrix-assisted autologous chondrocyte transplantation“), bei der Chondrozyten auf einer Trägermatrix in den Knorpeldefekt eingebracht werden.
Insgesamt zeigen sich bei der autologen Knorpelzelltransplantation sehr gute Langzeitergebnisse.3–6 Aufgrund der jedoch schlechten Ergebnisse bei arthrotischen Gelenksverhältnissen7–10 konnte für die Patientengruppe der Früharthrose bis jetzt nur eine abwartende und symptommodellierende Strategie eingeschlagen werden. Gerade jedoch diese Patienten drängen nach biologischen Regenerationsmöglichkeiten. Um eine Lösung für diese Patientengruppe zu finden, wurde unsere Großtierstudie gestartet.
Zuerst galt es, eine unikompartimentelle Arthrose am stabilen Gelenk zu induzieren, denn bisherige Modelle, wie die Durchtrennung des vorderen Kreuzbandes, die Resektion das Meniskus oder die Injektion von toxischen Stoffen (Iodacetat oder Quinolone), brachten entweder instabile oder komplett destruierte Gelenke, welche zur Studie für regenerative Operationen gänzlich ungeeignet schienen. Zur Generierung eines Arthrosemodells wurden 16 österreichische Bergschafe operiert. Die Induktion von unikompartimenteller Arthrose am stabilen Gelenk gelang uns durch einen Knorpeldefekt in der lasttragenden Zone am medialen femoralen Kondyl.11 Bei der Defektsetzung wurde der Knorpel innerhalb des standardisierten Zylinders komplett abgetragen, bis nur noch die kalzifizierte Knorpelschicht erhalten war. Danach durften die Tiere voll belasten.
Es wurden 4 verschiedene Gruppen mit jeweils unterschiedlich großem Knorpeldefekt (7 und 14mm) und unterschiedlicher Nachuntersuchungszeit (6 und 12 Wochen) gewählt. Nach 6 Wochen zeigte sich nur geringe Arthrose mit beiden Defektgrößen, nach 12 Wochen zeigte der 14mm-Defekt spannenderweise nur geringe Arthrose am medialen Femurkondyl, wo der Defekt gesetzt wurde, dafür aber ausgeprägte arthrotische Veränderungen an der Tibia und am Meniskus. Der 7mm-Defekt führte zu fokaler unikompartimenteller Arthrose am medialen femoralen Kondyl und nur geringen degenerativen Veränderungen an der Tibia.11 Diese Ergebnisse wurden sowohl makroskopisch mit dem „gross assessment of joint changes score“ als auch mikroskopisch mittels Mankin-Score evaluiert. Serum-COMP(„cartilage oligomeric matrix protein“)-Levels wurden alle 14 Tage abgenommen und stiegen kontinuierlich an.
Zusammenschauend konnte somit gezeigt werden, dass die ausgeprägteste Arthrose nach 12 Wochen mit dem 7mm-Defekt erzielt werden konnte. Daher wurde für die weiteren Studien der 7mm-Defekt mit der längeren Belastungszeit gewählt, um eine Arthrose bei stabilen Gelenksverhältnissen zu induzieren.
Bei der Entwicklung der Methodik für die biologische Regeneration wurde vor allem auf die Mitbeteiligung des subchondralen Knochens am arthrotischen Prozess Wert gelegt. Dies könnte unserer Meinung nach die Diskrepanz zwischen guten Ergebnissen im Kleintiermodell und schlechten Ergebnissen in der klinischen Anwendung erklären. Denn bei Kleintiermodellen wird bei der Austestung von humanen Matrices stets der subchondrale Knochen mit entfernt, da die Matrix die Dicke der Knorpelzellschicht überschreitet. In der humanen Anwendung wird aber der subchondrale Knochen stets intakt gelassen, um einer möglichen Hypertrophie des Regenerates vorzubeugen. Eine weitere Überlegung, die in die Planung eingeflossen ist, war, ob es notwendig ist, die implantierte Matrix mit Chondrozyten zu besiedeln, oder ob eine gleichwertige Regeneration auch ohne Zellen oder sogar ohne Matrix stattfindet.
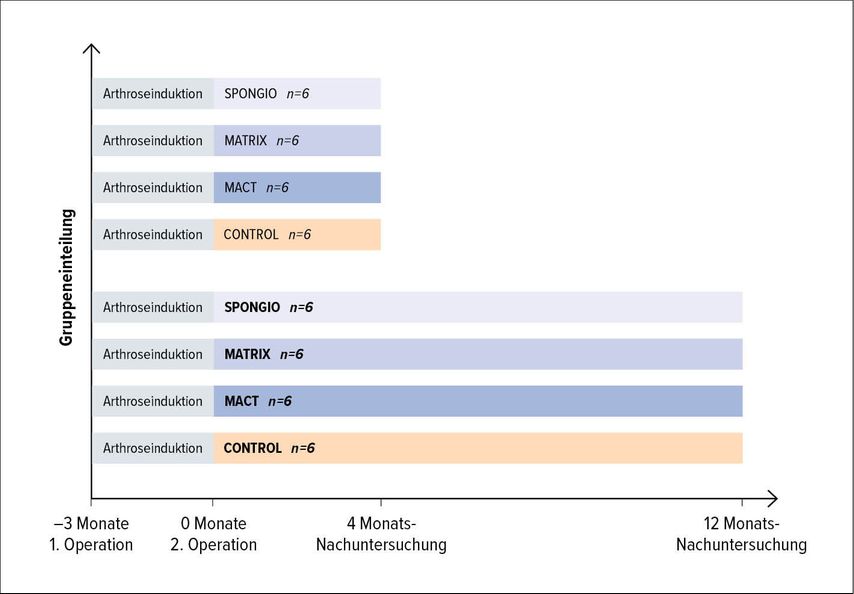
Besonderes Augenmerk wurde auf die Generierung von Langzeitergebnissen der regenerativen Verfahren gelegt. Es wurden zwei Großtierstudien im Rahmen eines EU-Projektes durchgeführt. Die erste hatte einen Nachuntersuchungszeitraum von 4 und die zweite von 12 Monaten.12,13 Es wurden 48 österreichische Bergschafe zweimal operiert. Im Zuge des ersten Eingriffes wurden die Erkenntnisse aus der Arthroseinduktionsstudie angewandt und eine Arthrose am stabilen Gelenk induziert (7mm-Defekt mit einer Belastungszeit von 12 Wochen; Gruppeneinteilung siehe Abb.1).
Der Knorpel, der im Rahmen der Defektsetzung gewonnen wurde, wurde zur Knorpelzellzüchtung herangezogen. Bei einem weiteren Eingriff erfolgte die Gruppenseparation in 3 unterschiedliche Behandlungsgruppen (SPONGIO, MATRIX, MACT) sowie in eine Arthroseverlaufsgruppe, in welcher der Knorpeldefekt und das umliegende Gewebe nicht behandelt wurden.
Bei den 3 Behandlungsgruppen wurden folgende Techniken angewandt: Bei den Schafen der SPONGIO-Gruppe wurde der Knorpel in der lasttragenden Zone am medialen femoralen Kondyl in dem Bereich, in dem auch der ursprüngliche 7mm-Defekt gesetzt wurde, mit einer standardisierten ovalen Stanze und einer Kürette entfernt. Danach erfolgte die Entfernung des Knochens bis zu einer Tiefe von 2,5mm mithilfe einer Fräse mit einem kugelförmigen und einem zylinderförmigen Aufsatz. Diese Technik wird als „spongialization“ bezeichnet.14 Die Blutstillung des Knochendefektes erfolgte mit einer dünnen Lage Fibrinkleber.
Die Tiere der MATRIX-Gruppe erhielten dieselbe Behandlung wie jene in der SPONGIO-Gruppe, mit dem Unterschied, dass hier eine Hyaluronsäurematrix auf die Fibrinkleberschicht aufgebracht wurde.
Bei den Schafen der MACT-Gruppe wurde dieselbe Technik wie in der MATRIX-Gruppe angewandt, mit dem Unterschied, dass die Hyaluronsäurematrix vor der Implantation mit autologen kultivierten Chondrozyten besiedelt wurde (1x106 Zellen pro cm2 P1-Zellen).
Die makroskopische Auswertung der Knorpelregeneration erfolgte mittels Brittberg-Score, die mikroskopische mit dem Mankin-Score und dem O’Driscoll-Score.
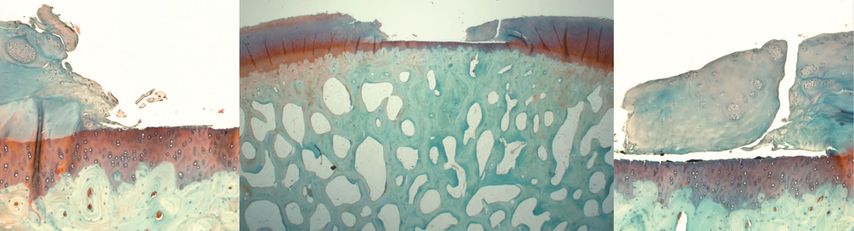
Die Evaluation der Ergebnisse der Kontrollgruppe zeigte eine signifikante Verschlechterung der Arthrose im Laufe der Zeit über 4 und 12 Monate. Im Defektareal zeigte sich keine Regeneration und der angrenzende Knorpel wies zunehmende Degeneration sowohl bei der makroskopischen als auch bei der mikroskopischen Evaluation auf (Abb.2).
Abb. 2: Safranin-O-gefärbter Histoschnitt sagittal durch den medialen femoralen Kondyl 12 Monate nach Defektsetzung der CONTROL-Gruppe. Im mittleren Bild zentral der Defekt ohne jegliche Regenerationstendenz. Rechts und links davon der angrenzende Knorpel mit ausgeprägten degenerativen Veränderungen
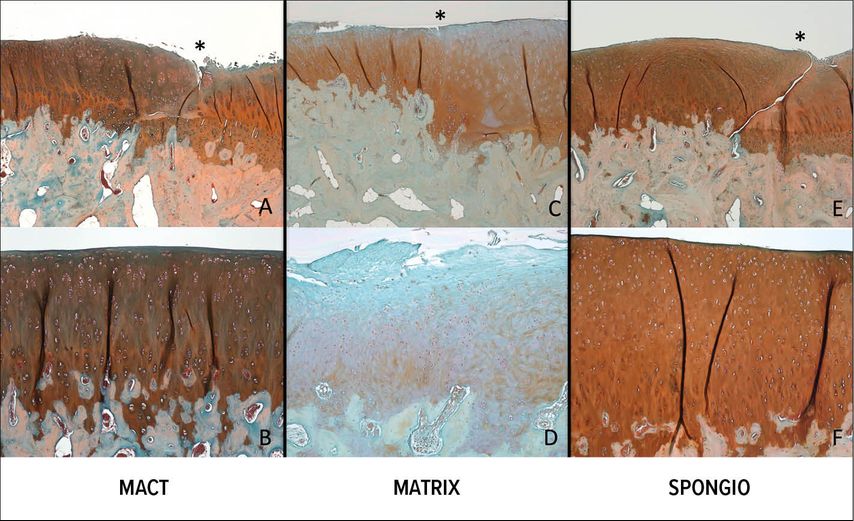
Ein zonaler Aufbau der Regenerationszone konnte in allen Regenerationsgruppen erzielt werden. Nach 4 Monaten zeigte sich ein signifikant besseres Ergebnis der MACT-Gruppe im Vergleich zu den anderen beiden Regenerationsgruppen (MATRIX, SPONGIO) mit signifikanten Unterschieden der makroskopischen und mikroskopischen Parameter. Bei der SPONGIO- Gruppe zeigte sich nach 4 Monaten fokal eine gute Knorpelzellqualität, jedoch präsentierte sich die Oberfläche als sehr uneben. Bei der MATRIX-Gruppe dominierte die Ausbildung eines Regeneratgewebes, welches jedoch nicht hyalinem Knorpel entsprach (Abb.3).
Abb. 3: Safranin-O-gefärbter Histoschnitt sagittal durch den medialen femoralen Kondyl 12 Monate nach Defektsetzung der MACT- (linke Spalte), MATRIX- (mittlere Spalte) und SPONGIO-Gruppe (rechte Spalte). Die erste Zeile zeigt das Regenerationsareal angrenzend an den nativen Knorpel. Die Anbindungszone ist jeweils mit * markiert. Die untere Zeile zeigt das zentrale Regenerationsareal
Im Verlauf von 4 bis zu 12 Monaten wurde weiterhin eine Verbesserung aller Regenerationsgruppen detektiert. Bei 4 von 6 Schafen der MACT-Gruppe füllte das Regenerat die volle Höhe des 2,5mm tiefen und 20x10mm großen Defektes aus. Ein über die normale Knorpelzellhöhe reichendes überschießendes Regenerat war bei keinem Tier vorhanden. In der Safranin-O-Färbung des Regenerats zeigte sich bei der MACT- und SPONGIO-Gruppe nur eine leichte Reduktion der Färbung im Vergleich zu gesundem Knorpelgewebe, bei der MATRIX-Gruppe eine stark reduzierte Färbung. Die Tidemark war bei allen Regenerationsgruppen noch von Blutgefäßen durchbrochen. Bemerkenswert waren in Säulenform angeordnete Chondrozyten im zentralen Defektareal der MACT-Gruppe, da dies für die Ausbildung eines hyalinen Knorpels spricht.
Zusammenfassend ergab die Analyse der histologischen Evaluation der 12-Monats-Ergebnisse eine signifikante Überlegenheit der MACT- und der SPONGIO-Gruppe gegenüber der MATRIX-Gruppe. Im an das Regenerat angrenzenden Knorpel zeigte sich in allen drei Regenerationsgruppen Clusterausbildung der Chondrozyten als Zeichen der Degeneration.
Der Vergleich der 12-Monats-Ergebnisse mit den 4-Monats-Ergebnissen ergab beim Mankin-Score eine signifikante bessere Gewebequalität. Der O’Driscoll-Score zeigte eine signifikante Verbesserung in der MATRIX- und SPONGIO-Gruppe im Vergleich zu den 4-Monats-Ergebnissen. In der MACT-Gruppe konnte jedoch nur eine weitere Verbesserung ohne Signifikanz gesehen werden, da hier die Ergebnisse schon nach 4 Monaten gut waren.
Die guten Ergebnisse der SPONGIO-Gruppe können auf den Einsatz von Fibrinkleber zur Stillung der Blutung und Standardisierung der drei Regenerationsgruppen zurückgeführt werden. Dieser scheint ebenso das Potenzial zu haben, als Matrix für Zellen zu wirken. Die schlechten Ergebnisse der MATRIX-Gruppe, trotz Einsatzes einer Hyaluronsäurematrix, lassen sich aus der Absiegelung des spongiösen Knochens mit flächigem Fibrinkleber erklären und die dadurch verhinderte Migration von Stammzellen aus dem Knochen in die Matrix. Hieraus können entscheidende Schlüsse für die klinische Anwendung im Bereich Matrixfixation gezogen werden.
Zusammenfassung
Das zunehmende Alter der Bevölkerung und die erhöhten Lebensansprüche einerseits und das Auftreten von Arthrose bei jungen Patienten andererseits machen es notwendig, die Forschung auf dem Gebiet der regenerativen Medizin voranzutreiben. Auf Basis der im Großtiermodell gezeigten vielversprechenden Ergebnisse bei unikompartimenteller Früharthrose könnte es möglich werden, eine biologische Regeneration des Knorpels und des darunterliegenden Knochens auch im humanen Gelenk zu erreichen.
In unserer Studie erreichte die MACT-Gruppe die besten Ergebnisse nach 4 Monaten, welche auch über 12 Monate gehalten, zum Teil sogar noch weiter verbessert werden konnten. Ein zonaler Aufbau der Regenerationszone konnte in allen Regenerationsgruppen erzielt werden. Die Arthrose in der Kontrollgruppe verschlechterte sich signifikant im Verlauf und zeigte keine Tendenz zur Regeneration.
Weitere Studien sind indiziert, um zu beweisen, ob die Ergebnisse direkt auf das humane Kniegelenk übertragen werden können. Viele Erkenntnisse, wie etwa die Auswirkungen eines „Critical size“-Knorpeldefektes in einer lasttragenden Zone des Gelenks, der keine Regenerationstendenz zeigt und schlussendlich in die Arthrose übergeht, oder der Einfluss von Fibrinkleber auf das Regenerat, der die Migration von Stammzellen zum Zeitpunkt der Regeneration verhindern kann oder auch selbst als Matrix wirken kann, können direkt klinisch umgesetzt werden.
Literatur:
1 Lawrence RC et al.: Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: part II. Arthritis Rheum 2008; 58(1): 26-35 2 Brittberg M et al.: Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med 1994; 331: 889-95 3 Aldrian S et al.: Clinical and radiological long-term outcomes after matrix-induced autologous chondrocyte transplantation: a prospective follow-up at a minimum of 10 years. Am J Sports Med 2014; 42(11): 2680-8 4 Biant LC et al.: Long-term results of autologous chondrocyte implantation in the knee for chronic chondral and osteochondral defects. Am J Sports Med 2014; 42(9): 2178-83 5 Moseley JB Jr et al.: Long-term durability of autologous chondrocyte implantation: a multicenter, observational study in US patients. Am J Sports Med 2010; 38(2): 238-46 6 Peterson L et al.: Autologous chondrocyte implantation: a long-term follow-up. Am J Sports Med 2010; 38(6): 1117-24 7 Andriolo L et al.: High rate of failure after matrix-assisted autologous chondrocyte transplantation in osteoarthritic knees at 15 years of follow-up. Am J Sports Med 2019; 47(9): 2116-22 8 Brix MO et al.: Treatment of full-thickness chondral defects with hyalograft C in the knee: long-term results. Am J Sports Med 2014; 42(6): 1426-32 9 Filardo G et al.: Second-generation arthroscopic autologous chondrocyte implantation for the treatment of degenerative cartilage lesions. Knee Surg Sports Traumatol Arthrosc 2012; 20(9): 1704-13 10 Filardo G et al.: Matrix-assisted autologous chondrocyte transplantation for cartilage regeneration in osteoarthritic knees: results and failures at midterm follow-up. Am J Sports Med 2013; 41(1): 95-100 11 Schinhan M et al.: Critical-size defect induces unicompartmental osteoarthritis in a stable ovine knee. J Orthop Res 2012; 30(2): 214-20 12 Schinhan M et al.: Matrix-associated autologous chondrocyte transplantation in a compartmentalized early stage of osteoarthritis. Osteoarthritis Cartilage 2013; 21(1): 217-25 13 Schinhan M et al.: Biological regeneration of articular cartilage in an early stage of compartmentalized osteoarthritis: 12-month results. Am J Sports Med 2020; 48(6): 1338-46 14 Ficat RP et al.: Spongialization: a new treatment for diseased patellae. Clin Orthop Relat Res 1979; 144: 74-83
Das könnte Sie auch interessieren:
Periphere Nervenkompressionssyndrome der oberen Extremität
Periphere Nervenkompressionssysteme der oberen Extremitäten sind verhältnismäßig häufig, insbesondere der Nervus medianus und der Nervus ulnaris sind oft im Bereich des Hand- bzw. ...
Konservative Behandlungsmöglichkeiten bei peripheren Nervenläsionen
Eine periphere Nervenläsion erfordert nicht nur eine Dekompression, Naht oder Rekonstruktion. Um Gelenke beweglich zu erhalten, eine Atrophie der Muskulatur zu verhindern und die ...
Bildgebende Diagnostik des peripheren Nervensystems
Die komplexen Nerventopografien machen die Nervenbildgebung zu einer fordernden Aufgabe, die allerdings eine wichtige Rolle dabei spielt, eine funktionelle Wiederherstellung der ...