Réduction des taux élevés de LDL – jusqu’où?
Compte-rendu:
Dre med. Christine Adderson-Kisser, MPH
Journaliste médicale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
En ce qui concerne la réduction du cholestérol LDL (C-LDL), des valeurs cibles sont annoncées en fonction du risque. Pour cela, on utilise d’abord les statines, puis l’ézétimibe et les inhibiteurs de la PCSK9. En cas de tolérance aux statines, l’acide bempédoïque est une option.
Le concept de réduction des lipides a évolué au cours des dernières décennies de telle sorte que l’objectif est aujourd’hui d’atteindre des taux de cholestérol LDL aussi bas que possible, et ce le plus tôt possible dans la vie. La valeur cible de LDL à atteindre dépend du profil de risque de la personne concernée. S’il existe un faible risque avec un SCORE («Systematic Coronary Risk Estimation») <1%, la valeur cible du LDL est de 3,0mmol/l. Avec l’augmentation du risque, il est souvent judicieux de fixer une valeur cible nettement plus basse – jusqu’à 1,4mmol/l pour les personnes à très haut risque (SCORE ≥10%, maladie coronarienne grave, diabète sucré avec séquelles organiques).1
«Si l’on considère qu’un nouveau-né présente un taux de C-LDL de 0,8 à 1,8mmol/l, on peut imaginer que la valeur cible idéale de C-LDL se situe dans cette fourchette», a déclaré le Pr Dr méd. Jean-Paul Schmid, médecin-chef de cardiologie et chef du service de médecine interne de la clinique de Gais. Il est tout à fait possible d’atteindre un tel niveau de C-LDL avec les inhibiteurs de PCSK9 (PCSK9i) actuellement disponibles. «Jusqu’à présent, nous ne disposons d’aucune preuve solide indiquant que des taux de C-LDL particulièrement bas sont associés à des effets négatifs.»
Quelles sont les préparations disponibles et comment agissent-elles?
Un concept très important dans le cadre du traitement hypolipémiant est celui de la régression de la plaque, comme l’a souligné J.-P. Schmid. L’imagerie intravasculaire a montré qu’une réduction du C-LDL à des valeurs cibles <2,0mmol/l dans les études permettait de réduire le volume des plaques.2 «C’est un argument important lorsque l’on parle avec les patient·es des valeurs cibles de C-LDL d’un traitement hypolipémiant: qu’avec une réduction suffisamment importante, les plaques d’athérosclérose peuvent régresser.»
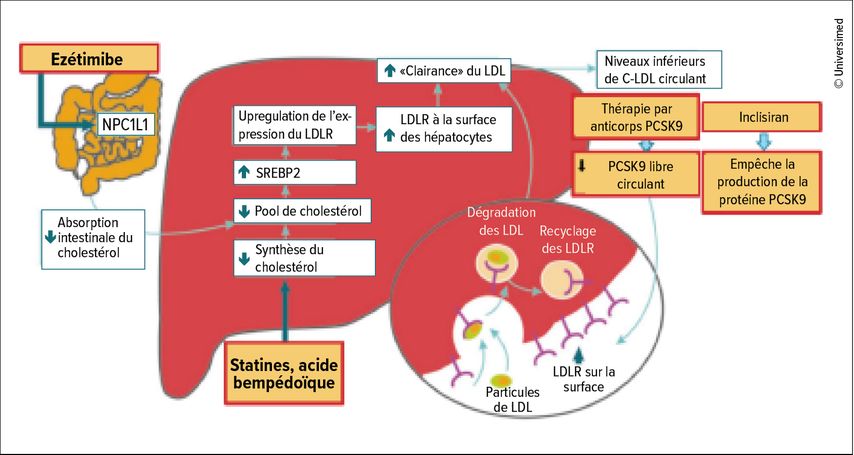
Pour bien atteindre la valeur cible visée, il est donc important de savoir dans quelle mesure les différents médicaments disponibles réduisent le C-LDL en moyenne. «Si nous traitons avec une statine très puissante, nous pouvons obtenir une réduction du C-LDL d’environ 50%. En ajoutant de l’ézétimibe, nous arrivons déjà à 65% et en ajoutant un inhibiteur de la PCSK9, le LDL peut être réduit de 50 à 60% supplémentaires», a expliqué Schmid. La raison en est l’interaction favorable entre les différentes classes de substances. En effet, le traitement par statine régule certes efficacement le métabolisme du cholestérol, mais la contre-régulation se traduit par une augmentation de l’absorption du cholestérol par l’intestin, de sorte qu’une partie de l’effet de la statine est annulée. «Avec l’utilisation de l’ézétimibe, qui inhibe l’absorption intestinale, nous avons donc ici une approche élégante pour éliminer cette contre-régulation.» L’augmentation des récepteurs LDL à la surface des cellules hépatiques provoquée par les statines et l’ézétimibe entraîne par la suite une absorption accrue des C-LDL dans le sang afin de couvrir les besoins accrus en cholestérol dans la cellule. La proprotéine convertase subtilisine/kexine de type 9 (PCSK9), qui favorise la dégradation des récepteurs LDL dans les lysosomes du foie, joue toutefois un rôle limitant. L’inhibition de la PCSK9 entraîne une nouvelle mise à disposition des récepteurs LDL à la surface des cellules hépatiques.3 «La triple combinaison de statine, d’ézétimibe et de PCSK9i est donc pertinente pour plusieurs raisons et entraîne une réduction efficace du C-LDL», explique J.-P. Schmid (Fig. 1).
Fig. 1: Justification pour la triple combinaison de statine, d’ézétimibe et d’inhibiteur de PCSK9 (adaptée de Landmesser U et al. 2017)3
Vaut-il la peine de doubler la dose de statine?
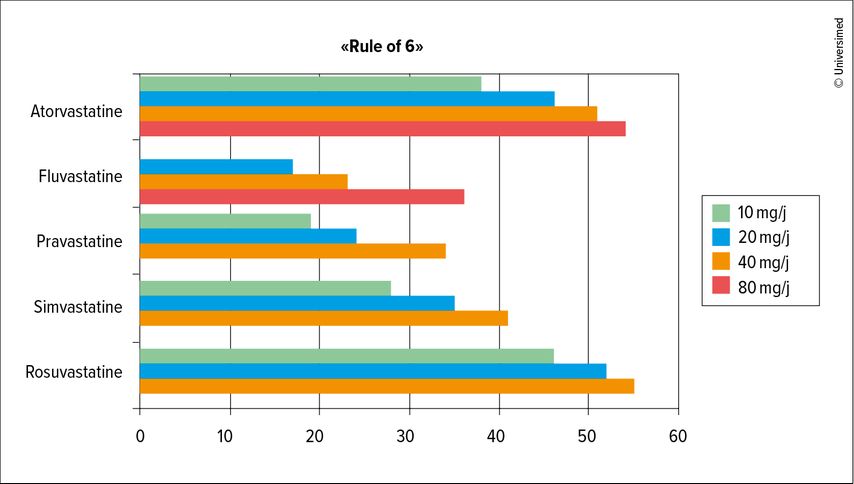
Lors du traitement, il faut d’abord tenir compte de la puissance de la statine en question: en effet, alors si une dose de 10mg de rosuvastatine par jour permet de réduire le C-LDL jusqu’à 45%, le même dosage de simvastatine n’entraîne qu’une réduction d’environ 25%. Une comparaison de l’effet de différentes statines dans l’essai STELLAR a en outre montré que l’introduction de la plus petite dose à chaque fois avait le plus grand effet de réduction du LDL pour toutes les statines, alors qu’un doublement de la dose n’entraînait qu’un faible effet supplémentaire (Fig. 2).4 Cette observation est appelée «Rule of 6», ce qui signifie que chaque doublement de la dose de statine entraîne une réduction supplémentaire du LDL de 6%. C’est pourquoi, en cas de contrôle insuffisant du C-LDL sous statine, il est plus judicieux d’ajouter de l’ézétimibe, qui permet d’obtenir une réduction supplémentaire de 18 à 24%.
Escalade thérapeutique selon les lignes directrices
Les algorithmes thérapeutiques de la GSLA de 2025, qui ont adapté les recommandations européennes pour le traitement de l’hypercholestérolémie (EAS/ESC 2019) pour la Suisse, montrent quelle classe de substances peuvent progressivement compléter un traitement par statine insuffisant et l’étendre en fonction de la valeur cible du C-LDL.1,5 Selon ces algorithmes, les personnes présentant un risque cardiovasculaire très élevé sont d’abord traitées par une statine – dans le but de réduire le LDL d’au moins 50% ou de le ramener à <1,4mmol/l. En cas d’échec, l’ézétimibe est ajouté. Si le LDL ne peut pas être abaissé à <1,8mmol/l sous ézétimibe, un PCSK9i ou de l’acide bempédoïque est ajouté.
En prévention primaire, on vise à abaisser le C-LDL d’au moins 50% ou à atteindre des valeurs <1,8mmol/l chez les personnes sans maladie athérosclérotique manifeste, mais à haut risque. En cas d’échec, il convient de compléter l’ézétimibe et d’exclure une hypercholestérolémie familiale hétérozygote. Si celle-ci est diagnostiquée, un PCSK9i est utilisé en complément. Les recommandations actuelles de la GSLA pour la prévention et la gestion de l’athérosclérose sont résumées dans le Pocketguide 2025.
Où faut-il classer l’acide bempédoïque?
«L’acide bempédoïque agit sur la même voie métabolique que les statines, mais il intervient à un stade plus précoce que ces dernières», a expliqué J.-P. Schmid. Leur avantage résiderait dans le fait qu’il s’agit d’une prodrogue qui n’est activée que par une enzyme spéciale qui ne se trouve que dans la cellule hépatique et non dans la cellule musculaire. Ainsi, contrairement aux statines, il ne faut pas s’attendre à des effets négatifs sur la musculature squelettique, ce qui fait de l’acide bempédonique un médicament approprié pour les personnes intolérantes aux statines. Leur bénéfice clinique dans ce groupe de patient·es est certes démontré, avec une réduction de 15 à 20% du niveau de C-LDL et de 23% du risque d’infarctus du myocarde, mais il est nettement inférieur à l’effet des PCSK9i, qui sont également disponibles en cas d’intolérance aux statines.6 «L’acide bempédoïque n’est peut-être pas notre médicament le plus efficace dans la réduction du C-LDL, mais il élargit notre répertoire dans ce groupe de patient·es», conclut J.-P. Schmid.
Source:
1er cours sur la lipidologie clinique du GSLA, du 18 au 19 janvier 2024, à Zurich
Littérature:
1 Mach F et al.: Eur Heart J 2020; 41: 111-88 2 Puri R et al.: Eur Heart J 2013; 34: 1818-2 3 Landmesser U et al.: Eur Heart J. 2017; 00: 1-13 4 Jones PH et al.: Am J Cardiol 2003; 92: 152-60 5 GSLA: Prévention de l’athérosclérose 2025. www.agla.ch/fr 6 Nissen et al.: N Engl J Med 2023; 288: 1353-64
Das könnte Sie auch interessieren:
Nouvelle époque, nouveaux pollens?
Le changement climatique, avec l’augmentation du CO2, la hausse des températures et la modification du régime des précipitations, influence la concentration, l’allergénicité et la la ...
Nouvelles directives et un puissant inhibiteur de BCR-ABL1Extension de l’autorisation de mise sur le marché du dostarlimab plus chimiothérapie
Les recommandations de l’ELN sur la prise en charge de la LMC seront mises à jour en 2025. L’asciminib, un inhibiteur allostérique sélectif ciblant la poche myristoylée de BCR-ABL1, a ...
Stratégies thérapeutiques de la MASLD en 2025
La stéatose hépatique non alcoolique ou MASLD («metabolic dysfunction-associated steatotic liver disease») est une maladie métabolique liée à une accumulation de graisse dans le foie.1 ...