Stratégies thérapeutiques de la MASLD en 2025
Auteur·es:
Dre méd. Ludmila Nicolazzi
Dr méd. Léo König
Dr méd. Giles Major
Service d’endocrinologie, diabétologie et métabolisme
Centre hospitalier universitaire vaudois
Lausanne
E-mail: ludmila.nicolazzi@chuv.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La stéatose hépatique non alcoolique ou MASLD («metabolic dysfunction-associated steatotic liver disease») est une maladie métabolique liée à une accumulation de graisse dans le foie.1 Les caractéristiques épidémiologiques et démographiques de la MASLD varient à travers le monde et évoluent parallèlement à la prévalence du syndrome métabolique. Même si un dépistage des sujets à risques est recommandé par les sociétés savantes, aucun traitement médicamenteux n’est pour l’heure préconisé et le seul traitement curatif de la cirrhose induite par la MASLD reste la transplantation hépatique.2 Des thérapies innovantes sont en cours de développement3 et le corps d’évidence sur l’effet positif de certains aliments thérapeutiques ne cesse de grandir. Nous allons aborder certaines de ces évidences dans cette revue.
Keypoints
-
La pierre angulaire de la prise en charge de la MASLD reste une modification de l’hygiène de vie.
-
Il n’y a pas de consensus sur un régime idéal dans la MASLD. Il est proposé d’éviter les aliments riches en fructose et les graisses saturées. Le régime méditerranéen, contenant des acides gras monoinsaturés et des Oméga-3, a montré une efficacité chez les patients atteints de MASLD.
-
Les Oméga-3 et la vitamine E sont considérés comme prometteurs dans la prise en charge de la MASLD.
-
La plupart des traitements actuels ne permettent pas de résolution de la fibrose. Certains ont montré une réduction de la stéatose comme les analogues du GLP-1.
-
Des thérapies émergentes comme le resmetirom et les analogues du FGF-21 sont des traitements prometteurs, actuellement à des stades de développement différents.
La MASLD est définie par la présence d’une stéatose hépatique dans ≥5% des hépatocytes (diagnostiquée par imagerie ou l’histologie) et en l’absence de consommation excessive d’alcool (≥30g/j chez les hommes, ≥20g/j chez les femmes)4 ou de médicament(s) (corticoïdes, tamoxifène, amiodarone) pouvant être responsables de la stéatose.5,6 Elle évolue selon un continuum de la simple stéatose hépatique («non-alcoholic fatty liver», NAFL) vers la NASH («non-alcoholic statohepatitis»).4 L’évolution se fait ensuite vers la fibrose dont les complications peuvent être sévères allant de la cirrhose aux carcinomes hépato-cellulaires.1 D’un point de vue épidémiologique, la prévalence de la MASLD est en augmentation constante.5 On estime que la prévalence de la MASLD deviendra la principale cause de transplantation hépatique dans les prochaines années.7
La nomenclature MASLD («metabolic dysfunction-associated steatotic liver disease») a été proposée en 20238 pour souligner la contribution de facteurs de risque métaboliques dans le développement et la progression de cette maladie. La MASLD est en effet associée aux comorbidités métaboliques telles que l’obésité, l’hypertension, la dyslipidémie et le diabète de type 2.3,9
Physiopathologie
La physiopathologie est complexe et non totalement élucidée6 et pourrait provenir d’un déséquilibre induit par un excès d’apport énergétique en graisses et hydrates de carbone (HC) et la capacité du foie à les métaboliser, favorisant ainsi la lipogenèse.10 L’excès d’HC et de graisses saturées induirait également une résistance à l’insuline du muscle squelettique et donc une diminution de la captation du sucre par le muscle qui serait redirigé vers le foie, où il est utilisé comme substrat pour la lipogenèse.10 Le déséquilibre du métabolisme lipidique conduit à un stress oxydatif et à l’apoptose des cellules hépatocytaires.6,11 La fibrose résulte d’une accumulation de matériel extracellulaire par les cellules stellaires remplaçant progressivement le tissu hépatique fonctionnel en tissu fibrotique.10,11 Des voies de signalisation inflammatoires seraient également impliquées dans la pathogenèse de la maladie (altération des cellules immunitaires, changement dans la production des cytokines et activation d’inflammasomes).11
Une autre hypothèse réside dans l’altération du cycle entéro-hépatique des acides biliaires comme rôle dans la physiopathologie de la MASLD.10
Des facteurs socioéconomiques sous-tendent également les différences de prévalence de la MASLD. Enfin, des facteurs individuels tels que la dysbiose intestinale ou certains variants génétiques et épigénétiques, semblent jouer un rôle dans l’occurrence de la MASLD.12
Screening
L’American Diabetes Association (ADA) ne recommande pas de dépistage systématique chez les patients avec un diabète de type 2.14 D’autres sociétés telles que les sociétés européennes d’hépatologie, de diabétologie et d’obésité recommandent d’effectuer un dépistage chez les patients avec un syndrome métabolique, obésité ou diabète de type 2 par un dosage des tests hépatiques et une échographie abdominale.1,4
L’imagerie la plus utilisée pour le diagnostic de stéatose hépatique est l’échographie (sensibilité de 83%, spécificité de 93%).3,6,7D’autres techniques d’imagerie sont utilisées pour le diagnostic de la stéatose hépatique comme le CT abdominal ou l’IRM6 bien que ces techniques soient limitées pour évaluer la charge graisseuse et incapables de détecter l’inflammation ou la fibrose.
Après le diagnostic de stéatose, des scores cliniques sont utilisés pour estimer le degré de fibrose (FIB-4 ou le NAFLD fibrosis score [NFS]), marqueur de pronostic et de sévérité essentiel à déterminer,3,5 comme le FIB-4 qui présente une sensibilité de 85% et une spécificité de 86% dans une étude.15 L’utilisation d’un 2e score (p.ex. le NAFLD score) peut augmenter la sensibilité et la spécificité.15 Chez les individus à risque modéré ou élevé de fibrose, Un deuxième test est nécessaire comme le «enhanced liver fibrosis test» (ELF) ou la mesure de l’élastographie impulsionnelle.4
Le gold standard reste la biopsie hépatique pour le diagnostic de MASLD mais est réservée à certaines situations spécifiques.1
Prise en charge de l’hygiène de vie
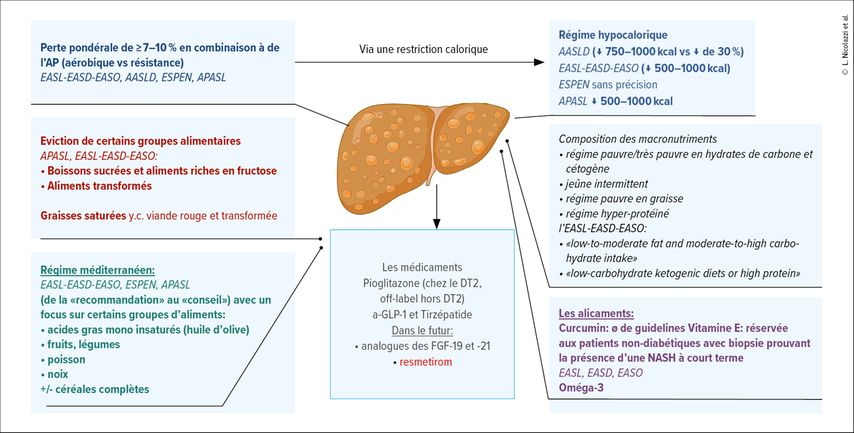
L’optimisation des mesures hygiéno-diététiques par modification du régime alimentaire et l’implémentation d’une activité physique reste actuellement la pierre angulaire de la prise en charge de la MASLD.16,17
Perte pondérale et activité physique
L’European Society for Clinical Nutrition and Metabolism (ESPEN; 2019) recommande une perte pondérale de ≥7–10% chez les patients en surpoids/en situation d’obésité pour une amélioration de la stéatose hépatique et précise qu’une perte de >10% pourrait être nécessaire pour une amélioration de la fibrose.17 La plupart des sociétés savantes ciblent également une perte pondérale ≥7% pour qu’un impact sur la fibrose soit présent. Certaines guidelines proposent un régime hypocalorique (réduction de 500–1000kcal/j comme proposé par l’AASLD (American Association for the Study of Liver disease) en combinaison à de l’exercice physique. De manière intéressante, une étude a montré une résolution de la MASLD chez 64,2% ayant eu un bypass gastrique selon Roux-en-Y ainsi qu’une régression de la fibrose.6 Chez 109 patients atteints de MASLD prouvée par une biopsie, la chirurgie bariatrique a permis une rémission histologique de 85% des patients après un an de suivi.1 Ces données permettent de souligner le bénéfice d’une perte pondérale chez les patients atteints de MASLD.
On ne retrouve pas de consensus sur le type (résistance versus aérobique) et la durée de l’exercice physique recommandés.1 Il a été démontré dans des méta-analyses que l’activité physique réduisait la teneur en lipides intrahépatiques et améliorait les enzymes hépatiques mais la supériorité d’un type d’exercice par rapport à un autre n’a pu être démontrée.17,18 L’EASL et l’AASLD recommandent ≥150 minutes d’exercice physique à intensité modérée en 3–5 séances par semaine.4 Les effets bénéfiques de l’activité physique peuvent s’expliquer par une augmentation de la dépense énergétique, une amélioration de la résistance à l’insuline, l’augmentation de la clearance des VLDL et l’amélioration du contrôle de l’appétit.17 La plupart des études incluent également des interventions visant une diminution du poids/modification du régime alimentaire, rendant difficile de connaître l’effet de l’exercice physique comme facteur indépendant dans la réduction de la stéatose hépatique.
Alimentation
Il n’existe pas de recommandation unanime sur le régime idéal chez les individus atteints de MASLD. Des études montrent des associations entre la MASLD et la consommation de certains macronutriments, tels que les boissons sucrées, la viande rouge9 et les graisses saturées.16 D’autres aliments, comme la consommation de noix ou d’acides gras monoinsaturés, semblent au contraire être négativement associés à la MASLD.9,16 Certains auteurs s’accordent également sur le bénéfice de certains patterns alimentaires comme le régime méditerranéen.19 Toutefois, les évidences manquent concernant l’implication des macronutriments dans le développement de la MASLD et l’effet d’une réduction de leur consommation.
Des patterns alimentaires ont été étudiés sur les outcomes de la MASLD comme les régimes en forte teneur protéique, le jeûne intermittent ou le régime méditerranéen.16,17 Le régime méditerranéen est le pattern alimentaire le plus étudié dans la MASLD et est proposé par de nombreuses guidelines20 dont celles de l’ESPEN.19 Ce régime, riche en céréales complètes, fruits, légumes, noix, huile d’olive, poisson/volaille et faible en graisse animale, a montré des effets bénéfiques dans la prévention des maladies cardiovasculaire et la MASLD.9 Indépendamment de la perte pondérale, le régime méditerranéen diminue la stéatose hépatique, améliore la sensibilité à l’insuline chez les patients atteints de MASLD avec une efficacité supérieure à un régime pauvre en graisse19 et semble également avoir un impact sur la sévérité de la maladie.19 Dans une étude, dans le groupe d’intervention (régime méditerranéen+régime hypocalorique), on retrouvait également une diminution de la rigidité hépatique,21 reflet indirect de la fibrose. Toutefois, les données ne permettaient pas de conclure que le régime méditerranéen a un impact sur la prévention du développement d’une MASLD.19
La consommation excessive de fructose aurait des effets délétères sur la santé notamment le développement de maladies métaboliques.22,23 En comparaison au glucose, le fructose est un inducteur plus puissant de la lipogenèse hépatique de novo et inhibe la β-oxydation.23,24 Le fructose est un sucre présent naturellement dans le miel et les fruits, mais est également un composant majeur des édulcorants que l’on retrouve dans les boissons sucrées type soda. Dans les études cliniques observationnelles, la consommation de soda est associée de manière importante à la MASLD9,16,23 et pourrait avoir un impact sur la progression de la fibrose.17 D’autre part, dans une étude randomiséecontrôlée, un régime restreint en fructose (<7,5g/repas et <10g/j) a montré une réduction plus importante de la stéatose que dans le groupe d’intervention.25 L’EASL, l’EASD et l’EASO (l’European Association for the Study of Obesity) recommandent l’éviction de boissons/aliments riches en fructose.17 Il se pourrait toutefois que l’association entre la MASLD et la consommation de fructose soit en lien avec l’apport calorique global élevé de ce sucre et non en raison d’une association directe.4
Les régimes cétogènes deviennent de plus en plus populaires dans le traitement du diabète de type 2 ou de l’obésité.9 Dans une étude où les participants avaient une consommation de ≤25g/j d’HC (couplée à une restriction calorique globale), on observait une diminution de la teneur en lipides intrahépatiques de 31% en association à une diminution de la résistance à l’insuline dès 48 heures après le début de l’étude.26 D’autres études, avec des régimes moins restrictifs (pauvres et très pauvres en hydrates de carbone [>1000kcal/j, les HC représentent 10–25% ou <10% respectivement de l’apport énergétique total]), ont également confirmé ces résultats. Dans une étude, chez les patients atteints de MASLD qui consommaient <20g/j d’hydrates de carbone pour 6 mois sans restriction calorique associée, on observait une réduction de la stéatose en plus d’une tendance vers une réduction de la fibrose,20 indiquant des résultats prometteurs indépendamment du potentiel effet d’un régime hypocalorique. Toutefois, ce type de régime est également associé à une augmentation du cholestérol total et du LDL à long terme et reste difficile à mettre en pratique au quotidien.26 De plus, en comparaison au régime faible en graisse, les patients exposés au régime pauvre en hydrates de carbone ne semblait pas avoir de bénéfice supplémentaire sur la réduction du taux de graisse intrahépatique.20
Certaines études suggèrent une implication d’une consommation élevée de graisses saturées (graisse animale, huile de palme, pâtisseries industrielles, etc.) dans le développement d’une stéatose hépatique.16,27 Au contraire, la consommation d’acides gras monoinsaturés comme l’huile d’olive (principalement extra vierge) pourrait jouer un rôle dans la prévention de la MASLD et réduire la stéatose hépatique.28
Les recommandations suisses datant de 2024 n’évoquent pas la MASLD directement mais le risque de carcinome hépatocellulaire (études de prévention des maladies non transmissibles).29
Les alicaments
Les alicaments sont des «composants classifiés ou non comme nutriments, ayant des fonctions systémiques». Nous en avons sélectionné certains, qui semblent prometteurs dans la prise en charge de la MASLD.
Oméga-3
Les oméga-3 sont une famille d’acides gras polyinsaturés qui comprend des acides gras essentiels (acide alpha linoléique, acide eicosapentaénoïque [EPA], acide docosahexaénoïque [DHA], etc.).30 On les retrouve naturellement chez les animaux (poisson, crustacés) et dans les graines (lin, chia), les noix et les huiles végétales. Les oméga-3 induisent une réduction des particules athérogènes (VLDL, triglycérides) et semblent améliorer la résistance à l’insuline.31 Une méta-analyse de 22 études randomisées contrôlées incluant 1366 patients avec une stéatose hépatique montrait une amélioration de la stéatose hépatique chez les patients prenant un traitement aux oméga-3 en comparaison au placebo, mais uniquement chez les patients évalués par ultrason hépatique. Cette différence n’était pas retrouvée lorsque les lésions étaient évaluées par histologie, probablement en raison de la durée des études insuffisante pour observer des différences histologiques.30 De plus, on retrouvait une diminution significative du cholestérol total, des triglycérides et du BMI et une augmentation des particules HDL chez les patients sous supplémentation d’oméga-3.30 Les auteurs retrouvent néanmoins une hétérogénéité importante entre les études notamment sur la durée du traitement et le type d’acides gras polyinsaturés (proportion d’EPA/DHA) utilisé.30 La supplémentation en oméga-3 semble également avoir un impact sur le taux des transaminases.30,31 Certaines études ont montré un risque augmenté de fibrillation auriculaire sous traitement aux oméga-3 mais cela reste controversé.32
Vitamine E
La vitamine E fait partie des vitamines liposolubles qui ont un effet antioxydant, anti-inflammatoire et anti-athérogène.6,31 Dans les modèles animaux sous supplémentation en vitamine E, on retrouvait une diminution de la stéatose, de l’inflammation et de l’activation des cellules hépatiques stellaires.31 L’étude PIVENS a montré une amélioration significative de la stéatose hépatique, de l’inflammation histologique sans changement sur la fibrose chez des patients traités par 800UI/j de vitamineE, pendant 96 jours, en comparaison au placebo.6 Une dose de ≥400UI/j pourrait être associée à une augmentation de la mortalité selon une méta-analyse6 bien que cela n’ait pas été retrouvé dans une autre large méta-analyse avec une dose de ≥5500UI/j.31 On retrouvait également un risque augmenté de cancer prostatique chez les hommes >50ans1,5 et d’AVC hémorragique.31 Ce traitement est donc réservé aux sujets non diabétiques avec une biopsie prouvant la présence d’une MASLD, à court terme, selon l’EASL et l’ASSLD.1
Les polyphénols
Le curcumin
Le curcumin appartient à la famille des polyphénols et est connu pour ses effets anti-inflammatoires et antioxydants.31 Son effet bénéfique sur la MASLD pourrait être en lien avec une modification du microbiote induisant une diminution de la perméabilité de la barrière intestinale et donc une diminution de l’inflammation chronique systémique. Le désavantage réside dans le fait qu’il faut une dose très importante de curcumin quotidienne pour avoir un effet métabolique sur la MASLD notamment en raison d’une biodisponibilité faible du curcumin naturel.31
Resvératrol
Le resvératrol, un polyphénol naturel, concentré dans la peau du raisin et des baies, exercerait des effets vasoprotecteurs et antioxydants.31 Dans les études in vitro, on observait une réduction de la progression de la fibrose hépatique.31 Néanmoins, les études cliniques n’ont pas retrouvé d’effet bénéfique notamment sur la stéatose hépatique possiblement en lien avec le design des études.31
D’autres alicaments ont également montré une réduction de la sévérité de la MALSD mais présentent également une biodisponibilité orale faible.31
Les traitements
La pioglitazone est le seul médicament recommandé par les guidelines pour le traitement de la MASLD chez les patients diabétiques.33 En effet, ce traitement a montré une amélioration de la stéatose hépatique et des caractéristiques histologiques4,5 mais expose à de nombreux effets secondaires tels qu’une prise pondérale, une rétention de liquide, de fractures osseuses et une possible augmentation du risque de cancer de la vessie.5
Les analogues du GLP-1 montrent également de bons résultats avec une amélioration de la stéatose, de l’inflammation histologique, de la cytolyse (LEAD-2) et un plus haut taux de résolution histologique (LEAN) dans le groupe traité par analogues du GLP-1.1 Les traitements par un double agoniste (GIP et GLP-1), autorisés en Suisse depuis 2022, ont également été étudiés dans ce contexte. En 2024, une étude de phase 2, multicentrique, randomisée, contrôlée et en double aveugle, incluant 190 patients atteints de NASH (par biopsie), de diabète de type 2 et d’une fibrose modérée à sévère, a été publiée.34 Les patients ont été randomisés pour recevoir le tirzépatide, un double agoniste du GLP-1/GIP, à des dosages différents ou un placebo pendant 52 semaines. À la fin du follow-up des biopsies hépatiques ont été réalisées.34 Les auteurs ont observé une résolution de la MASLD de 44% sans aggravation de la fibrose dans le groupe traité par 5mg/semaine, 56% dans le groupe traité par 10mg/semaine et 62% dans le groupe sous 15mg/semaine, par rapport à 10% dans le groupe placebo. Toutefois, la puissance statistique n’était pas suffisante pour évaluer l’évolution de la fibrose.34
Les hormones thyroïdiennes
L’hypothyroïdie est associée à la présence et la sévérité de la MASLD.3 Dans les modèles expérimentaux, l’administration exogène d’hormone T3 a montré une diminution de la stéatose hépatique via la régulation de l’expression de nombreuses protéines impliquées dans le métabolisme lipidique.35
Le resmetirom, un agoniste du TRH-β, semble être très prometteur. Une étude de phase III randomisée contrôlée et publiée en février 2024 a montré une résolution de la NASH et une amélioration de la fibrose chez certains patients traités par rapport au placebo. Le traitement est actuellement approuvé par la FDA mais non commercialisé en Suisse.
Les traitements avec des analogues du FGF-21 («fibroblast growth factor 21») ont également été étudiés. En effet, le FGF-21, régule le métabolisme des lipides et du glucose. Une étude randomisée contrôlée de 2023 comparant le placebo au pégozafermin a montré une amélioration de la fibrose. Des études de phases 3 sont en cours.36
Conclusion
En conclusion, un dépistage des patients à risque et la stratification du risque de fibrose de manière précoce est essentiel pour la prise en charge de la MASLD. Les armes thérapeutiques actuelles reposent sur la modification de l’hygiène de vie. De nombreuses perspectives émergent concernant le rôle des alicaments et de nouvelles molécules innovantes, qui ne sont pas encore validées dans les guidelines actuelles (Fig. 1). Il est essentiel de considérer la MASLD comme une manifestation supplémentaire des mécanismes sous-jacents des maladies métaboliques, et de considérer l’augmentation du risque d’événements cardiovasculaires, de morbidité et de mortalité avec cette pathologie.37
Littérature:
1 Barigou M et al.: Rev Med Suisse 2020; 16: 586-91 2 Villeret F et al.: Clin Res Hepatol Gastroenterol 2022; 46: 101759 3 Karim G, Bansal MB: touchREV Endocrinol 2023; 19: 60-70 4 EASL et al.: J Hepatol 2016; 64: 1388-402 5Powell EE et al.: Lancet 2021; 397: 2212-24 6 Pouwels S et al.: BMC Endocr Disord 2022; 22: 63 7 Younossi Z et al.: Nat Rev Gastroenterol Hepatol 2018; 15: 11-20 8 Rinella ME et al.: J Hepatol 2023; 79: 1542-56 9 He K et al.: Br J Nutr 2020; 124: 1-13 10 Loomba R et al.: Cell 2021; 184: 2537-64 11 Trauner M, Fuchs CD: Gut 2022; 71: 194-209 12 Loomba R et al.: Cell 2021; 184: 2537-64 13 Ha S et al.: Gut 2025; 74: 141-52 14 American Diabetes Association: Diabetes Care 2019; 42 (Suppl 1): 34-4515 Torres L et al.: Ann Hepatol 2023; 28: 100774 16George ES et al.: Adv Nutr 2018; 9: 30-40 17 Semmler G et al.: Liver Int Off J Int Assoc Study Liver 2021; 41: 2249-68 18 Thoma C et al.: J Hepatol 2012; 56: 255-66 19 Bischoff SC et al.: Clin Nutr 2020; 39: 3533-62 20 Sripongpun P et al.: J Clin Transl Hepatol 2022; 10: 730-9 21Abenavoli L et al.: Nutrients 2017; 9: 870 22 Dornas WC et al.: Adv Nutr 2015; 6: 729-37 23 Jensen T et al.:J Hepatol 2018; 68: 1063-75 24Jung S et al.: Annu Rev Nutr 2022; 42: 45-66 25 Simons N et al.: Am J Clin Nutr 2021; 113: 391-400 26 Luukkonen PK et al.: Proc Natl Acad Sci U S A 2020; 117: 7347-54 27 Meex RCR, Blaak EE: Mol Nutr Food Res 2021; 65: e1900942 28 Assy N et al.: World J Gastroenterol 2009; 15: 1809 29 Federal Food Safety and Veterinary Office (FSVO): Swiss dietary recommendations. 2024. Short version. https://www.blv.admin.ch/dam/blv/en/dokumente/lebensmittel-und-ernaehrung/ernaehrung/Ernaehrungsempfehlungen/Schweizer%20Ern%C3%A4hrungsempfehlungen_Kurzversion_EN.pdf.download.pdf 33 Lee CH et al.: Nutrients 2020; 12: 2769 31 Rizzo M et al.: Pharmacol Res 2023; 189: 106679 32Huh JH, Jo SH: Korean J Intern Med 2023; 38: 282-9 33 Cusi K: Liver Int 2020; 40 (Suppl 1): 82-8 34Loomba R et al.: N Engl J Med 2024; 391: 299-310 35 Kowalik MA et al.: Front Endocrinol 2018; 9: 382 36Loomba R et al.: . N Engl J Med 2023; 389: 998-1008 37 Sanyal AJ et al.: N Engl J Med 2010; 362: 1675-85
Das könnte Sie auch interessieren:
Nouvelle époque, nouveaux pollens?
Le changement climatique, avec l’augmentation du CO2, la hausse des températures et la modification du régime des précipitations, influence la concentration, l’allergénicité et la la ...
Nouvelles données sur l’apparition de lymphopénies liées aux principes actifs
Le champ thérapeutique de la sclérose en plaques (SEP) a considérablement évolué au cours des dernières décennies grâce au développement de traitements de fond efficaces. Outre les ...
Nouvelles directives et un puissant inhibiteur de BCR-ABL1Extension de l’autorisation de mise sur le marché du dostarlimab plus chimiothérapie
Les recommandations de l’ELN sur la prise en charge de la LMC seront mises à jour en 2025. L’asciminib, un inhibiteur allostérique sélectif ciblant la poche myristoylée de BCR-ABL1, a ...