Neues aus klinischen Studien und exploratorischen Analysen
Bericht:
Dr. Judith Moser
Mehr als 3000 Teilnehmer*innen hatten am online und in Kopenhagen abgehaltenen European Lung Cancer Congress 2023 Gelegenheit, sich über Präventions-, Screening- und Behandlungskonzepte beim Lungenkarzinom und anderen thorakalen Tumoren auszutauschen. Im Folgenden sind ausgewählte Studiendaten zu den Effekten aktueller Therapien bei Patient*innen mit Lungenkarzinom sowie Einblicke aus der Biomarkerforschung zusammengefasst.
Frühstadium: prä- & perioperative Immuntherapie
Die randomisierte Phase-III-Studie CheckMate 816 evaluiert den neoadjuvanten Einsatz des PD1-Inhibitors Nivolumab in Kombination mit platinbasierter Chemotherapie bei Patient*innen mit resektablem nicht kleinzelligem Lungenkarzinom (NSCLC). Laut Primäranalyse resultierten gegenüber der alleinigen Chemotherapie statistisch signifikante und klinisch relevante Verbesserungen im Bereich von ereignisfreiem Überleben (EFS) und pathologischer Komplettremission.1 Gemäß dem am ELCC 2023 präsentierten Dreijahres-Update bewirkte das Kombinationsschema weiterhin klare Vorteile.2 Nach 36 Monaten beliefen sich die EFS-Raten auf 57% vs. 43%, und das mediane EFS war im Prüfarm noch nicht erreicht worden (vs. 21,1 Monate; HR: 0,68). Fast alle Subgruppen profitierten von der Zugabe des PD-1-Antikörpers. Der Benefit trat unabhängig von Art und Umfang der Operation zutage, und auch bei R0-Resektion schnitt der experimentelle Arm mit Dreijahres-EFS-Raten von 64% vs. 51% besser ab (HR: 0,65).
Unter der Immunchemotherapie resultierte eine niedrigere Inzidenz an Fernmetastasen (10% vs. 22%) mit einer geringeren ZNS-Befallsrate (4% vs. 13%). Die Zeitspanne bis zur Fernmetastasierung war verlängert (nicht erreicht vs. 34,3 Monate; HR: 0,55). Für das Gesamtüberleben (OS) fand sich nach 36 Monaten ein vielversprechender Trend (78% vs. 64%; HR: 0,62). Insgesamt untermauern die Daten die Bedeutung von Nivolumab plus Chemotherapie als neoadjuvantes Standardschema.
Die perioperative Gabe des PD-L1-Inhibitors Atezolizumab wurde in der offenen, einarmigen Phase-II-Studie LCMC3 untersucht. Zwei Atezolizumab-Zyklen waren von der Operation und anschließend einer Radiotherapie und/oder adjuvanten Chemotherapie gefolgt. Optional konnte adjuvantes Atezolizumab für 12 Monate zur Anwendung gelangen. Nachdem der primäre Endpunkt in Form einer „major pathological response“ (MPR) von 20% bereits erreicht worden war,3 stellten Carbone et al. in ihrer exploratorischen Analyse Benefits der adjuvanten Atezolizumab-Gabe fest.4 Sowohl in der Population mit MPR als auch jener ohne MPR fielen krankheitsfreies Überleben und Gesamtüberleben zumindest tendenziell besser aus als in der Gruppe, die kein adjuvantes Atezolizumab erhalten hatte. Die zusätzliche systemische Behandlung zeigte eine hohe Verträglichkeit ohne neue Sicherheitssignale. Den Autor*innen zufolge bedingte adjuvantes Atezolizumab bessere Ergebnisse als erwartet, weshalb die perioperative Immuntherapie Gegenstand weiterer Untersuchungen sein könnte.
Fortgeschrittene Tumoren
TRUST-I: Taletrectinib
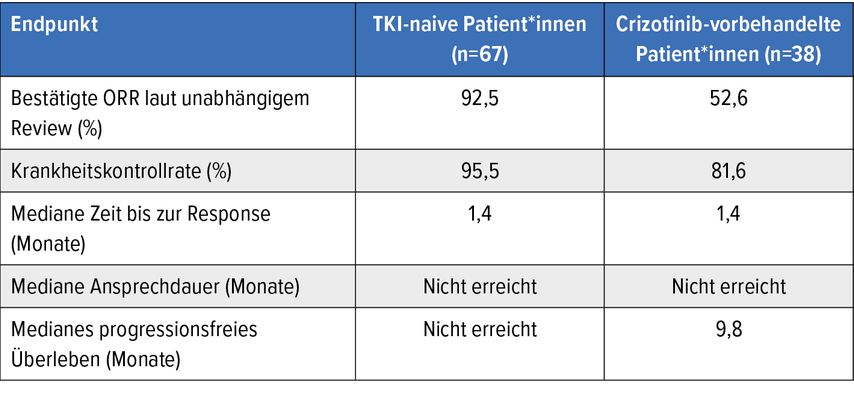
Taletrectinib, ein potenter ROS1-Tyrosinkinaseinhibitor (TKI) der nächsten Generation, wurde im Rahmen der Phase-II-Studie TRUST-I bei Patient*innen mit lokal fortgeschrittenem oder metastasiertem NSCLC und ROS1-Fusion evaluiert.5 ROS1-TKI-naive (n=67) und Crizotinib-vorbehandelte Patient*innen (n=42) erhielten Taletrectinib 600mg/d. Als primärer Endpunkt galt die bestätigte Gesamtansprechrate (cORR) laut unabhängigem Review.
Vor allem in der TKI-naiven Gruppe wurden beeindruckende Ergebnisse mit einer cORR von 92,5% und einer Krankheitskontrollrate (DCR) von 95,5% erreicht (Tab. 1). Vorbehandelte Patient*innen erzielten eine cORR von 52,6% und eine DCR von 81,6%. Bei Vorliegen von sekundären Resistenzmutationen erwies sich die Therapie mit Taletrectinib als effektiv; die Ansprechrate im Kollektiv mit G2032R-Mutation lag bei 80%. Ebenso konnte die ZNS-Aktivität des neuen TKI überzeugen. In der Gruppe mit messbaren Hirnmetastasen (n=12) betrug die intrakranielle ORR 91,7% und die intrakranielle DCR 100%. Gepoolte Daten aus beiden Teilen der Studie inklusive der Dosisfindungsphase zeigen ein medianes progressionsfreies Überleben (PFS) von 33,2 Monaten bei den TKI-Naiven und 11,8 Monaten bei den Crizotinib-Vorbehandelten.
Tab. 1: Effektivität von Taletrectinib beim ROS1-positiven fortgeschrittenen NSCLC. Modifiziert nach Li W et al.5
Unter der Therapie auftretende Nebenwirkungen wurden überwiegend als Grad 1 oder 2 eingestuft und erwiesen sich als transient und reversibel. Toxizitäten machten Dosisreduktionen in 20,2% und Therapiebeendigungen in 5,1% erforderlich. Aktuell befindet sich die pivotale Phase-II-Studie TRUST-II, die Taletrectinib beim ROS1-positiven NSCLC und anderen soliden Tumoren untersucht, weltweit im Laufen.
Tusamitamab-Ravtansin plus IO und Immunchemotherapie
Das Adhäsionsmolekül CEACAM5 wird bei bis zu 25% der Patient*innen mit nicht-squamösem NSCLC hochgradig auf der Zelloberfläche exprimiert.6,7 Tusamitamab-Ravtansin, der erste Vertreter der gegen CEACAM5 gerichteten Antikörper-Wirkstoffkonjugate, wird in der Phase-II-Studie CARMEN-LC05 bei unbehandelten Patient*innen mit fortgeschrittenem nicht-squamösem, CEACAM5-positivem NSCLC evaluiert. Dabei erfolgt die gemeinsame Gabe von Tusamitamab-Ravtansin 150 oder 170mg/m2 alle 3 Wochen entweder mit Pembrolizumab alleine, mit Pembrolizumab plus Platin oder mit Pembrolizumab, Platin und Pemetrexed. Insgesamt erhalten 25 Patient*innen eines der drei Schemen. Die dosislimitierende Toxizität bildet den primären Endpunkt. Paz-Ares et al. stellten die ersten Ergebnisse der Studie am ELCC 2023 vor.8
Hinsichtlich der Wirksamkeit zeigte das Antikörper-Wirkstoffkonjugat vielversprechende Effektivität. Über alle Therapieschemen und Dosislevels hinweg konnte eine bestätigte ORR von 52% und eine DCR von 88% generiert werden. Ein Ansprechen resultierte unabhängig von CEACAM5- und PD-L1-Expression. Unter den Toxizitäten dominierten Übelkeit und Diarrhö. Auffällig war eine Häufung von Nebenwirkungen im Bereich der Hornhaut (24%), die mittels Dosismodifikation beherrscht werden konnten. In einem Fall kam es zur Entstehung einer Grad-3-Keratitis, ansonsten traten keine höhergradigen molekularen Toxizitäten auf. Pneumonitiden/interstitielle Lungenerkrankungen wurden in 16% dokumentiert (Grad 3: 4%), periphere Neuropathien in 28% (ausschließlich Ereignisse der Grade 1 und 2).
Upfront-Osimertinib vs. Sequenz: APPLE
Die Phase-II-Studie APPLE war unter anderem darauf ausgelegt, die Durchführbarkeit eines seriellen Monitorings der EGFR(Epidermaler Wachstumsfaktor)-Resistenzmutation T790M mittels zirkulierender Tumor-DNA (ctDNA) unter dem Erstgenerations-EGFR-TKI Gefitinib bei Patient*innen mit EGFR-mutiertem fortgeschrittenem NSCLC nachzuweisen. Tatsächlich gab eine molekulare Progression laut ctDNA in 17% der Fälle noch vor der Manifestation einer Progression laut RECIST Anlass zu einem frühen Switch auf die Zweitlinientherapie mit Osimertinib.9 Im Kontrollarm kam Gefitinib ebenfalls zur Anwendung, wurde aber erst bei RECIST-Progression auf Osimertinib umgestellt.
Der dritte Arm der Studie erhielt Osimertinib 80mg/d von Beginn an bis zur Progression laut RECIST. Am ELCC 2023 präsentierten Remon et al. die Ergebnisse zum Upfront-Einsatz von Osimertinib (n=53) im Vergleich zur sequenziellen Strategie, wobei zu diesem Zweck die beiden primär mit Gefitinib behandelten Arme gepoolt wurden (n=103).10 82% der Patient*innen in der sequenziellen Therapiegruppe waren nach Eintreten der Progression auf Osimertinib geswitcht worden.
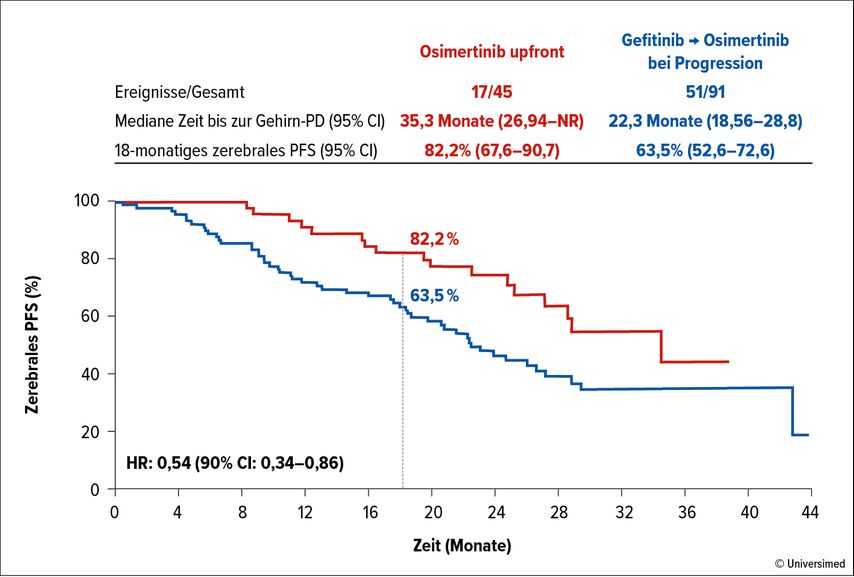
Der Analyse zufolge unterschieden sich die beiden Therapieansätze weder in Bezug auf das OS (nicht erreicht vs. 42,8 Monate; HR: 1,01) noch im Hinblick auf das PFS (19,5 vs. 21,39 Monate; HR: 0,87). Nach 18 Monaten lebten 84,4% vs. 82,3% der Patient*innen. Auch die Subgruppenanalyse erbrachte hinsichtlich des OS kein klares Signal. Eindeutig überlegen erwies sich Osimertinib im Zusammenhang mit dem zerebralen PFS (82,2% vs. 63,5% nach 18 Monaten; HR: 0,54; Abb. 1), wobei bekannt ist, dass sich die ZNS-Aktivität von Gefitinib in Grenzen hält. Als früher prognostischer Marker wurde die ctDNA-Clearance nach 4 bzw. 8 Wochen identifiziert; das Persistieren von EGFR-Mutationen unter einer TKI-Gabe könnte zur Selektion der Gruppe beitragen, die von einer Therapieeskalation profitiert.
Abb. 1: APPLE-Studie: PFS im Gehirn bei NSCLC-Patient*innen unter Osimertinib „upfront“ verglichen mit der sequenziellen Strategie. Modifiziert nach Remon J et al.10
PROs aus CodeBreaK 200
Die randomisierte Phase-III-Studie CodeBreaK 200 etablierte Sotorasib 960mg/d als überlegene Option vs. Docetaxel beim fortgeschrittenen KRASG12C-mutierten NSCLC nach mindestens einer Vortherapie.11 Als einer der sekundären Endpunkte der Untersuchung waren die „patient-reported outcomes“ (PROs) definiert, die von Waterhouse et al. am ELCC 2023 vorgestellt wurden.12
Sotorasib-behandelte Patient*innen gaben im Vergleich zum Kollektiv unter Chemotherapie eine geringere Beeinträchtigung durch die Nebenwirkungen an. Schmerzen im Allgemeinen sowie Muskel- und Gelenkschmerz zeigten eine geringere Ausprägung und beeinflussten tägliche Aktivitäten weniger als Docetaxel; gleichzeitig bestand eine ähnliche Symptomhäufigkeit. Signifikante Verbesserungen resultierten im Prüfarm in den Bereichen Mobilität, Selbstversorgung und der Fähigkeit, die üblichen Aktivitäten durchzuführen. Insgesamt blieb die Lebensqualität unter der zielgerichteten Therapie stabil, während sie sich unter Docetaxel verschlechterte.
Neues zu Biomarkern
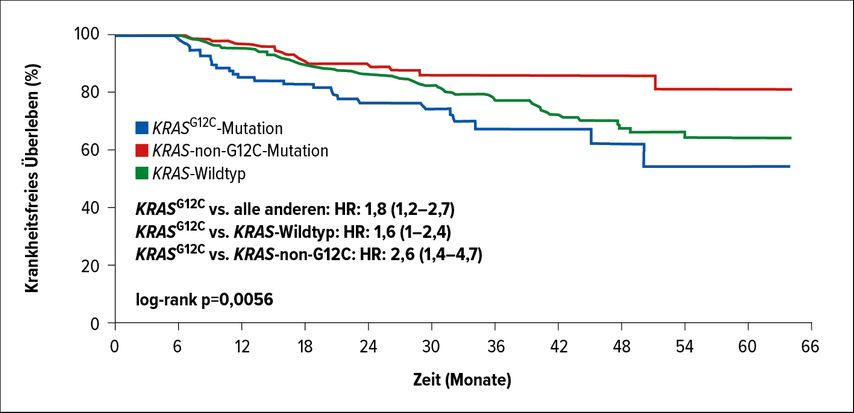
KRAS-Mutationen finden sich bei 20–40% der Lungenkarzinome, wobei die G12C-Variante mit ca. 13% dominiert.13 Auch nach der Resektion eines frühen NSCLC im Stadium I beeinflusst das genetische Setup die Prognose, wie retrospektive Daten vor Augen führen.14 Bei Vorliegen einer KRASG12C-Mutation verkürzte sich das krankheitsfreie Überleben im Vergleich zu Patient*innen mit einem anderen KRAS-Mutationssubtyp, einem KRAS-Wildtyp oder anderen Tumoren (Abb. 2).
Abb. 2: Krankheitsfreies Überleben nach Resektion im Stadium I in Abhängigkeit vom KRAS-Mutationsstatus. Modifiziert nach Marinelli D et al.14
Gemäß der retrospektiven Analyse von Rubio-Novella et al. könnte die TP53-Mutation in Abhängigkeit von der PD-L1-Expression als Marker für die Behandlungsentscheidung beim metastasiertem NSCLC herangezogen werden.15 68 Patient*innen, die in der Erstlinie eine Chemoimmuntherapie oder Immuntherapie erhielten, wurden retrospektiv ausgewertet. TP53-Mutationen fanden sich in dieser Gruppe in 34,3%. Bei Vorliegen einer TP53-Mutation bestand ein Trend zu einer OS-Verlängerung (18,4 vs. 7,3 Monate bei TP53-Wildtyp; HR: 0,50; p=0,058). Wenn die PD-L1-Expression gleichzeitig 50% unterschritt, wurde der OS-Benefit signifikant (18,4 vs. 6,9 Monate; HR: 0,44; p=0,043). Dagegen beeinflusste der Mutationsstatus in der Gruppe mit hoher PD-L1-Expression ≥50% das Überleben nicht. Eine prospektive Validierung dieser Beobachtung ist erforderlich, wie die Autor*innen festhalten.
Der Effekt der PD-L1-Expression auf die Outcomes stand auch im Fokus der POET-Studie, deren erste Ergebnisse am ELCC 2023 präsentiert wurden.16 Anhand der Daten von 171 EGFR-TKI-behandelten Patient*innen mit EGFR-positivem fortgeschrittenem NSCLC konnten die Wissenschaftler*innen in einer multizentrischen retrospektiven Analyse den negativen prognostischen Effekt einer hohen PD-L1-Expression demonstrieren. Bei PD-L1-Werten ≥50% war das PFS unter Erst- und Zweitgenerations-TKIs (Erlotinib/Gefitinib/Afatinib) sowie dem Drittgenerations-TKI Osimertinib kürzer (8,0 bzw. 10,2 Monate) als bei PD-L1-Werten <50% (15,4 bzw. 23,6 Monate). Unabhängig von der PD-L1-Expression zeigte Osimertinib signifikante PFS-Überlegenheit verglichen mit den anderen Therapien. Das mediane OS unterschied sich auch bei hoher PD-L1-Expression zugunsten von Osimertinib (31,3 vs. 24,9 Monate; p=0,03). Aktuell wird der Datenpool laufend erweitert, und aktualisierte Analysen werden in Bälde erwartet.
Quelle:
European Lung Cancer Congress 2023, 29. März – 1. April 2023, Kopenhagen
Literatur:
1 Forde PM et al.: N Engl J Med 2022; 386(21): 1973-85 2 Forde PM et al.: ELCC 2023; Abstr. #84O 3 Chaft JE et al.: Nature Med 2022; 28(10): 2155-61 4 Carbone DP et al: ELCC 2023; Abstr. #145MO 5 Li W et al.: ELCC 2023; Abstr. #14MO 6 Decary S et al.: Clin Cancer Res 2020; 26(24): 6589-99 7 Adam J et al.: Ann Oncol 2021; 32(Suppl 7): S1381 8 Paz-Ares L et al.: ELCC 2023; Abstr. #13MO 9 Remon J et al.: Ann Oncol 2023; S0923-7534(23)00089-3 10 Remon J et al.: ELCC 2023; Abstr. #1O 11 de Langen AJ et al.: Lancet 2023; 401(10378): 733-46 12 Waterhouse D et al.: ELCC 2023; Abstr. #4O 13 AACR Project GENIE Consortium: Cancer Discov 2017; 7(8): 818-31 14 Marinelli D et al: ELCC 2023; Abstr. #86P 15 Rubio-Novella S et al.: ELCC 2023; Abstr. #70P 16 Belluomini L et al.: ELCC 2023; Abstr. #23P