Highlights zum multiplen Myelom
Autor:
Univ.-Prof. Dr. Heinz Ludwig
Wilhelminenkrebsforschungsinstitut
1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin
Klinik Ottakring, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nie zuvor hat es so viele Updates und Innovationen zur zellulären Immuntherapie beim multiplen Myelom gegeben wie beim diesjährigen Meeting der American Society of Hematology (ASH). ImFolgenden finden Sie eine kurze Zusammenfassung der aus meiner Sicht besonders bemerkenswerten Präsentationen.
First-Line-Therapie
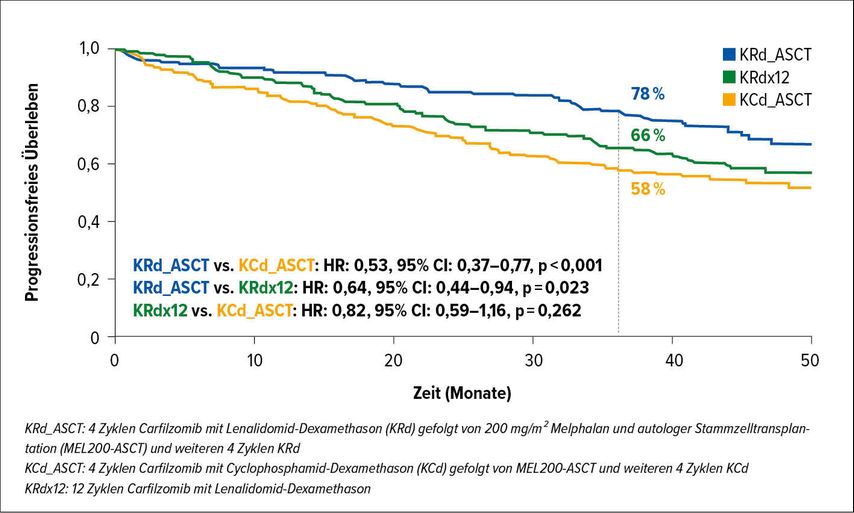
Francesca Gay berichtet über ein Update ihrer dreiarmigen FORTE-Studie, in der 4 Zyklen Carfilzomib plus Cyclophosphamid-Dexamethason (KCd) oder Carfilzomib plus Lenalidomid-Dexamethason (KRd), jeweils gefolgt von Transplantation und nochmals 4 Zyklen Konsolidierungstherapie, mit 12 Zyklen KRd (ohne Transplantation) verglichen wurden.Nach Beendigung der Induktionsphase wurden die Patienten in einen Erhaltungstherapiearm mit Carfilzomib-Lenalidomid bzw. Lenalidomid-Monotherapie randomisiert. Die Rate des progressionsfreien Überlebens (PFS) nach 3 Jahren lag im KRd-Transplantationsarm bei 78%, im KRdx12-Arm bei 66% und im KCd-Transplantationsarm bei 58% (Abb.1). Dementsprechend fand sich eine Negativitätsrate in Bezug auf minimale Resterkrankung (MRD)von 68%, 54% bzw. 45% in den 3 Therapiegruppen. So zeigte das erste Zwischenergebnis eine deutliche Überlegenheit von KRd gegenüber KCd, was letztendlich zur Elimination von Cyclophosphamid als Kombinationspartner für die Erstlinientherapie bei jüngeren Patienten führen sollte. Weiters konnte durch die Studienergebnisse der Stellenwert der Transplantation untermauert werden, sodass die Hochdosistherapie nicht nur bei Patienten mit Hochrisiko-Zytogenetik, sondern auch für Standardrisiko-Patienten entscheidende Vorteile bringt. Ein weiteres wichtiges Ergebnis ist der Nachweis einer signifikanten Verlängerung des progressionsfreien Überlebens durch Kombination von Carfilzomib mit der Standard-Erhaltungstherapie Lenalidomid, was mit einer Erhöhung der MRD-Negativitätsrate bei guter Therapietoleranz verbunden war.1
Abb. 1: Vergleich des progressionsfreien Überlebens unter KRd_ASCT, KRdx12 und KCd_ASCT in der FORTE-Studie (nach Gay et al.)1
Michele Cavo präsentierte die LangzeitFollow-up-Daten der EMN02/HO95-Studie, die in der ersten Randomisation eine autologe Transplantation mit Bortezomib-Melphalan-Prednison (VMP) verglich. Nach langem Follow-up zeigte sich für die Transplantationsgruppe ein signifikanter Überlebensvorteil, allerdings muss man hier berücksichtigen, dass die konventionelle Induktionstherapie mit VMP heute nicht als optimaler Standard für diese Patientengruppe angesehen wird. Weitere Analysen zeigten eine verlängerte Zeit bis zum Progress/Tod unter der ersten Folgetherapie (PFS2) und eine verlängerte Zeit bis zur nächsten Behandlung in der Therapiegruppe mit sofortiger Transplantation. Patienten, die nach konventioneller Chemotherapie eine Rescue-Transplantation erhielten, wiesen ein kürzeres PFS2 als jene auf, die initial transplantiert wurden.2
Weiters wurde von Jonathan Kaufman ein Follow-up (median 27,4 Monate) der GRIFFIN-Studie präsentiert, in der Patienten Bortezomib, Lenalidomid und Dexamethason (VRd) oder VRd plus Daratumumab (4 Zyklen Induktion, danach eine autologe Stammzelltransplantation [ASCT], 4 Zyklen Konsolidierung und danach Daratumumab-Lenalidomid bzw. Lenalidomid als Erhaltungstherapie) erhielten. Diese zeigten ein tieferes Ansprechen mit einer kompletten Remissionsrate von 81,8% in der Daratumumab-VRd-Kombinationsgruppe im Vergleich zu 60,8% in der VRd-Gruppe. Dementsprechend lagen die MRD-Negativitätsraten bei 62,5% und 27,2%, was letztlich zu einer tendenziellen Verlängerung des PFS bei derzeit noch fast überlappenden Gesamtüberlebenskurven führte.3
First-Line-Therapie bei älteren (nicht für eine Transplantation geeigneten) Patienten
Thierry Facon hat die TOURMALINE-MM2-Studie vorgestellt, in der für eine Transplantation ungeeignete Patienten entweder mit dem Standard-Lenalidomid-Dexamethason-Regime oder mit der Tripel-Kombination Ixazomib-Lenalidomid-Dexamethason behandelt wurden. Insgesamt wurden 805 Patienten eingebracht. Mit der Tripel-Kombination konnte keine höhere Ansprechrate (82,1% vs. 79,7%) erzielt werden, allerdings fand sich in der Gruppe mit Ixazomib-Therapie eine höhere Rate von vollständigem bzw. stringent vollständigem Ansprechen (CR/sCR) (25,6% vs. 14,1%) sowie von mindestens sehr gutem partiellem Ansprechen (VGPR) (63,0% vs. 47,7%). Das progressionsfreie Überleben war numerisch unter Ixazomib-Rd deutlich länger (median 35,3 vs. 21,8 Monate); dieser Unterschied war allerdings nicht statistisch signifikant.4
Sehr beeindruckend war auch die Vorstellung der Langzeit-Follow-up-Daten der MAIA-Studie durch Shaji Kumar. Im Daratumumab-Rd-Arm wurde nach einem medianen Follow-up von 47,9 Monaten der Median des PFS noch nicht erreicht, allerdings wurde auch in der Rd-Kontrollgruppe ein exzellentes Ergebnis mit einem PFS von im Median 34 Monaten erzielt. Klinisch relevant ist auch der beobachtete Nutzen bei Hochrisiko-Patienten (PFS 45,3 vs. 29,6 Monate). Somit ist bei älteren Patienten Daratumumab-Rd als neue Standardtherapie anzusehen.5
Therapieansätze für Patienten mit relapsierter/refraktärer Erkrankung
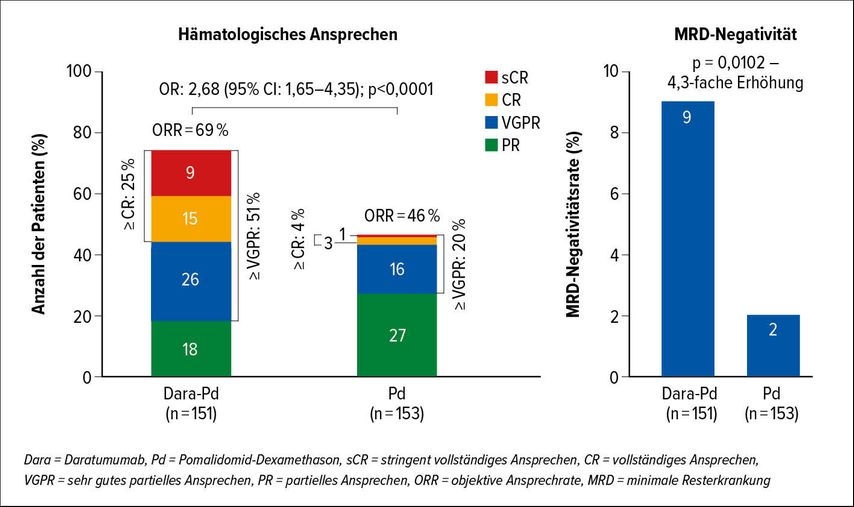
Meletios Dimopoulos präsentierte die APOLLO-Studie, in die Patienten mit 1–3 Vortherapien eingeschlossen wurden und entweder in eine Gruppe mit Daratumumab-Pomalidomid-Dexamethason oder eine Gruppe mit Pomalidomid-Dexamethason randomisiert wurden. Daratumumab wurde in dieser Studie bereits in Form einer 5-minütigen subkutanen Injektion appliziert. Erwartungsgemäß führte die Antikörperkombination zu einem signifikanten Vorteil in allen entscheidenden Ansprechkriterien wie Ansprechrate (69% vs. 46%) und MRD-Negativität (9% vs. 2%; Abb. 2). Das PFS wurde durch die Kombination mit Daratumumab von 6,9 Monaten auf 12,4 Monate verlängert, wobei das mediane PFS bei Patienten, die auf Lenalidomid refraktär waren, mit der Tripel-Kombination bei 9,9 Monaten lag. Der Vorteil der Tripel-Kombination war in den meisten Subgruppen zu beobachten, mit Ausnahme von Patienten mit Hochrisiko-Zytogenetik und Patienten, die refraktär auf Lenalidomid waren. Interessanterweise profitierten Patienten mit mehr als 2 Vortherapien besonders von der Kombination.6
Abb. 2: Vergleich der Ansprechraten von Dara-Pd mit Pd in der APOLLO-Studie (nach Dimopoulos et al.)⁶
Michael Sebag präsentierte eine interessante randomisierte Phase-II-Studie, in der subkutan verabreichtes Daratumumab mit wöchentlich verabreichtem Cyclophosphamid und Dexamethason mit und ohne Pomalidomid bei Patienten mit mehr als einer Vortherapie verglichen wurde. Mit der Kombination wurde eine Erhöhung der Gesamtansprechrate auf 88,6% erzielt, im Vergleich zur Tripel-Kombination mit 50,6%. Beachtenswert war auch der Unterschied im progressionsfreien Überleben, welches in der Vierfach-Kombinations-Gruppe bei 25,3 Monaten und in der Tripel-Kombinations-Gruppe nur bei 8,9 Monaten lag. Mehrere Patienten, die in der Tripel-Kombinations-Gruppe progredient wurden, erhielten nach Progress zusätzlich Pomalidomid, wodurch in dieser Gruppe das PFS auf 20,9 Monate angehoben werden konnte. Allerdings wurde durch die Kombination mit Pomalidomid die Infektionsrate deutlich erhöht.7
Das Update der IKEMA-Studie, in der Isatuximab-Kd mit Carfilzomib plus Dexamethason (Kd) bei Patienten mit 1–3 Vortherapien verglichen wurde, stellte Thomas Martin vor. Folgende Ergebnisse wurden berichtet: Gesamtansprechrate 92,9% vs. 86,6%, ≥CR 39,7% vs. 27,6% und MRD-Negativität 29,6% vs. 13,6%. Das mediane PFS wurde in der Isatuximab-Kd-Gruppe noch nicht erreicht, lag aber deutlich über jenem der Kontrollgruppe. Die Hazard-Ratio lag für MRD-negative Patienten bei 0,578 und für MRD-positive Patienten bei 0,670. Zusätzlich durchgeführte Massenspektrometrie-Analysen lassen vermuten, dass die Zahl an Patienten mit kompletter Remission in der Isatuximab-Gruppe aufgrund einer durch Isatuximab bedingten monoklonalen Bande unterschätzt wurde.8
Meletios Dimopoulos berichtete auch über die CANDOR-Studie, in der Patienten auf Daratumumab-Carfilzomib-Dexamethason vs. Carfilzomib-Dexamethason randomisiert wurden. Die Patienten hatten 1–3 Vortherapien und zeigten unter der Tripel-Kombination erwartungsgemäß weitaus höhere Ansprechraten und insbesondere ein um mehr als ein Jahr längeres PFS, welches in der Tripel-Kombinations-Gruppe 28,6 Monate und in der Kd-Gruppe 15,2 Monate betrug (Hazard-Ratio: 0,59). Erstaunlicherweise war die Kombination Daratumumab-Kd bei Patienten, die Lenalidomid-refraktär waren, besonders aktiv, mit einer Hazard-Ratio von 0,46.9
Philippe Moreau konnte durch die PLEIADES-Studie belegen, dass subkutan appliziertes Daratumumab als Standardverabreichung zu betrachten ist, womit die zeit- und ressourcenaufwendige intravenöse Daratumumab-Infusionstherapie der Vergangenheit angehören sollte. In der genannten Studie wurde Daratumumab subkutan in drei Studienarmen entweder in Kombination mit VMP, Rd oder Kd verabreicht. Kd wurde am Tag 1 des ersten Zyklus in einer Dosis von 20mg/m2 und danach in einer Dosis von 70mg/m2 wöchentlich appliziert. Da die erhobenen Resultate mit jenen der CANDOR-Studie fast deckungsgleich sind, kann eine gleiche Wirkung von intravenös bzw. subkutan appliziertem Daratumumab angenommen werden.10
Isatuximab bei Daratumumab-refraktären Patienten
In einer kleinen Serie von 15 Patienten wurde der Frage nachgegangen, ob nach Daratumumab-Versagen eine andere Anti-CD38-Antikörper-Kombination wirksam ist. In dieser kleinen Studie wurden Patienten mit 2–9 Vortherapien, von denen 89% zuvor auf eine Daratumumab-basierte Therapie angesprochen hatten, nach Progression mit Isatuximab in Kombination mit Pomalidomid-Dexamethason behandelt. Tatsächlich konnte bei 10 der 15mindestens ein minimales Ansprechen (MR) erreicht werden. Inwieweit hier das Isatuximab für den Therapieerfolg verantwortlich ist, kann durch diese Studie nicht beantwortet werden.11
T-Cell-Engager
Belantamab-Mafodotin ist ein „Bispecific T-Cell-Engager“ (BiTE), welcher über einen Linker an Monomethyl-Auristatin, einen Mikrotubulus-Inhibitor, verknüpft ist und über beachtliche Wirksamkeit bei umfangreich vorbehandelten Patienten verfügt. Allerdings ist die Therapie auch mit beträchtlicher Keratotoxizität verbunden. Diese lässt sich durch Verlängerung der Applikationsintervalle deutlich reduzieren. Mit der Kombination Belantamab-Mafodotin mit Bortezomib-Dexamethason wurde bei Patienten mit mehr als drei Vortherapien eine Ansprechrate von 78% inklusive einer VGPR berichtet. Die Keratopathie konnte durch Dosisanpassung bzw. Intervallverlängerung bei der Therapie mit Belantamab-Mafodotin gut kontrolliert werden.12
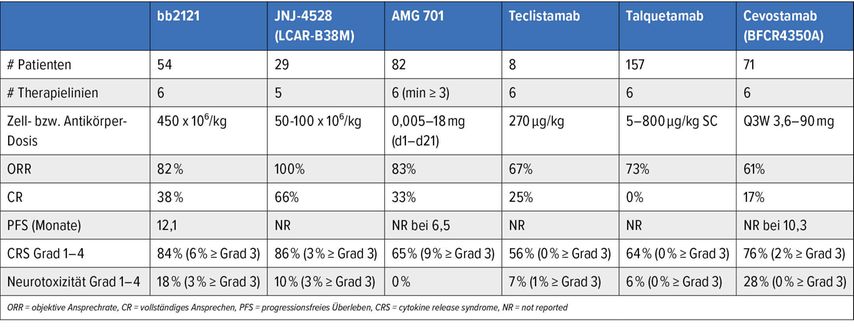
Erwähnenswert sind auch die Ergebnisse von weiteren in klinischer Erprobung befindlichen BiTEs. Dazu zählen unter anderen Teclistamab13, Talquetamab14, Cevostamab15 und AMG 701.16 Erste Ergebnisse zeigen Ansprechraten zwischen 61% und 83% bei umfangreich vorbehandelten Patienten. Als wesentlichste Nebenwirkung ist dabei das „cytokine release syndrome“ (CRS) zu erwähnen, welches allerdings nur in geringer Ausprägung (Grad 1 bzw. 2) beobachtet wurde. Ein Vergleich der Behandlungsergebnisse mit BiTEs und den unten angeführten CAR-T-Zell-Studien ist in Tabelle 1 angeführt.
CAR-T-Zellen
Im Fokus der wissenschaftlichen Präsentationen lagen die Ergebnisse mit verschiedenen CAR-T-Zell-Präparaten. Alle zeigen hohe Ansprechraten inklusive hoher MRD-Negativität auch bei umfangreich vorbehandelten Patienten. Die besten Ergebnisse wurden in der CARTITUDE-1-Studie beobachtet:17 Die Ansprechrate lag bei 97%, die Rate an MRD-negativen Befunden bei 57% und das PFS bei 12 Monaten. Fast ebenso gute Resultate wurden in der CRB-401-Studie mit bb2121 erzielt. Hier lag die optimale Dosis der CAR-T-Zellen bei 450x106/kg.18Als wichtige Komplikationen sind Neurotoxizität und CRS zu erwähnen, allerdings wurden Nebenwirkungen vom Grad 3 bzw. 4 nur bei 9,3% bzw. 4,1% der Patienten beobachtet. Für die Zukunft könnten die Versuche, allogene T-Zellen bzw. natürliche-Killer-Zellen als genmodifizierte Effektor-Zellen zu verwenden, zu einer entscheidenden Wende in Bezug auf Kosten und Verfügbarkeit führen, da solche „lebenden Medikamente“ im großen Stil hergestellt und fast jederzeit ohne Wartefrist zur Verfügung gestellt werden könnten. Jedenfalls konnte in der ALLO-715-Studie mit solchen allogenen CAR-T-Zellen bei 5 von 15 Patienten ein Ansprechen beobachtet werden.19
Literatur:
1 Gay F et al.: Survival analysis of newly diagnosed transplant-eligible multiple myeloma patients in the randomized FORTE trial. ASH-Meeting 2020; Abstr. #141 2 Cavo M et al.: Upfront autologous hematopoietic stem-cell transplantation improves overall survival in comparison with bortezomib-based intensification therapy in newly diagnosed multiple myeloma: long-term follow-up analysis of the randomized phase 3 EMN02/HO95 study. ASH-Meeting 2020; Abstr. #142 3 Kaufman JL et al.: Daratumumab (DARA) plus lenalidomide, bortezomib, and dexamethasone (RVD) in patients with transplant-eligible newly diagnosed multiple myeloma (NDMM): updated analysis of GRIFFIN after 12 months of maintenance therapy. ASH-Meeting 2020; Abstr. #549 4 Facon T et al.: The phase 3 TOURMALINE-MM2 trial: oral ixazomib, lenalidomide, and dexamethasone (IRd) vs placebo-Rd for transplant-ineligible patients with newly diagnosed multiple myeloma (NDMM). ASH-Meeting 2020; Abstr. #551 5 Kumar SK et al.: Updated analysis of daratumumab plus lenalidomide and dexamethasone (D-Rd) versus lenalidomide and dexamethasone (Rd) in patients with transplant-ineligible newly diagnosed multiple myeloma (NDMM): the phase 3 MAIA study. ASH-Meeting 2020; Abstr. #2276 6 Dimopoulos MA: APOLLO: Phase 3 randomized study of subcutaneous dara-tumumab plus pomalidomide and dexamethasone (D-Pd) versus pomalidomide and dexamethasone (Pd) alone in patients (PTS) with relapsed/refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr. #412 7 Sebag M et al.: A randomized phase II, open label, study of daratumumab, weekly low-dose oral dexamethasone and cyclophosphamide with or without pomalidomide in patients with relapsed and refractory multiple myeloma. ASH-Meeting 2020; Abstr. #413 8 Martin T et al.: Depth of response and response kinetics of isatuximab plus carfilzomib and dexamethasone in relapsed multiple myeloma: IKEMA interim analysis. ASH-Meeting 2020; Abstr. #414 9 Dimopoulos M et al.: Carfilzomib, dexamethasone, and daratumumab versus carfilzomib and dexamethasone in relapsed or refractory multiple myeloma: updated efficacy and safety results of the phase 3 CANDOR study. ASH-Meeting 2020; Abstr. #2325 10 Moreau P et al.: Subcutaneous daratumumab (DARA SC) plus standard-of-care (SOC) regimens in multiple myeloma (MM) across lines of therapy in the phase 2 PLEIADES study: initial results of the DARA SC plus carfilzomib/dexamethasone (D-KD) cohort, and updated results for the DARA SC plus bortezomib/melphalan/prednisone (D-VMP) and DARA SC plus lenalidomide/dexamethasone (D-Rd) cohorts. ASH-Meeting 2020; Abstr. #1380 11 Becnel M et al.: Descriptive analysis of isatuximab use following prior daratumumab in patients with relapsed/refractory multiple myeloma. ASH-Meeting 2020; Abstr. #1371 12 Popat R et al.: DREAMM-6: safety, tolerability and clinical activity of belantamab mafodotin (BELAMAF) in combination with bortezomib/dexamethasone (BORDEX) in relapsed/refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr. #1419 13 Garfall A et al.: Updated phase 1 results of teclistamab, a B-cell maturation antigen (BCMA) x CD3 bispecific antibody, in relapsed and/or refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr. #180 14 Chari A et al.: a phase 1, first-in-human study of talquetamab, a g protein-coupled receptor family C group 5 member D (GPRC5D) x CD3 bispecific antibody, in patients with relapsed and/or refractory multiple myeloma (RRMM). ASH-Meeting 2020; Abstr. #290 15 Cohen A et al.: Initial clinical activity and safety of BFCR4350A, a FCRH5/CD3 t-cell-engaging bispecific antibody, in relapsed/refractory multiple myeloma. ASH-Meeting 2020; Abstr. #292 16 Harrison S et al.: a Phase 1 first in human (FIH) study of AMG 701, an anti-B-cell maturation antigen (BCMA) half-life extended (HLE) BiTE® (bispecific T-cell engager) molecule, in relapsed/refractory (RR) multiple myeloma (MM). ASH-Meeting 2020; Abstr. #181 17 Madduri D et al.: CARTITUDE-1: phase 1b/2 study of ciltacabtagene autoleucel, a B-cell maturation antigen–directed chimeric antigen receptor T cell therapy, in relapsed/refractory multiple myeloma. ASH-Meeting 2020; Abstr. #177 18 Lin Y et al.: Idecabtagene vicleucel (ide-cel, bb2121), a BCMA-directed CAR T cell therapy, in patients with relapsed and refractory multiple myeloma: updated results from phase 1 CRB-401 study. ASH-Meeting 2020; Abstr. #131 19 Mailankody S et al.: Universal: an allogeneic first-in-human study of the anti-BCMA ALLO-715 and the ANTI-CD52 ALLO-647 in relapsed/refractory multiple myeloma. ASH-Meeting 2020; Abstr. #129