Traitement optimisé de la MC fistulisante
Auteure:
Dre méd. Reingard Platzer
Innere Medizin für Gastroenterologie und Hepatologie, Landesklinikum Wiener Neustadt
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La maladie de Crohn fistulisante est considérée comme l’une des formes représenant le plus grand défi dans le traitement des patients atteints de maladies inflammatoires chroniques de l’intestin. L’hétérogénéité des patients exige un traitement personnalisé. Outre la prise de médicaments anti-inflammatoires efficaces, une collaboration interdisciplinaire est essentielle. En 1999, l’ère des médicaments biologiques pour la maladie de Crohn (MC) a été inaugurée avec l’infliximab, qui est toujours considéré comme le traitement de première ligne dans les directives.
Keypoints
-
L’hétérogénéité des patients, la charge de morbidité et d’inflammation élevée avec des lésions potentiellement irréversibles exigent un plan de traitement interdisciplinaire.
-
Les objectifs thérapeutiques comprennent le contrôle de l’inflammation, le maintien de la fonction sphinctérienne et la prévention de l’incontinence, l’amélioration de la qualité de vie et la prévention d’une stomie.
-
La guérison nécessite des taux plus élevés des inhibiteurs du TNF-alpha, ce qui implique l’ajustement correspondant de la dose et l’évaluation du rapport bénéfice-risque d’un traitement combiné par des thiopurines.
-
Un traitement personnalisé est la clé du succès.
Les fistules préoccupent l’humanité depuis longtemps – dans l’Antiquité déjà, Hippocrate a décrit la mise en place d’un séton en crin de cheval (450 av.J.-C.). Après la première description de l’iléite terminale en 1932, le chirurgien américain Burrill Bernard Crohn a décrit en 1938 l’apparition de fistules périanales dans la maladie de Crohn (MC).1 Les publications du «Lancet», qui ont décrit en 1980 l’efficacité des thiopurines dans les fistules et en 1999 celle de l’infliximab comme premier médicament biologique dans le traitement de la MC, sont considérées comme des étapes clés dans les options thérapeutiques médicamenteuses.2,3
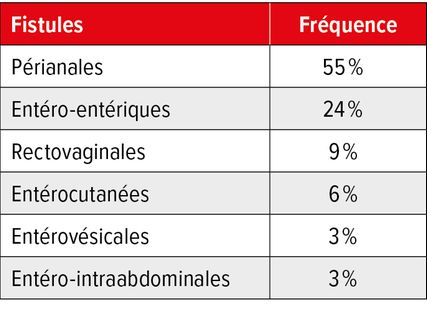
Plus d’un patient atteint de la MC sur trois est concerné (Tab. 1). La MC fistulisante/pénétrante est considérée comme un facteur prédictif négatif de l’évolution de la maladie, le taux d’intervention chirurgicale augmentant avec la progression de la maladie. Environ 20% des patients développent une MC périanale dans les 10 ans, et environ 10% présente une telle maladie lors du premier diagnostic.4 Il existe souvent une corrélation avec la MC luminale, mais une maladie périanale isolée est observée dans 5% des cas.5,6 La prévalence des fistules anales en Europe est de 18,37/100000. Il est intéressant de noter que les études menées avant l’an 2000 montrent des prévalences nettement plus faibles.7 Selon les données actuelles, 25% des fistules sont considérées comme liées à la MC.8
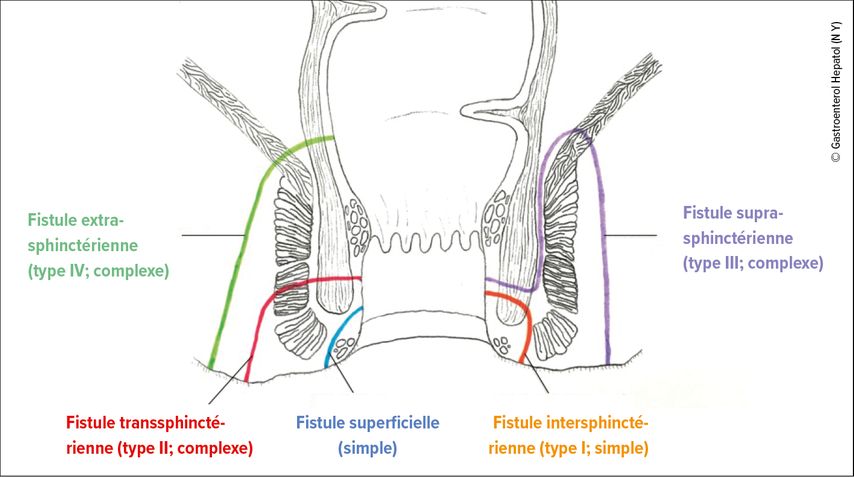
La classification de Parks9 existe depuis près de 50 ans et fait la distinction entre la position et le trajet par rapport au sphincter anal (externe et interne) (Fig. 1):
-
Type I: fistule intersphinctérienne
-
Type II: fistule transsphinctérienne
-
Type III: fistule suprasphinctérienne
-
Type IV: fistule extrasphinctérienne
-
Type V: fistule sous-cutanée/sous-anatomique/sous-muqueuse
Fig. 1: Classification de Parks des fistules périanales (avec l’aimable autorisation de Gastroenterol Hepatol, modifiée selon Gold SL et al. 2018)36
On parle de fistules hautes au-dessus de la ligne pectinée et de fistules basses en dessous. En 2003, l’American Gastroenterological Association (AGA) a défini la classification en fistules simples et complexes. Les fistules complexes comprennent les fistules avec plusieurs orifices externes, l’atteinte d’organes tels que le vagin/la vessie, ainsi qu’une sténose anorectale, une proctite ou un abcès lié à une fistule. 70 à 80% des fistules sont considérées comme complexes.10
Toute douleur au niveau périanal n’est pas forcément une fistule. Il faut tenir compte d’une série de diagnostics différentiels comme le pyoderma gangrenosum, l’acné inversa/hidrosadénite suppurative, le psoriasis inversé, les infections herpétiques et streptococciques, la tuberculose, la sarcoïdose, la maladie de Behçet, le prurit anal, les carcinomes, la syphilis, la MC métastatique, la thrombose périanale, etc.
«Burden of disease» et complications des fistules
Les fistules périanales peuvent avoir des répercussions négatives sur la perception du corps et la sexualité. Une enquête récente en onze langues, initiée par l’association européenne de soutien aux patients, montre que la MC fistulisante périanale est plus handicapante dans tous les domaines de la vie (vie sociale et professionnelle, vie de couple, sexualité, qualité de vie) par rapport à celle sans fistule.11
Ce que nous voulons éviter dans le traitement, ce sont les visites nocturnes (qui ne sont pas rares) aux urgences avec un abcès anal douloureux et aigu. Il convient donc d’impliquer le chirurgien le plus tôt possible dans l’évolution de la maladie et d’initier un drainage de la fistule, le cas échéant.
Les fistules périanales peuvent être accompagnées de douleurs, d’une dyspareunie, d’une perte incontrôlée de liquide/pus et de selles, et d’une détérioration de la qualité de vie. Les carcinomes liés à une fistule peuvent survenir en présence de fistules persistant depuis de nombreuses années et sont difficiles à diagnostiquer. Ils sont rares, avec une faible incidence (<1%), mais présentent un pronostic défavorable. Les facteurs de risque sont les suivants: longue durée ainsi que début précoce de la maladie, activité inflammatoire élevée, sténose anorectale, tabagisme, infection à HPV.12–14
Formation de la fistule
L’«epithelial-to-mesenchymal transition» (EMT) joue un rôle décisif dans la formation du trajet fistuleux chez les patients atteints de MC. Une série de cytokines pro-inflammatoires telles que le TNF, la régulation positive de la production de TGF-β et une activité accrue des métalloprotéinases matricielles (MMP) sont impliquées dans la transformation des cellules épithéliales intestinales en cellules de type myofibroblastes, ce qui entraîne la formation d’une fistule. L’IL-13 est fortement exprimée dans les trajets fistuleux. Pour cela, une altération de la barrière muqueuse doit exister (comme dans l’inflammation transmurale de la MC, par opposition à la colite ulcéreuse qui s’accompagne d’une inflammation muqueuse superficielle, les fistules étant très rares).
Diagnostic
Outre l’examen clinique, l’endoscopie (évaluation de l’activité inflammatoire) et l’IRM font partie des composantes essentielles du diagnostic. La fistulographie n’est plus recommandée dans les directives de l’ECCO en raison de la supériorité de l’IRM et de l’exposition aux rayonnements. L’endosonographie anale peut apporter des informations sur les déficits musculaires de l’appareil sphinctérien, p.ex. L’échographie intestinale peut donner des informations sur l’épaisseur de la paroi intestinale et permettre de détecter des abcès ou des fistules. En raison de l’exposition aux rayonnements, la TDM doit être réservée aux examens d’urgence et à certaines questions, p.ex. en cas de fistules entérovésicales, en complément de la cystoscopie et de la cystographie.
Les fistules périanales peuvent précéder le diagnostic de MC de plusieurs années. Outre l’anamnèse, la calprotectine fécale ainsi que l’examen endoscopique et radiologique, il convient de souligner ici l’avantage de l’endoscopie par capsule: 24% en cas d’iléocoloscopie, d’entéro-TDM/IRM normale.9
Options thérapeutiques médicamenteuses
L’étude randomisée et contrôlée Infliximab-Landmark, publiée en 1999, a ouvert la voie à l’utilisation de médicaments biologiques, la réponse aux fistules ayant été le critère d’évaluation primaire.3 L’infliximab est recommandé comme traitement de première ligne des fistules périanales. Une étude récente confirme la supériorité de l’infliximab par rapport à l’adalimumab en termes d’efficacité (64,9% vs 34,8% de réponse à 6 mois) et de persistance. Un meilleur taux de réponse peut être obtenu en cas de prise concomitante d’immunomodulateurs.15 La guérison des fistules périanales nécessite des taux plus élevés des inhibiteurs du TNF-α infliximab et adalimumab.16 Cela souligne l’importance d’ajuster la dose et d’évaluer le rapport bénéfice-risque d’un traitement combiné par des thiopurines.
En 1980, l’efficacité des thiopurines en monothérapie dans la MC fistulisante a pu être démontrée.2 Aujourd’hui, le traitement combiné par des thiopurines (azathioprine ou 6-mercaptopurine) et des inhibiteurs du TNF-α permet de réduire l’immunogénicité et d’augmenter les taux d’anti-TNF.17 Les antibiotiques, tels que le métronidazole ou la ciprofloxacine, combinés aux anti-TNF peuvent permettre d’obtenir de meilleurs taux de réponse à court terme, mais il faut tenir compte des effets potentiellement indésirables de l’antibiothérapie.18–20 Les bithérapies biologiques constituent une option en cas de MC fistulisante réfractaire.21
Gestion médicamenteuse optimisée
À quoi faut-il faire attention?
-
Timing optimal du traitement immunomodulateur, envisager la mise en place d’un séton avant le début du traitement par anti-TNF
-
Les données du monde réel indiquent un décalage allant jusqu’à 6 mois.22
-
Traitement d’entretien de la MC fistulisante
-
Une série d’études montrent que l’arrêt du traitement par anti-TNF entraîne une rechute (périanale+luminale) chez environ la moitié des patients.23–25
-
Fistules entériques symptomatiques: envisager un curetage chirurgical précoce
Les facteurs de risque de complications telles que les infections, le sepsis ou les abcès intraabdominaux, ainsi que la non-réponse à un traitement médicamenteux sont les suivants: sténose intestinale concomitante, plusieurs fistules entériques, fistules entérovésicales.
En 2004 déjà, une étude menée par l’hôpital général de Vienne (AKH) a mis en évidence l’efficacité insuffisante du traitement par l’infliximab en cas de MC avec fistule entérique.26 Selon les directives de l’ECCO, les fistules asymptomatiques ne doivent pas être opérées immédiatement, mais l’effet des médicaments doit faire l’objet d’une surveillance étroite.27
Options médicamenteuses récentes
Les médicaments biologiques tels que l’ustékinumab (inhibiteur de l’IL-12/IL-23) ou le védolizumab (antagoniste de l’intégrine α4β7) présentent un avantage dans les analyses de sous-groupes28,29 et constituent une bonne alternative en cas d’échec du traitement par anti-TNF ou de contre-indication aux inhibiteurs du TNF-α.
Des données sur les fistules publiées récemment sont également disponibles pour les inhibiteurs sélectifs de JAK upadacitinib30 et filgotinib.31
Réponses aux questions fréquemment posées
-
Durée de mise en place du séton: variable, généralement d’environ six mois, au moins pour la durée du traitement d’induction par un médicament biologique, la mise en place d’un séton n’étant pas une mesure unique32,33
-
Taux de guérison des fistules: environ 50% malgré les concepts thérapeutiques modernes (combinant médicaments et chirurgie)34
-
Facteurs de risque de mauvaise cicatrisation lors d’une intervention chirurgicale: activité inflammatoire luminale de la maladie de Crohn, tabagisme
-
Condition préalable au traitement par des cellules souches mésenchymateuses (darvadstrocel) en cas de fistule périanale complexe: MC luminale inactive/légèrement active
Le traitement de la MC fistulisante de A à Z
Sensibiliser et poser activement des questions à ce sujet, éviter, détecter et traiter les abcès. Prendre les éléments suivants en compte: sujet tabou, grande souffrance, près de la moitié des patients atteints de MC sont concernés. Garantir le contrôle optimal de l’inflammation afin d’éviter la formation de fistules entériques et de permettre l’efficacité de toutes les approches thérapeutiques des fistules périanales.
Conclusion
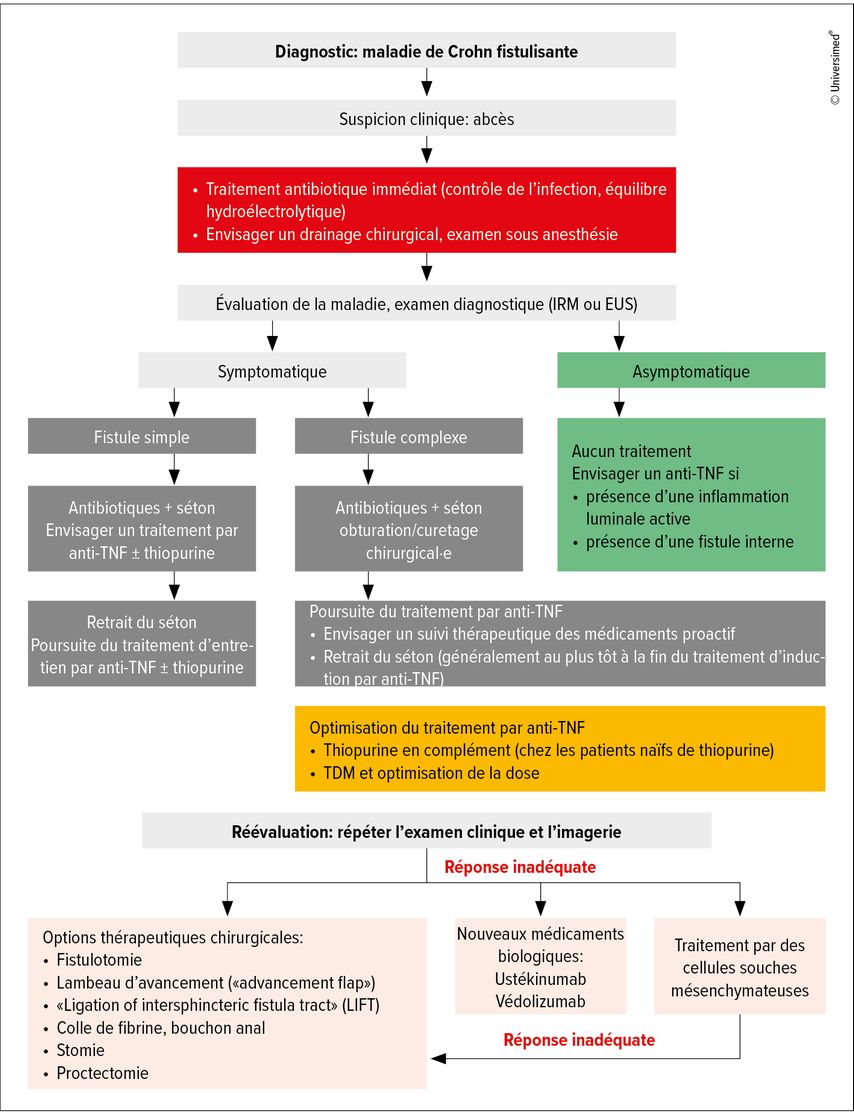
Une prise en charge multidisciplinaire (gastroentérologie, chirurgie, radiologie, soins infirmiers MICI, conseiller en stomie, etc.), un traitement précoce efficace, un contrôle optimal de l’inflammation ainsi qu’un plan de traitement personnalisé sont les clés du succès (Fig. 2).
Fig. 2: Algorithme du traitement optimisé de la maladie de Crohn fistulisante (modifié selon Wetwittayakhlang P et al. 2022)37
Littérature:
1 Penner A, Crohn BB: Ann Surg 1938; 108: 867-73 2 Present DH et al.: N Engl J Med 1980; 302: 18 3 Present DH et al.: N Engl J Med 1999; 340(18): 1398-405 4 Tsai L et al.: IBD 2021; 19: 2031-45.e11 5 Gecse KB et al.: J Crohns Colitis 2016; 10: 758-66 6 Schwartz DA et al.: Inflamm Bowel Dis 2015; 21: 723-30 7 Sarveazad A et al.: Gastroenterol Hepatol Bed Bench 2022; 15: 190-3 8Hokkanen S et al.: World J Clin Cases 2019; 7: 1795-1804 9 Adler SN et al.: World J Gastrointest Endosc 2012; 4: 185-8 10 Molendijk I et al.: Inflamm Bowel Dis 2014; 20: 2022-8 11 Spinelli A et al.: Crohns & Colitis 360 2023; 5: otad 36 12 Kotsafti A et al.: Cancers 2020; 12: 1748 13 Baars JE et al.: Scand J Gastroenterol 2011; 46: 319-25 14 Kienbauer M et al.: J Gastroenterol Hepatol Erkrank 2017; 15: 51-5 15 Maas L et al.: Dig Dis Sci 2023; 68: 357-69 16 Gu B et al.: World J Gastroenterol 2022; 28: 2597-2608 17Lee MJ et al.: Colorectal Dis 2018; 20: 797-803 18 Dewint P et al.: Gut 2014; 63: 292-9 19 West RL et al.: Aliment Pharmacol Ther 2004; 20: 1329-36 20 Lee MJ et al.: Clin Gastroenterol Hepatol 2018; 16: 1879-92 21 Yang E et al.: Aliment Pharmacol Ther 2020; 51: 1031-8 22 Lee MJ et al.: Colorectal Dis 2018; 20: 797-803 23 Tandon P et al.: Dig Dis Sci 2019; 64: 3066-77 24 Mak JWJ et al.: Aliment Pharmacol Ther 2019; 50: 1195-1203 25Legué C et al.: Inflamm Bowel Dis 2018; 24: 1107-13 26 Miehsler W et al.: Inflamm Bowel Dis 2004; 53: 542-8 27 Bemelman WA et al.: J Crohns Colitis 2018; 12: 1-16 28 Godoy Brewer GM et al.: BMJ Open Gastroenterol 2021; 8: e000702 29Ayoub F et al.: Intest Res 2022; 20: 240-50 30 Colombel JF et al.: J Crohns Colitis 2023; 17: i485-6 31 Reinisch W et al.: J Crohns Colitis 2022; 16: i415 32Bouguen G et al.: Clin Gastroenterol Hepatol 2013; 11: 975-81.e1-4 33 Wasmann KA et al.: JJ Crohns Colitis 2020; 14: 1049-56 34 Kotze PG et al.: Gut 2018; 67: 1181-94 35 Tjandra D et al.: Aliment Pharmacol Ther 2021; 53: 1064-79 36 Gold SL et al.: Gastroenterol Hepatol 2018; 14: 470-81 37 Wetwittayakhlang P et al.: J Clin Med 2022; 11: 3045
Das könnte Sie auch interessieren:
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...