Tests pharmacogénétiques et surveillance thérapeutique des médicaments:
Auteurs:
Dr méd. Maxim Kuzin
Privatklinik und Lehrkrankenhaus der Universität Zürich
https://orcid.org/0000-0002-0243-8458
Prof. hon. Dr rer. nat. Pierre Baumann
Centre hospitalier universitaire (CHUV) et Université de Lausanne
https://orcid.org/0000-0002-6253-5225
Auteur correspondant:
Dr méd. Maxim Kuzin
E-mail: maxim.kuzin@clienia.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La pharmacothérapie du trouble bipolaire entraîne souvent la nécessité d’une thérapie combinée, lorsque la monothérapie s’avère insuffisante. Le dosage plasmatique à des fins thérapeutiques («therapeutic drug monitoring»,TDM) en combinaison avec des tests pharmacogénétiques en tant qu’outil de médecine de précision permet une individualisation de la posologie. Cette approche minimise le risque d’effets secondaires indésirables, d’autres complications et d’échec du traitement.
Les troubles bipolaires et leurs formes principales
Selon les dernières données de l’Organisation mondiale de la santé (OMS), environ 1 milliard de personnes dans le monde souffre d’un trouble mental.1 Selon l’Office fédéral de la statistique, environ 6% de la population suisse a été traitée pour des problèmes de santé mentale en 2017.2 Avec une prévalence au cours de la vie estimée à 3%3, les troubles bipolaires ne sont pas des maladies rares. Cependant, le diagnostic est souvent posé avec un délai pouvant atteindre 5,6 ans, car il dépend considérablement de la polarité du premier épisode.4
Les troubles bipolaires appartiennent au groupe des troubles affectifs et font partie des maladies psychiatriques graves. Ils sont parmi ceux qui sont les plus caractérisés par une évolution chronique. Typiquement, ils commencent à l’adolescence ou au début de l’âge adulte.3 Une évolution progressive de deux états affectifs adversatifs, qui présentent un degré d’expression différent de composants maniaques, divise le trouble bipolaire en deux formes classiques: le type I (manie et dépression) et le type II (hypomanie et dépression). À côté d’épisodes mixtes, il y a aussi des formes particulières qui s’expriment par des changements de phases rapides et qui méritent également d’être mentionnées: le trouble bipolaire à cycle rapide, à cycle ultrarapide et à cycle ultradien. Jusqu’à 20% des patients bipolaires présentent un cycle rapide, qui affecte principalement les femmes:3pour son diagnostic, il faut au moins quatre épisodes affectifs au cours de la dernière année. Les patients considérés comme cycleurs ultrarapides ont au moins quatre épisodes par mois, donc un changement fréquent en l’espace de quelques semaines ou de jours. Chez les cycleurs ultradiens, un changement de phase en 24 heures et cela à quatre jours par semaine est typique. La diversité montrée reflète une évolution hétérogène des troubles bipolaires, qui sont non seulement associés à une altération considérable du mode de vie et à une grande souffrance, mais aussi à une espérance de vie raccourcie de 10 à 20 ans.5
Le succès des mesures thérapeutiques dépend ainsi de nombreux facteurs tels que du type de thérapie appliqué (psychothérapie et/ou pharmacothérapie), de la qualité de la relation thérapeutique avec le thérapeute, de l’adhérence du patient aux interventions thérapeutiques et de facteurs psychosociaux. En raison de l’hypothèse d’une genèse multifactorielle, le traitement du trouble bipolaire implique une approche multidimensionnelle, qui comprend la combinaison d’une pharmacothérapie avec une psychothérapie et une psychoéducation.
Pharmacothérapie dutrouble bipolaire
Il existe différentes lignes directrices et recommandations de traitement pour les troubles bipolaires.3,6 Récemment, des recommandations du Réseau canadien pour le traitement de l’humeur et de l’anxiété (CANMAT) et de l’International Society for Bipolar Disorders (ISBD) pour le traitement d’un trouble bipolaire avec présentations mixtes ont également été publiées.7 Les recommandations de traitement de la Société suisse des troubles bipolaires (SSTB) de 2019 sont centrées sur des produits tels que le lithium, les anticonvulsivants, les antidépresseurs et les antipsychotiques (Tab.1).8 Cependant, une monothérapie telle qu’elle est souhaitée conduit rarement à un effet thérapeutique durable.9 Une combinaison de deux ou trois médicaments est alors utilisée lorsqu’aucune rémission complète des symptômes n’est obtenue en monothérapie. Selon une étude, une pharmacothérapie complexe (basée sur trois médicaments psychotropes) n’est pas rare chez 32,5% des patients bipolaires ambulatoires.9 Par contre, ces stratégies de traitement augmentent le risque d’effets indésirables et d’interactions médicamenteuses cliniquement significatives.
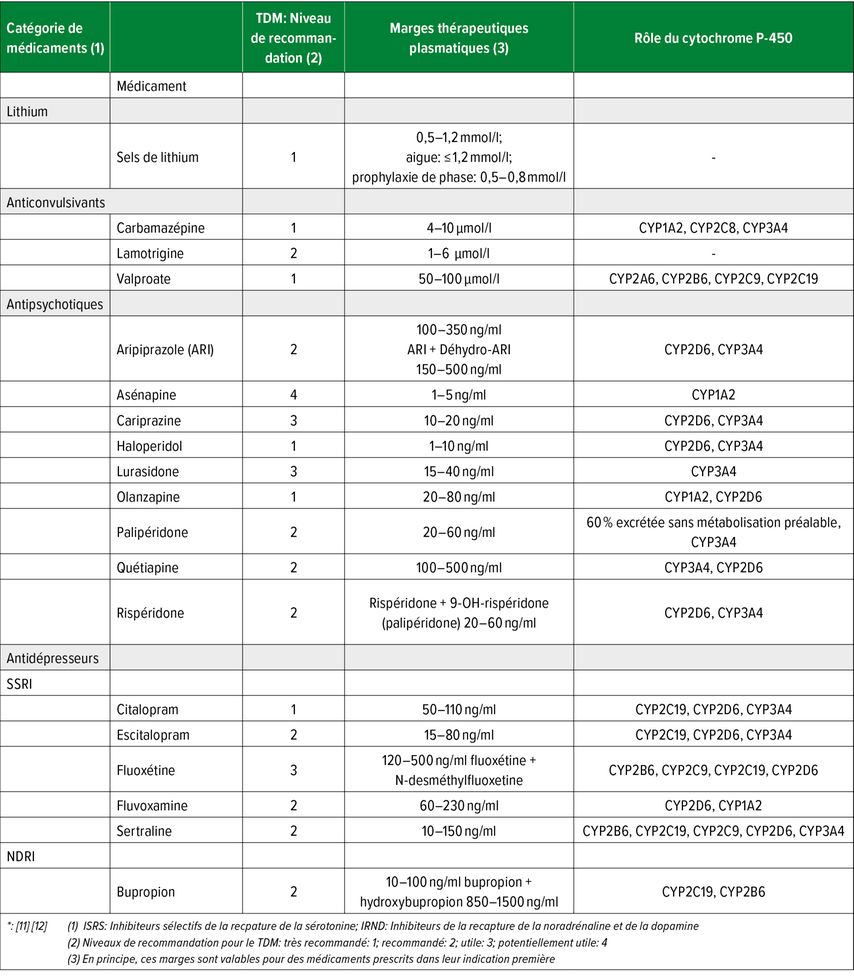
Tab. 1: Surveillance thérapeutique des médicaments psychotropes («therapeutic drug monitoring»,TDM) dans le trouble bipolaire
Métabolisme des médicaments psychotropes et aspects pharmacogénétiques
À part quelques exceptions telles que le lithium et la lamotrigine, presque tous les médicaments recommandés par la SSTB pour le traitement des troubles bipolaires sont soumis au métabolisme hépatique impliquant le système enzymatique du cytochrome P-450 (CYP).10,11 Le tableau 1 présente les marges thérapeutiques plasmatiques de ces médicaments. Ces marges ainsi que le niveau de recommandation TDM pour chaque médicament ont été proposés par le groupe AGNP-TDM («Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie»).12 Cependant, en ce qui concerne les antidépresseurs et les antipsychotiques, leurs données se réfèrent en fait à leur indication originale, à savoir dépression ou schizophrénie.
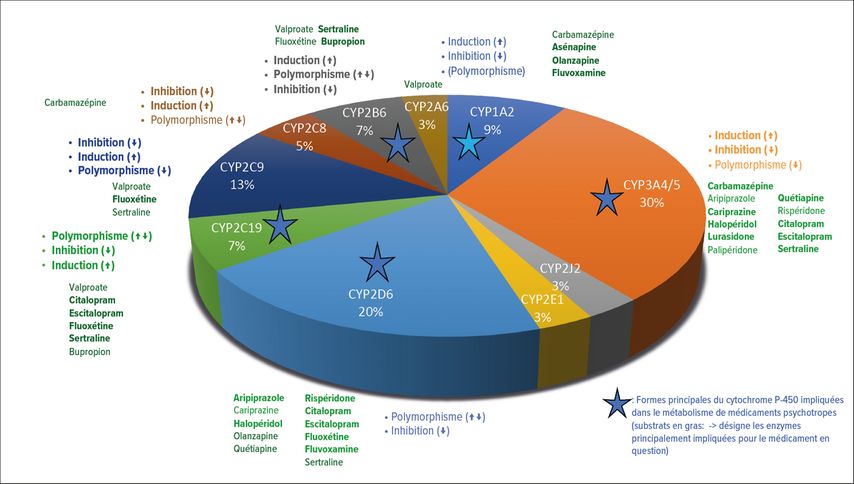
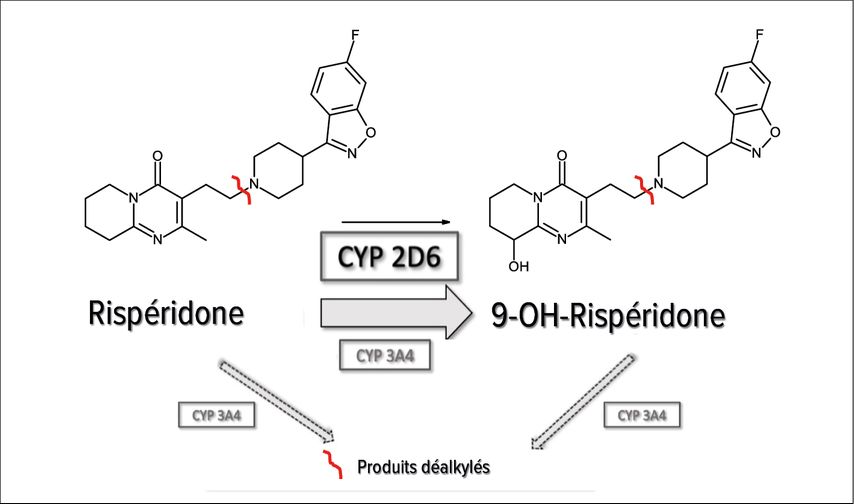
Les isoenzymes CYP sont localisées dans la membrane du réticulum endoplasmique des cellules. Dans la nature, plus de 200 isoenzymes CYP sont connues, dont à peine une demi-douzaine sont responsables du métabolisme de médicaments psychotropes chez l’homme. Le CYP3A4/5 est l’enzyme prépondérante avec environ 30%, suivi du CYP2D6 (20%), du CYP2C9 (12,8%), puis du CYP1A2 (8,9%) (Fig. 1).13 Dans la biotransformation des médicaments, les isoenzymes individuelles du CYP peuvent être impliquées à la fois dans la voie de dégradation principale et dans les voies de dégradation secondaires, comme l’illustre l’exemple de la rispéridone (Fig. 2). Elle est métabolisée en un métabolite actif, la 9-OH-rispéridone (palipéridone) via une voie de dégradation principale grâce au CYP2D6. Dans une faible mesure, le CYP3A4 participe également à cette étape, mais il est surtout impliqué, dans une voie secondaire, – celle de la déalkylation de la rispéridone et de la 9-OH-rispéridone. La rispéridone et la 9-OH-rispéridone forment ensemble la fraction active («active moiety»).10 Le rapport rispéridone/9-OH-rispéridone mesuré dans le plasma dans des conditions d’équilibre peutêtre considéré en quelque sorte comme un phénotypage par rapport à l’activité métabolique du CYP2D6. Si le rapport est de >1 ou <0,1, il peut ensuite être utile de procéder à un génotypage du CYP2D6, dans le sens d’une personnalisation de la psychopharmacothérapie chez un patient individuel.14
Fig. 1: Contribution de différentes formes du cytochrome P-450 dans le métabolisme de médicaments psychotropes utilisés pour le traitement du trouble bipolaire12 (figure d’après Zanger UM et al., 2013)13
Fig. 2: Biotransformation de la rispéridone en 9-OH-rispéridone (palipéridone): en rouge: marque les sites où ces composés sont métabolisés en métabolites inactifs
On parle de polymorphisme génétique, si la fréquence d’une variante génétique est de 1% au moins. Selon le génotype, de fortes différences interindividuelles dans la capacité métabolique peuvent exister et ainsi influencer la tolérance et la sécurité du médicament et même conduire à l’échec du traitement. Sur la base d’un consensus récemment publié sur l’application de tests pharmacogénétiques en psychiatrie, le génotypage des deux isoenzymes CYP2D6 et CYP2C19 pourrait être bénéfique.15 Cela a également été décrit dans un article axé sur les conditions suisses, bien qu’il explique aussi, pourquoi par exemple les frais liés à ces génotypages CYP2D6 et CYP2C19 ne soient pas couverts par l’assurance de base par rapport à d’autres tests pharmacogénétiques.16
L’activité métabolique du CYP2D6 est divisée en quatre types: métaboliseurs lents («poor metabolisers», PM), métaboliseurs intermédiaires (IM), métaboliseurs rapides ou »normaux« («extensive metabolizers», EM) et métaboliseurs ultrarapides (UM).
Les personnes présentant un génotype (ou plutôt de phénotype) de PM sont représentées dans la population européenne avec une fréquence de 6,2%. La répartition des différents génotypes au niveau mondial dépend des ethnies examinées.17 En général, les PM ont deux allèles non fonctionnels ce qui peut avoir comme conséquence, lors de la prescription d’un précurseur («prodrug»), une absence de biotransformation en métabolite actif, et donc un échec thérapeutique. Cette situation est illustrée par le cas de la codéine, qui doit être transformée par le CYP2D6 en morphine pour exercer une activité analgésique.18 D’autre part, le statut PM peut entraîner un effet cumulatif. Il en résulte une diminution de la tolérance et augmente donc le risque d’une adhérence fluctuante au traitement, comme cela a été discuté à plusieurs reprises au sujet de la rispéridone, un substrat de CYP2D6.19,20 Dans ce cas, il serait utile de réduire les doses quotidiennes de moitié pour éviter l’effet cumulatif avec les conséquences citées. Un TDM effectué régulièrement serait parfaitement approprié.21 Toujours en se référant au CYP2D6, le statut pharmacogénétique IM est beaucoup moins fréquent dans une population européenne (caucasienne) (2,6%) qu’en Asie de l’Est (48,6%).17 Dans ce cas, un ajustement ou une réduction modérée de la posologie sont suffisants.21 En général, les patients EM sont homozygotes pour l’allèle de type sauvage (forme allèle normale). Ce groupe présente l’activité métabolique la plus courante dans la population européenne (88,1%), mais elle est presque deux fois moins fréquente en Asie de l’Est.17 Chez les personnes considérées comme UM, on observe une duplication ou même multiplication du gène, avec donc trois copies ou plus d’allèles fonctionnels révélés par le génotypage. Ce génotype est représenté dans la population européenne avec une fréquence de 3,2%, mais elle augmente du nord au sud.17 Le phénotype UM se produit plus fréquemment que ce que le génotypage prévoit, mais chez de nombreux patients génotypés, ce phénotype ne s’explique pas. L’activité métabolique élevée chez un UM annonce un risque réel d’un échec au traitement. Même en doublant la dose du médicament, substrat de CYP2D6, il n’est parfois pas possible d’atteindre des taux plasmatiques suffisants pour obtenir une réponse thérapeutique adéquate.20
Pharmacothérapie du trouble bipolaire: interactions médicamenteuses
Il faut faire une distinction entre les interactions pharmacodynamiques et pharmacocinétiques. Dans les interactions pharmacodynamiques, l’influence d’un médicament sur l’effet pharmacologique d’un autre médicament est au premier plan, de sorte qu’une modification de leurs concentrations plasmatiques ne doit pas être une condition. Il en résulte des interactions pharmacodynamiques additives (également connues sous le nom de synergies) ou antagonistes qui peuvent modifier la durée, la puissance et le début de l’action du médicament concerné.
La pharmacocinétique décrit quatre niveaux qui peuvent être concernés par des interactions: absorption, distribution, métabolisme et excrétion (ADME). Les interactions pharmacocinétiques se reflètent en général dans la modification des taux plasmatiques et/ou du rapport substance mère/métabolite actif (cela serait donc surtout au niveau métabolisme), ce qui peut alors entraîner des conséquences cliniques indésirables.
Interactions pharmacodynamiques:pertinence dans le trouble bipolaire
Une prescription simultanée d’anti-inflammatoires non stéroïdiens (AINS) et d’inhibiteurs de la recapture de la sérotonine (ISRS), – un traitement combiné qui est aussi habituel lors du traitement d’un trouble bipolaire, sert d’exemple d’interaction pharmacodynamique. Les ISRS inhibent le transport de la sérotonine via les transporteurs de la sérotonine dans les plaquettes, qui sont incapables de synthétiser cette amine. Elles constituent un réservoir important de sérotonine périphérique, dont le rôle consiste à moduler la vasoconstriction et l’agrégation plaquettaire.22Dans le cadre d’une telle thérapie combinée, le risque de complications intestinales ou de saignements augmente d’une manière significative.23,24 En outre, un risque légèrement accru d’hémorragie cérébrale sous ISRS et AINS est également discuté.25,26 L’interaction pharmacodynamique est d’importance clinique, de sorte qu’il est conseillé de prescrire des antidépresseurs dont le mécanisme d’action est basé sur un autre mécanisme d’action, en particulier chez les patients qui présentant un risque accru de saignement.
Interactions pharmacocinétiques: risques d’échec du traitement
Une thérapie combinée dans le traitement du trouble bipolaire n’est pas rare,27,28 mais une seule interaction pharmacocinétique cliniquement pertinente via un effet inhibiteur ou inducteur sur des CYP impliqués peut compromettre l’ensemble du processus de traitement.
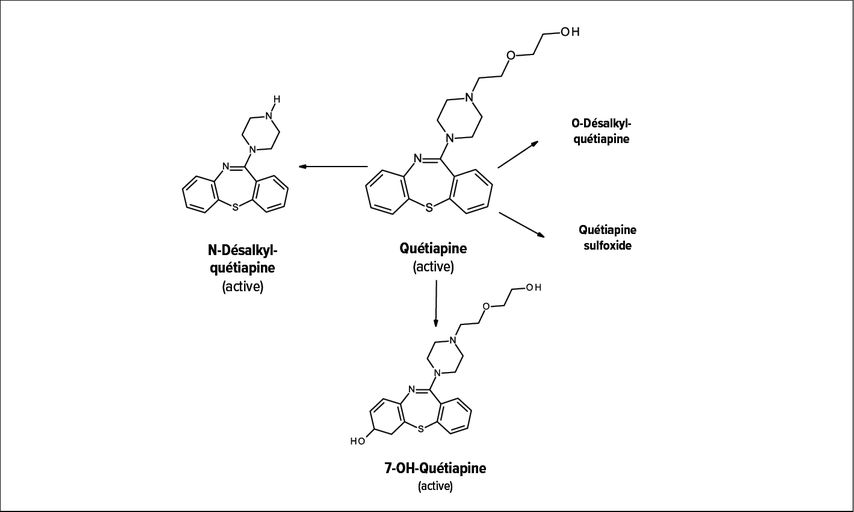
Le lithium, la carbamazépine, la lamotrigine et le valproate sont des stabilisateurs de l’humeur et peuvent être associés à des interactions d’importance clinique lorsqu’ils sont combinés avec des antipsychotiques atypiques.11 La carbamazépine en tant que stabilisateur de l’humeur est particulièrement interactive et ne convient donc que dans une mesure limitée à une telle approche. L’adjonction («augmentation») de carbamazépine peut entraîner une diminution des concentrations plasmatiques d’une comédication, connue pour être un substrat du CYP3A4 inductible. L’antipsychotique atypique quétiapine, principalement métabolisée par le CYP3A4 (Fig. 3), est largement prescrit pour le traitement du trouble bipolaire. Sa prescription simultanée avec la carbamazépine peut avoir comme conséquence une forte baisse de sa concentration suivie d’une déstabilisation aiguë de la psychopathologie chez le patient29,30(cf situation clinique [encadré]). La situation est similaire avec d’autres antipsychotiques atypiques tels qu’avec la rispéridone, l’olanzapine ou l’aripiprazole: une chute du taux plasmatique de ces médicaments est à craindre après leur association avec la carbamazépine.29
Fig. 3: Métabolisme de la quétiapine: la N-désalkylquétiapine (norquétiapine) est un inhibiteur de la recapture de la noradrénaline (NARI)36
La polypharmacie constitue un défi,31,32 mais elle fait désormais partie de la routine clinique dans une société de plus en plus vieillissante. Les interactions pharmacocinétiques deviennent de plus en plus probables dans ce contexte. Le TDM en tant qu’outil de gestion des patients et comme élément de la médecine de précision peut aider les cliniciens dans des questions complexes lorsqu’il s’agit d’optimiser un traitement. Il aide à faire la différence entre la non-réponse et le manque d’observance, et à prévenir les conséquences d’interactions pharmacocinétiques.
Polymorphismes génétiques associés au système antigène leucocytaire
Le système antigène leucocytaire humain (HLA) avec plus de 200 gènes (chromosome 6) est également soumis à une variabilité génétique. Dans la pharmacothérapie du trouble bipolaire avec la carbamazépine, son importance clinique est à relever. La fréquence de l’allèle HLA-B*-1502 est de 1 à 2% dans la population européenne, mais elle est beaucoup plus élevée en Asie, en particulier à Singapour et chez les Chinois Han (plus de 10%).33 L’allèle HLA-B*-1502 est associé au syndrome de Stevens-Johnson et à la nécrolyse épidermique toxique, de sorte que la Food and Drug Administration (FDA) des États-Unis recommande le génotypage pour tous les patients asiatiques.34 Une autre variante d’allèle, le HLA-A*-3101 est importante pour les personnes d’origine européenne et japonaise. Si elle est présente, les Européens courent un risque jusqu’à 26% d’être atteint d’un syndrome d’hypersensibilité.35 Swissmedic recommande le génotypage de l’allèle HLA-A*-3101 chez les personnes auxquelles l’on prescrit un traitement à base de carbamazépine pour la première fois. Cet examen est couvert par l’assurance de base.16
Conclusions
Le traitement pharmacologique du trouble bipolaire est souvent difficile en raison de la nécessité d’une thérapie combinée, en particulier en tenant compte d’interactions pharmacodynamiques et pharmacocinétiques. Divers outils sont à disposition pour optimiser le traitement pharmacologique du trouble bipolaire.
Le TDM peut aider le clinicien à optimiser les stratégies de traitement pharmacologique, à faire la différence entre la non-réponse et le manque d’observance, et à révéler à un moment opportun les interactions pharmacocinétiques cliniquement pertinentes.
Le génotypage du cytochrome P450 permet de personnaliser davantage la pharmacothérapie. En relation avec les médicaments psychotropes, un génotypage peut principalement être recommandé pour le CYP2D6 et le CYP2C19, mais un génotypage de routine n’est actuellement pas justifié dans le contexte clinique. En cas de suspicion d’une déficience génétique d’une de ces enzymes et en particulier dans le cas de la polypharmacie, le génotypage doit être envisagé, comme l’illustre la description de cas (encadré). L’exemple de la carbamazépine indique aussi que nous disposerons de plus en plus de génotypages cliniquement précieux (p.ex. HLA-A*3101) dans le domaine de la pharmacodynamie.
Vignette clinique – La carbamazépine en tant que comédication dans le trouble bipolaire: échec du traitement à la suite de l’induction du CYP3A4
Grâce à un traitement au valproate (1200mg/j) et à la quétiapine ret. (500mg/j), une patiente de 51 ans et souffrant d’un trouble bipolaire a présenté une situation clinique stable depuis une année. Cependant, elle a signalé une perte de cheveux persistante associée à l’initiation du traitement par le valproate (un effet secondaire connu, de nature dose-dépendante et transitoire). La patiente a accepté un changement de médication dans sa maison de santé, mais en refusant un traitement conséquent avec du valproate. Sur la base des recommandations de traitement publiées par la SSTB, un passage à la carbamazépine (initialement à 200mg/j) a été effectué, car une bonne réponse thérapeutique était déjà connue des antécédents psychiatriques.
En une semaine, une déstabilisation croissante de la psychopathologie avec des composantes affectives à prédominance maniaque et une mégalomanie à contenu religieux ont été observées chez la patiente, de sorte qu’une hospitalisation d’urgence à la clinique psychiatrique était inévitable. Il faut signaler que le personnel de la maison de santé avait confirmé une administration et une prise régulières de la médication.
La TDM a révélé un taux plasmatique de quétiapine à peine mesurable, à savoir 49ng/ml (marge thérapeutique: 100–500ng/ml; Tab. 1) (voie métabolique principale de la quétiapine: CYP3A4). Le traitement à la carbamazépine a été arrêté, et le valproate (900mg/j) a été réintroduit en tenant compte de ses taux plasmatiques. Ce nouveau traitement s’est avéré efficace et sans manifestation d’effets secondaires (en particulier sans perte de cheveux initialement décrite). Cependant, une association avec la quétiapine retard c’est à nouveau avérée nécessaire. Après quelques semaines, la situation clinique s’est stabilisée à nouveau, en atteignant le niveau initial.
Littérature:
1 GBD 2017 Disease and Injury Incidence and Prevalence Collaborators: Lancet 2018; 392: 1789-1858 2 Statistik, B.f. [cited 2021 11.10.]; Available from: https://www.bfs.admin.ch/bfs/de/home/statistiken/gesundheit/gesundheitszustand/psychische.html 3 DGPPN: S3-Leitlinie zur Diagnostik und Therapie Bipolarer Störungen. [cited 2021 11.10.2021]; Available from: https://www.awmf.org/uploads/tx_szleitlinien/038-019l_S3_Bipolare-Stoerungen-Diagnostik-Therapie_2020-05.pdf 4 Cha B et al.: Psychiatry Investig 2009; 6: 96-101 5 Liu NH et al.: World Psychiatry 2017; 16: 30-40 6 Yatham LN et al.: Bipolar Disord 2018; 20: 97-170 7 Yatham LN et al.: Bipolar Disord 2021; doi: 10.1111/bdi.13135; online ahead of print 8 Hasler G et al.: Swiss Medical Forum 2019; 19: 537-46 9 Taylor RW et al.: Int J Neuropsychopharmacol 2020; 23: 587-625 10 Hiemke C et al.: Pharmacopsychiatry 2018; 51: 9-62 11 Bauman P and Kuzin M: BrainMag 2021; 6: 12-7 12 Hiemke C et al.: Pharmacopsychiatry 2018; 51: 9-62 13 Zanger UM and Schwab M: Pharmacol Ther 2013; 138: 103-41 14 Mannheimer B et al.: Eur J Clin Pharmacol 2014; 70: 695-9 15 Bousman CA et al.: Pharmacopsychiatry 2021; 54: 5-17 16 Baumann P, Jetter A: Ars Medici 2020; 11+12: 364-71 17 Milosavljevic F et al.: JAMA Psychiatry 2021; 78: 270-80 18 He W et al.: J Clin Oncol 2020; 38: 548-57 19 de Leon J et al.: J Clin Psychiatry 2005; 66: 15-27 20 Soria-Chacartegui P et al.: Front Pharmacol 2021; 12: 711940 21 Kirchheiner J et al.: Pharmacopsychiatry 2003; 36(Suppl 3): 235-43 22 Maclean JA, Schoenwaelder SM: Chapter 5 - Serotonin in Platelets, in Serotonin The mediator that spans evolution. 2019; 91-119 23 de Jong JC et al.: Br J Clin Pharmacol 2003; 55: 591-5 24 Laporte S et al.: Pharmacol Res 2017; 118: 19-32 25 Douros AM et al.: CNS Drugs 2018; 32: 321-34 26 Jensen MP et al.: Eur Stroke J 2019; 4: 144-52 27 Fornaro M et al.: Neuropsychiatr Dis Treat 2016; 12: 719-35 28 Kim K et al.: Psychiatry Investig 2019; 16: 397-402 29 de Leon J et al.: Expert Opin Drug Metab Toxicol 2012; 8: 311-34 30 Nickl-Jockschat T et al.: Clin Neuropharmacol 2009; 32: 55 31 Hoel RW et al.: Mayo Clin Proc 2021; 96: 242-56 32 Fung VC et al.: J Affect Disord 2019; 257: 17-22 33 Wang Q et al.: Seizure 2011; 20: 446-8 34 Ferrell PB Jr and McLeod HL: Pharmacogenomics 2008; 9: 1543-6 35 McCormack M et al.: N Engl J Med 2011; 364: 1134-43 36 Bakken GV et al.: Drug Metab Dispos 2009; 37: 254-8
Das könnte Sie auch interessieren:
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...