«Precision diabetes»: vers un traitement personnalisé du diabète
Compte-rendu:
Reno Barth
Journaliste médical
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Un traitement personnalisé doit permettre d’améliorer les résultats des patient·es atteint·es de diabète sucré, ce qui a pu être réalisé en particulier pour les formes monogéniques de diabète. Même le diagnostic différentiel, en apparence simple, entre le diabète de type 1 (DT1) et le diabète de type 2 (DT2) peut toutefois s’avérer difficile dans certaines populations.
Keypoints
-
Plus de 90% des cas de diabète néonatal ont une origine monogénique.
-
Certaines formes monogéniques de diabète peuvent être bien traitées à long terme par des sulfonylurées.
-
On trouve également des mutations MODY chez des personnes qui ne développent aucun diabète.
-
La différenciation entre le DT1 et le DT2 peut s’avérer difficile chez les patient·es âgé·es.
-
À l’avenir, les scores génétiques pourraient être utilisés en cas de diagnostic difficile.
Le mot-clé «precision diabetes» regroupe des stratégies visant à adapter la gestion du diabète aux besoins individuels des patient·es, explique le Pr Andrew Hattersley de l’Université d’Exeter. Cette approche doit être axée sur les patient·es et applicable. Pour une petite proportion de la population diabétique, l’approche personnalisée a déjà permis une amélioration spectaculaire de leur situation. Il s’agit de patient·es dont le diabète a une origine monogénique et qui est traité de manière causale. Il s’est ainsi avéré que le diabète néonatal est dû à une mutation d’un gène codant pour la sous-unité Kir6.2 des canaux potassiques sensibles à l’ATP dans 50% des cas.1
A. Hattersley a expliqué qu’il a été envisagé que les sulfonylurées puissent fermer ce canal et ainsi relancer la sécrétion d’insuline. Dans la pratique, cela a fonctionné encore mieux que prévu. Tou·tes les patient·es ont vu leur contrôle glycémique s’améliorer sans risque accru d’hypoglycémie et 90% ont pu arrêter de prendre de l’insuline, ce qui a représenté un énorme soulagement pour les familles concernées.2
Le contrôle glycémique a été maintenu à long terme et le retard de développement souvent associé dans ce cas s’est également amélioré, sans que l’on en comprenne les raisons, car il n’y a aucun canal potassique ATP-dépendant dans le cerveau. L’université d’Exeter a mis gratuitement à la disposition du monde entier le test initialement breveté.
Il est désormais établi que plus de 90% des cas de diabète néonatal ont une origine monogénique, 43 sous-types de diabète néonatal étant connus. Les troubles peuvent concerner le développement du pancréas, la fonction de la cellule bêta ou entraîner la destruction de la cellule bêta.2 A. Hattersley a souligné que ces recherches ont apporté des connaissances importantes dont la portée va au-delà du cadre du diabète néonatal. Il a ainsi été démontré que le développement du pancréas chez l’être humain diffère nettement de celui chez la souris et que des gènes totalement divers sont parfois impliqués. La recommandation selon laquelle tous les enfants qui développent un diabète dans les six mois suivant leur naissance doivent réaliser des tests génétiques pour les 43 mutations à risque connues est devenue la référence. Il en résulte des recommandations thérapeutiques concrètes pour certain·es patient·es.3
Le risque polygénique détermine la pénétrance du MODY
Alors que pratiquement toutes les formes de diabète néonatal ont une cause monogénique, il existe également un diabète monogénique à début tardif: le «maturity-onset diabetes of the young» (MODY). Il se manifeste généralement avant 25 ans et rappelle un DT2 sur le plan clinique. Plusieurs sous-types sont connus, avec une origine génétique et des tableaux cliniques différents. Les formes MODY se distinguent également par leur réponse au traitement. Alors que la majorité ne nécessitent aucun traitement ou peuvent être traitées (plus ou moins bien) par des sulfonylurées, d’autres formes requièrent une insulinothérapie. Selon A.Hattersley, le problème réside toutefois dans le fait que les cas de MODY sont loin d’être tous détectés dans la pratique clinique quotidienne. Malgré une prise de conscience et une augmentation des tests, des données provenant de Grande-Bretagne indiquent que 50% des cas pédiatriques et 75% des cas adultes ne sont toujours pas correctement diagnostiqués. Il faut encore attendre plus de trois ans après le diagnostic de diabète avant que celui de MODY ne soit posé. Il convient de ne pas se fier au tableau clinique, mais de tester tous les gènes potentiels, a souligné A. Hattersley. Les manifestations atypiques du diabète, comme un DT1 avec anticorps négatifs ou un DT2 chez des personnes jeunes et minces, doit attirer l’attention sur un éventuel MODY. Si des problèmes rénaux ou un engourdissement surviennent en plus, cela indique fortement une origine monogénique.
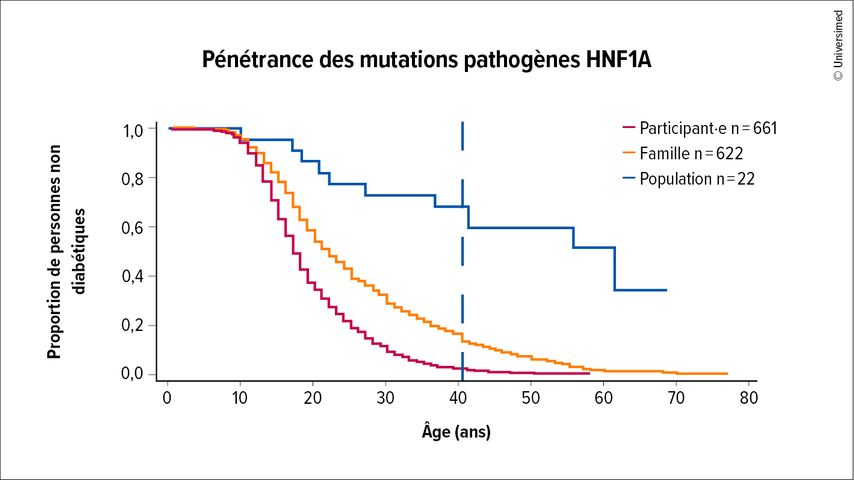
Inversement, un dépistage de l’ensemble de la population n’est ni faisable ni pertinent, car des études montrent que les mutations MODY sont également détectées chez des personnes qui ne développent aucun diabète. Il semble que le risque polygénique influence la pénétrance des mutations MODY (Fig.1). A. Hattersley évoque la possibilité d’un «double-dose diabetes», associé à la combinaison de plusieurs facteurs de risque génétique.
Fig.1: Pénétrance des mutations pathogènes HNF1A dans différentes cohortes. La figure représente la proportion de personnes non diabétiques en fonction de l’âge. Les personnes index (rouge) et les parents présentant des mutations HNF1A (orange) ont une probabilité plus élevée de développer la maladie que la population globale (bleu), ce qui indique des facteurs génétiques et environnementaux influençant la manifestation (selon Mirshahi UL et al. 2022)5
Appliquer l’approche de la médecine personnalisée aux formes plus courantes de DT1 et DT2 constitue le prochain défi à relever. Des données provenant d’Afrique suggèrent que les formes de diabète qui y sont répandues ne sont pas les mêmes qu’en Europe. En Afrique, un diabète avec insulinodéficience, anticorps négatifs et symptômes de type 1 est fréquent. En Europe aussi, les erreurs de classification entre le DT1 et le DT2 ne sont pas rares. Les patient·es âgé·es et minces font souvent l’objet d’erreurs de diagnostic. A. Hattersley recommande donc de toujours tester les anticorps en cas de suspicion de DT1. Les données d’études révèlent que 67% des patient·es présentant un DT1 présumé avec anticorps négatifs sont en fait atteint·es de DT2 ou de MODY.
Diagnostic différentiel plus difficile chez les patient·es âgé·es
Le Pr Angus Jones de l’Université d’Exeter explique à quel point il peut s’avérer difficile de différencier le DT1 et le DT2 en prenant l’exemple d’une patiente âgée de 65 ans avec un IMC de 23kg/m2, une HbA1c de 10,4%, une hyperglycémie symptomatique, un taux de cétones élevé, mais pas d’acidocétose. Selon lui, la classification de ce diabète est non seulement difficile, mais elle est également importante, car les différences entre le DT1 et le DT2 ont une influence décisive sur le traitement. Alors que le DT1 se caractérise par un déficit absolu en insuline, le DT2 se caractérise par un déficit partiel en insuline. La sécrétion d’insuline diminue, mais ne tend pratiquement jamais vers zéro. Une différence déterminante pour la gestion clinique réside dans la variabilité de la glycémie, qui est très élevée dans le DT1 et relativement faible dans le DT2.
Les données d’études montrent cependant que l’IMC n’est pas un critère suffisant pour différencier le DT1 et le DT2. En revanche, l’âge s’est révélé pertinent en ce sens dans sept des neuf études. Parmi les personnes âgées de 50 ans nouvellement diagnostiquées, seules 1,4% sont encore atteintes de DT1.4 L’étude STARTRIGHT, qui n’a pas encore été publiée, a relevé toute une série de valeurs et de paramètres chez des patient·es nouvellement diagnostiqué·es, et les a mis en relation avec le diagnostic définitif sur une période de suivi de quatre ans. Les meilleurs facteurs prédictifs d’un DT1 étaient une perte de poids involontaire, un IMC <25kg/m2 et une HbA1c très élevée à la présentation, selon A. Jones. L’acidocétose diabétique s’est avérée très spécifique, bien que non sensible en cas de DT1.
On ne peut pas toujours se fier aux anticorps
La très faible probabilité d’un diagnostic de DT1 chez une personne âgée de 65 ans rend la classification difficile, car aucune caractéristique n’a une valeur prédictive suffisamment élevée. «Même si plusieurs facteurs indiquent un DT1, la probabilité qu’il s’agisse d’un DT2 est toujours élevée dans ce groupe d’âge» a déclaré A. Jones. Cela conduit à des erreurs de diagnostic dans les deux sens. Dans le groupe des 30 ans et plus, près de la moitié des personnes concernées se voient diagnostiquer à tort un DT1 comme étant un DT2. Il en résulte une gestion sous-optimale de la maladie. «Ces personnes ne reçoivent ni dispositif de mesure du glucose en continu ni pompe à insuline», a-t-il expliqué.
Les biomarqueurs améliorent la qualité du diagnostic, mais ne permettent pas non plus d’être sûr à 100%. Les auto-anticorps sont de bons facteurs prédictifs de l’évolution future, mais ne révèlent pas grand-chose sur les besoins thérapeutiques actuels. La pertinence du peptide C comme facteur prédictif de l’évolution future est par contre limitée au moment du diagnostic, mais il convient bien à l’évaluation de la situation actuelle. Les anticorps anti-îlots ne sont pas non plus fiables chez les patient·es âgé·es. Des anticorps négatifs n’excluent pas avec certitude un DT1, des anticorps positifs sont clairement en faveur d’un diabète auto-immun, mais ne peuvent pas confirmer le diagnostic avec certitude compte tenu de la prévalence élevée du DT2 dans cette population. Il faut également envisager la possibilité de tests faux positifs. Selon A. Jones, les tests courants détectent des auto-anticorps chez jusqu'à 5% des témoins sains. À l’avenir, des scores de risque génétique pourraient être utilisés pour différencier le DT1 et le DT2 en cas de doute. Un DT1 supposé avec anticorps négatifs s’avère souvent être un DT2 lorsque le risque génétique plaide en faveur du DT2. En cas de risque génétique de DT1, il s’agit en revanche généralement d’un DT1, même en l’absence d’auto-anticorps.
Source:
61e congrès annuel de l’European Association for the Study of Diabetes (EASD), du 15 au 19 septembre 2025, à Vienne
Littérature:
1 Gloyn AL et al.: Activating mutations in the gene encoding the ATP-sensitive potassium-channel subunit Kir6.2 and permanent neonatal diabetes. N Engl J Med 2004; 350: 1838-49 2 Pearson ER et al.: Switching from insulin to oral sulfonylureas in patients with diabetes due to Kir6.2 mutations. N Engl J Med 2006; 355: 467-77 3 De Franco E et al.: The effect of early, comprehensive genomic testing on clinical care in neonatal diabetes: an international cohort study. Lancet 2015; 386: 957-63 4Shields BM et al. Can clinical features be used to differentiate type 1 from type 2 diabetes? A systematic review of the literature. BMJ Open 2015; 5: e009088 5 Mirshahi UL et al.: Reduced penetrance of MODY-associated HNF1A/HNF4A variants but not GCK variants in clinically unselected cohorts. Am J Hum Genet 2022; 109: 2018-28
Das könnte Sie auch interessieren:
Les incrétinomimétiques dans les études cliniques
Des études de phase III présentées dans le cadre du congrès de l’EASD 2025 ont examiné l’efficacité de médicaments ciblant les récepteurs au GLP. Entre autres, on dispose désormais de ...
Urgences diabétologiques: hypo- et hyperglycémie
L’insuline ou les sulfonylurées sont la deuxième et la quatrième cause d’hospitalisation d’urgence liée aux médicaments.1 Lors du FOMF Update Refresher médecine interne générale, le Pr ...
Cœur, vaisseaux et yeux: données sur l’efficacité et la tolérance du sémaglutide
Outre des résultats positifs en termes d’efficacité dans le traitement du diabète de type 2 (DT2) et la régulation du poids, les agonistes des récepteurs du GLP-1 (GLP-1-RA) présentent ...