Nouveautés concernant la prophylaxie de la GVHD et l’évaluation du risque en cas de myélofibrose
Compte-rendu:
Dre méd. vét. Therese Schwender
La prophylaxie de la maladie du greffon contre l’hôte («Graft-versus-Host Disease»; GVHD) reste un défi majeur après une allogreffe de cellules souches. Lors du congrès de l’European Society for Blood and Marrow Transplantation (EBMT) de cette année, de nouveaux développements ont été discutés à ce sujet: des plans d’utilisation optimisés de médicaments éprouvés aux manipulations complexes de greffons, en passant par des substances actives innovantes. En outre, un outil basé sur l’IA a été présenté afin d’améliorer l’évaluation du risque chez les personnes atteintes de myélofibrose avant la greffe.
L’une des sessions du congrès de l’EBMT de cette année était consacrée à la prophylaxie de la GVHD. Dans son introduction, le Dr méd. Benjamin Watkins (Nouvelle-Orléans/États-Unis) a souligné que de multiples études sont actuellement menées sur ce sujet. Il faut toutefois noter qu’elles sont également très hétérogènes en ce qui concerne des facteurs tels que la maladie sous-jacente, l’intensité du schéma thérapeutique ou encore l’âge des donneur·ses. «Il n’existe pas non plus de véritable consensus sur le critère d’évaluation à utiliser», a-t-il poursuivi. Les critères d’évaluation composites, tels que la survie sans GVHD ni rechute («GVHD-free, relapse-free survival»; GRFS), ne sont pas définis de manière uniforme.
Comme l’a expliqué B. Watkins, des substances telles que l’abatacept (ABA), le cyclophosphamide (Cy) ainsi que la globuline antithymocyte (ATG) se sont entre-temps révélées supérieures aux substances de référence historiques que sont les inhibiteurs de la calcineurine (ICN) et le méthotrexate (MTX), et sont utilisées de manière standard dans de nombreux endroits. «L’immunosuppression supplémentaire a toutefois un prix, puisqu’elle s’accompagne de risques tels qu’une diminution de la reconstitution immunitaire, des infections et un taux accru de récidive», a-t-il déclaré. C’est pourquoi il est toujours nécessaire de trouver de nouvelles approches pour la prophylaxie de la GVHD.
De nouvelles approches avec des substances éprouvées
Une nouvelle approche possible consiste à modifier l’utilisation de substances déjà éprouvées. Dans ce contexte, B. Watkins a fait référence à l’étude de phaseII OPTIMIZE en cours.1
Elle examine des doses plus faibles de cyclophosphamide post-greffe (PTCy, 25mg/kg ou 37,5mg/kg les jours 3 et 4 au lieu de 50mg/kg). Cela devrait contribuer à réduire le taux d’infections en cas de prophylaxie de la GVHDchez les personnes atteintes de néoplasie hématologique après une greffe de cellules souches du sang périphérique (PBSC) provenant d’un donneur non apparenté HLA-incompatible («mismatched unrelated donor», MMUD). D’autres études en cours, comme ABA3, examinent des schémas posologiques à long terme à base d’ABA/tacrolimus/MTX (jusqu’au jour 150) chez des patient·es pédiatriques et adultes, notamment en ce qui concerne la prophylaxie de la GVHD chronique (cGVHD).2
Des schémas sans ICN sont également étudiés. Chez des adultes atteint·es de néoplasie hématologique et ayant un donneur HLA-compatible, une étude a examiné une PBSC avec sélection CD34 ainsi qu’une prophylaxie par PTCy après une greffe de moelle osseuse par rapport au tacrolimus (TAC) plus MTX après une greffe de moelle osseuse (contrôle).3
La sélection CD34 a entraîné des taux significativement plus faibles de GVHD aiguë (aGVHD) et de cGVHD, mais aussi une mortalité plus élevée par rapport au PTCy et au TAC plus MTX. Cela s’expliquait par un taux accru d’infections et de récidives. «Cette approche semble donc avoir conduit globalement à une immunosuppression trop importante», a commenté B. Watkins à propos des résultats.
Une autre possibilité d’amélioration de la prophylaxie de la GVHD est l’utilisation combinée de médicaments éprouvés. Dans ce contexte, l’intervenant a mentionné l’étude de phaseIb/II CAST, qui a examiné une combinaison de PTCy, d’ABA et de l’administration temporaire de TAC dans le cadre d’une PBSC haplo-identique.4
«Avec 6% d’aGVHD de grade3–4 et 16% de cGVHD modérée à sévère, ainsi qu’une GRFS à 1 an de 66%, l’étude a montré des résultats vraiment encourageants», a estimé B. Watkins.
Étude portant sur de nouvelles substances actives
Il a ensuite présenté quelques études portant sur de nouvelles substances. La première était le védolizumab, un anticorps monoclonal humanisé immunomodulateur qui se lie à l’intégrine α4β7 exprimée sur les lymphocytes pathogènes soumis à l’écotaxie intestinale et inhibe sélectivement l’adhésion de ces cellules à la molécule-1 d’adhérence cellulaire d’adressine muqueuse (MAdCAM-1). «Le védolizumab empêche les cellules T exprimant l’intégrine α4β7 de migrer vers le tissu intestinal et de déclencher une GVHD», a expliqué B. Watkins. Une étude de phaseIII randomisée a évalué le védolizumab ou le placebo (jours –1, +13, +41, +69, +97, +125 et +153) en combinaison avec la prophylaxie de référence (ICN plus MTX/mycophénolate mofétil).5
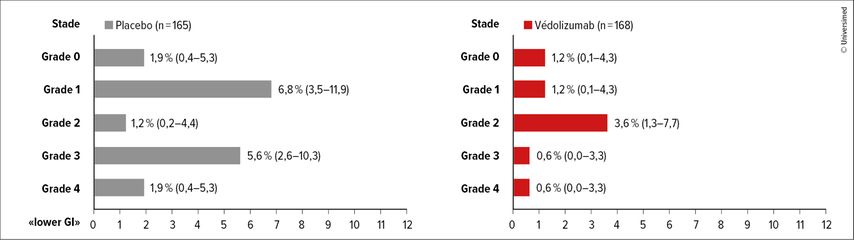
«Il est important de souligner qu’en raison du mécanisme d’action de la substance, il s’agissait ici uniquement de réduire la GVHD gastro-intestinale», a-t-il déclaré. Dans le groupe sous védolizumab par rapport à celui sous placebo, un taux plus faible d’aGVHD du tractus gastro-intestinal inférieur («lower GI») ainsi qu’une survie sans aGVHD «lower GI» significativement plus longue ont été démontrés (Fig.1).
Fig.1: Taux d’aGVHD «lower GI» dans le bras sous placebo et dans celui sous védolizumab, selon le stade clinique maximal5
Outre le védolizumab, des résultats d’études encourageants ont été obtenus sur les inhibiteurs de Janus kinase. Le ruxolitinib, en particulier, a donné de bons résultats en combinaison avec l’association TAC plus MTX chez les adultes âgé·es ayant des donneur·ses PBSC apparenté·es (aGVHD: grade3–4: 5%; cGVHD à 2 ans modérée à sévère: 16%; GRFS à 2 ans: 62%).6
«Cela a conduit au lancement de l’étude de phaseIII PROGRESS, qui évalue désormais le ruxolitinib, le tacrolimus et le méthotrexate par rapport au cyclophosphamide post-greffe, au tacrolimus et au mycophénolate mofétil», a déclaré l’intervenant.
En outre, des études intensives sont menées sur les méthodes de manipulation des greffons, comme la déplétion des cellulesTαβ. Ce procédé vise à éliminer de manière ciblée les cellules T responsables de la GVHD, tout en préservant les fonctions de protection immunitaire.7
Dans des études menées sur une population pédiatrique, la déplétion des cellules T αβ/CD19 a entraîné des taux remarquablement faibles de GVHD avec un taux élevé de survie à long terme, mais avec une diminution de la reconstitution immunitaire.8
Comme l’a souligné B. Watkins en conclusion, il n’existe actuellement aucune substance de référence reconnue pour la prévention de la GVHD, à l’exception du PTCy en cas de greffe haplo-identique. Le PTCy, l’ATG et l’ABA se sont révélés supérieurs à l’association ICN plus MTX dans les études, raison pour laquelle cette dernière ne doit plus être utilisée dans le bras de contrôle dans les études. «Parmi les nouvelles approches, toutes se sont avérées prometteuses dans une certaine mesure, mais aucune n’était clairement supérieure. Chaque schéma présente des risques et des bénéfices. Il sera de plus en plus difficile à l’avenir de savoir quelle est la meilleure option, à moins que nous ne commencions à mener des études comparatives directes», a-t-il ajouté.
Calcul du risque de greffe en cas de myélofibrose
La détermination du risque de greffe chez les personnes atteintes de myélofibrose (MF) a été le sujet de la présentation du Dr méd. Adrián Mosquera Orgueira (Saint-Jacques-de-Compostelle/Espagne), hématologue et expert en apprentissage automatique (ML). «La décision d’effectuer une greffe chez une personne atteinte de myélofibrose est souvent très complexe et seulement 10% des patient·es environ subissent effectivement une greffe. Comme il n’existe aucun outil d’évaluation du risque, nous pouvons généralement uniquement nous fier à notre expérience personnelle pour prendre cette décision difficile, et non à des critères bien définis», a-t-il déclaré.
En collaboration avec le Dr méd. Juan Carlos Hernández-Boluda (Valence/Espagne), premier auteur de la publication parue pratiquement au même moment dans la revue Blood, et une équipe de chercheur·ses, A. Mosquera Orgueira a donc tenté d’améliorer l’évaluation du risque chez les personnes atteintes de MF à l’aide d’un outil de ML.9
Pour ce faire, l’équipe a identifié 5183 adultes atteint·es de MF provenant de 288 centres enregistrés auprès de l’EBMT et ayant subi une première allogreffe de cellules souches entre 2005 et 2020. Parmi ces ensembles de données, 3887 ont été utilisés pour entraîner l’algorithme et 1296 pour évaluer et valider le nouveau modèle. Le modèle de l’équipe de chercheur·ses, basé sur les «random survival forests» (RSF), a finalement permis d’obtenir de meilleurs résultats par rapport à différentes méthodes de comparaison (dont le modèle CIBMTR). D’une part, il a donné des résultats plus reproductibles. D’autre part, il a surpassé les modèles de référence en termes de précision. Il a identifié 25% des personnes atteintes de MF comme étant des patient·es à haut risque (par rapport au 10,1% avec un modèle basé sur Cox et 8,2% avec le modèle CIBMTR), avec une probabilité de décès dans l’année suivant la greffe de 40%.
Calculateur de risque en libre accès
L’équipe de chercheur·ses a depuis traduit son modèle basé sur les RSF en un calculateur en ligne en libre accès ( https://gemfin.click/ebmt/ ). Cet outil prédit la survie globale des personnes atteintes de MF après la greffe sur la base de 10 paramètres (âge, statut de performance, indice de comorbidité, paramètres hématologiques, type de donneur, intensité du conditionnement et type de prophylaxie de la GVHD).
L’intervenant a toutefois souligné que l’étude présentait certaines limites, notamment le fait qu’elle se basait sur un registre de patient·es dans lequel il manquait des données pour certaines variables, dont le grade de myélofibrose et la présence de mutations somatiques supplémentaires au moment de la greffe. Les chercheur·ses espèrent à l’avenir pouvoir collecter les données réelles saisies et inclure d’autres facteurs spécifiques de la maladie afin d’améliorer l’applicabilité du modèle. «En résumé, notre outil répond à trois conditions essentielles pour intégrer efficacement l’intelligence artificielle dans la médecine», a déclaré A. Mosquera Orgueira. «Premièrement, il est largement applicable, c’est-à-dire que les variables sur lesquelles se base le modèle sont facilement identifiables, quel que soit le système de santé. Deuxièmement, il est disponible en libre accès en ligne et donc facilement accessible. Et troisièmement, il est cliniquement exploitable. Il aide les équipes multidisciplinaires à décider si une greffe doit être effectuée ou si d’autres options médicales doivent être envisagées, et le personnel soignant ainsi que les personnes concernées à prendre des décisions plus éclairées», a-t-il précisé.
Source:
51st Annual Meeting of the EBMT, 30 mars au 2 avril 2025, Florence, Italie, et en ligne
Littérature:
1 HLA-mismatched unrelated donor peripheral blood stem cell transplantation with reduced dose post transplantation cyclophosphamide GvHD prophylaxis (OPTIMIZE). https://clinicaltrials.gov/study/NCT06001385 2 Extended vs short-term abatacept dosing for graft versus host disease prophylaxis (ABA3). https://clinicaltrials.gov/study/NCT04380740 3 Luznik L et al.: Randomized phase III BMT CTN trial of calcineurin inhibitor-free chronic graft-versus-host disease interventions in myeloablative hematopoietic cell transplantation for hematologic malignancies. J Clin Oncol 2022; 40(4): 356-68 4 Al-Homsi AS et al.: PTCy, abatacept, and a short course of tacrolimus for GVHD prevention after haploidentical transplantation. Blood Adv 2023; 7(14): 3604-11 5 Chen YB et al.: Vedolizumab for the prevention of intestinal acute GVHD after allogeneic hematopoietic stem cell transplantation: a randomized phase 3 trial. Nat Med 2024; 30(8): 2277-87 6 DeFilipp Z et al.: Low rates of chronic graft-versus-host disease with ruxolitinib maintenance following allogeneic HCT. Blood 2025; doi: 10.1182/blood.2024028005. Epub ahead of print 7 Pistoia V et al.: Human γδ t-cells: from surface receptors to the therapy of high-risk leukemias. Front Immunol 2018; 9: 984 8 Merli P et al.: TCRαβ/CD19 cell-depleted HLA-haploidentical transplantation to treat pediatric acute leukemia: updated final analysis. Blood 2024; 143(3): 279-89 9 Hernandez-Boluda JC et al.: Use of machine learning techniques to predict poor survival after hematopoietic cell transplantation for myelofibrosis. Blood 2025; doi: 10.1182/blood.2024027287
Das könnte Sie auch interessieren:
«Grâce à la Young Oncology Academy, j’ai pu me constituer un réseau»
La Young Oncology Academy (Academy) du Swiss Cancer Institute est un programme de promotion et de mentorat pour les jeunes oncologues. Le programme s’adresse aux médecins-assistants qui ...
«Ce serait bien d’établir un lien»
Le cancer du poumon de Michael Emmenegger-Müller a changé sa vie, mais pas sa motivation à s’engager pour les autres. Il a fondé l’organisation «Leben mit Lungenkrebs» (Vivre avec le ...
Anticorps bispécifiques dans les lymphomes indolents et agressifs
Les anticorps bispécifiques ont acquis une place de choix dans le traitement des lymphomes indolents et agressifs. Initialement, des études ont été menées sur les anticorps bispécifiques ...