Anticorps bispécifiques dans les lymphomes indolents et agressifs
Auteure:
Prof. Dre méd. Felicitas Hitz
Onkologie/Hämatologie
Kantonsspital St.Gallen
E-mail: felicitas.hitz@kssg.ch
Les anticorps bispécifiques ont acquis une place de choix dans le traitement des lymphomes indolents et agressifs. Initialement, des études ont été menées sur les anticorps bispécifiques dans différents sous-types de lymphomes indolents et agressifs. Les résultats de vastes études de phaseII/III sur les lymphomes folliculaires et sur les lymphomes à grandes cellules B sont désormais disponibles. L’article suivant aborde les principaux résultats.
Keypoints
-
Les substances activant les cellules T, telles que les anticorps bispécifiques et les traitements par cellules CAR-T, ont considérablement modifié les algorithmes thérapeutiques des lymphomes.
-
En cas de récidive, les anticorps bispécifiques constituent une option thérapeutique efficace dans les lymphomes folliculaires et les lymphomes diffus à grandes cellules B, et présentent peu de complications lorsqu’ils sont utilisés de manière appropriée.
-
La première administration doit être effectuée dans le cadre d’une hospitalisation et s’accompagner d’un traitement préalable par la dexaméthasone ainsi que d’une augmentation progressive de la dose.
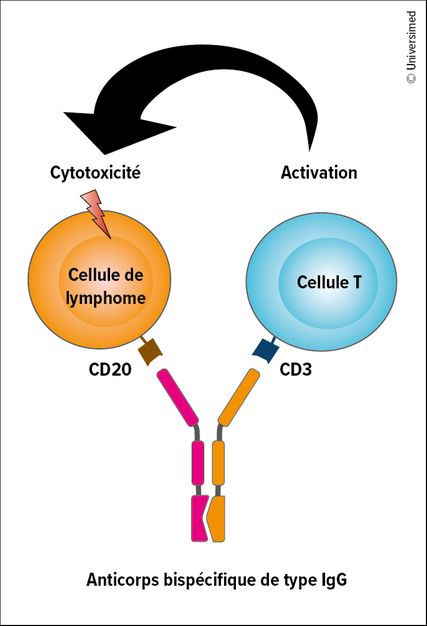
Mécanisme d’action des anticorps bispécifiques
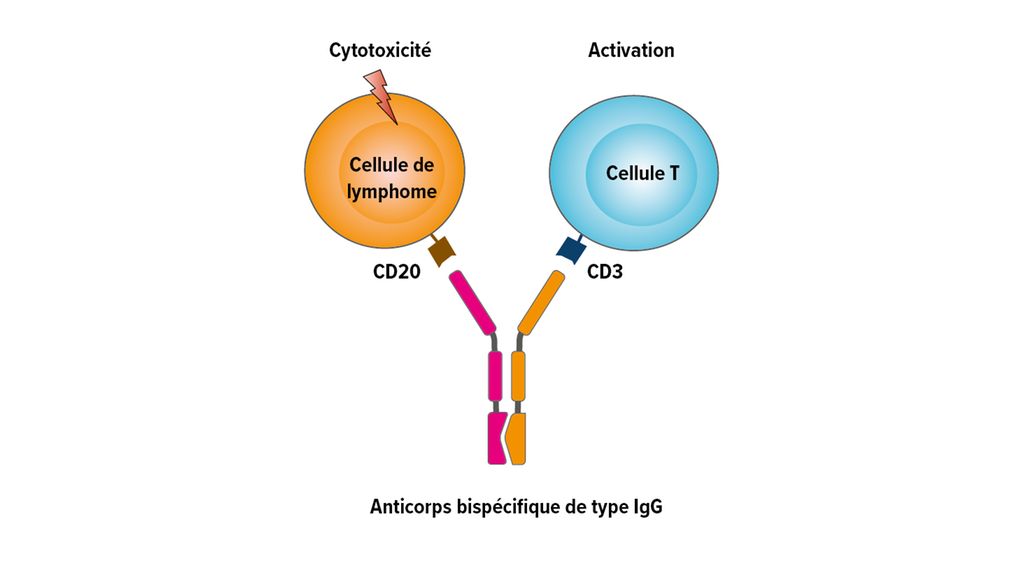
Fig.1: Structure et mécanisme d’action des anticorps bispécifiques (modifiée selon Falchi L et al.)2
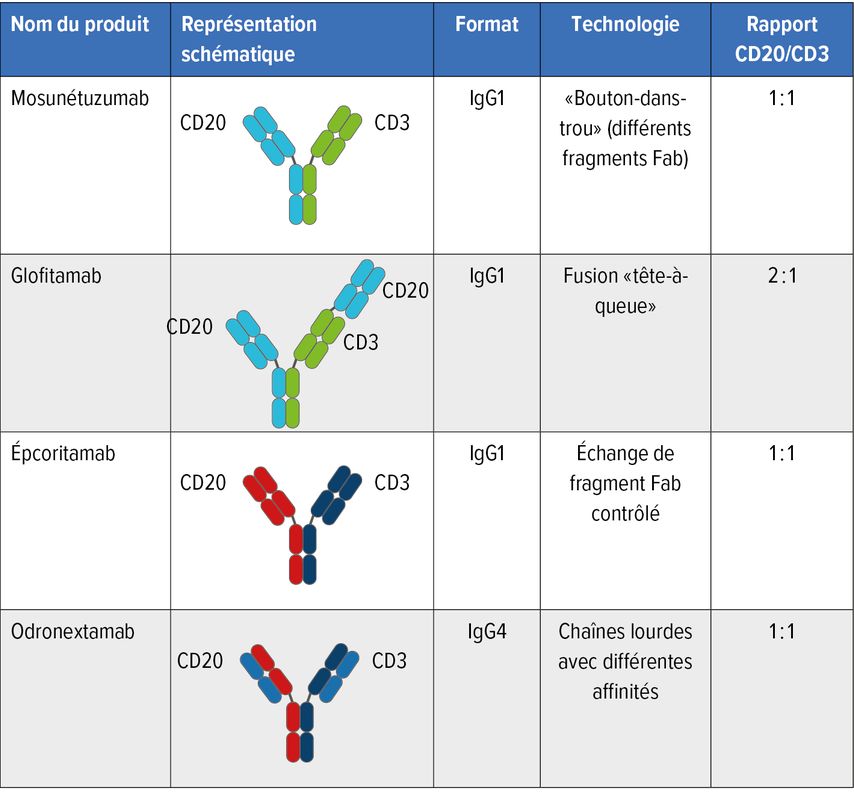
Le mécanisme d’action des anticorps bispécifiques est basé sur la liaison entre les récepteurs des cellules T et un antigène spécifique de la tumeur à la surface du lymphome (Fig. 1). Les anticorps bispécifiques actuellement les plus avancés dans les études cliniques (glofitamab, épcoritamab, odronextamab, mosunétuzumab) sont comparables à une structure d’anticorps de type IgG. L’activation des cellules T se fait par la liaison de CD3 et CD20 (Fig. 2).
Une activation excessive des cellules T provoque un effet secondaire caractéristique, le syndrome de libération de cytokines (CRS). Les symptômes neurologiques sont nettement moins fréquents sous anticorps bispécifiques que sous traitement par cellules CAR-T. Le risque de complication sévère est réduit par un traitement préalable, une augmentation progressive de la dose et une administration par voie souscutanée.
Fig.2: Les quatre anticorps bispécifiques les plus avancés à ce jour (modifiée selon Falchi L et al.)2
Le traitement préalable par la dexaméthasone entraîne une expression nettement plus faible du CRS et s’est donc établi comme référence.1
Pour le glofitamab, une administration d’obinutuzumab est recommandée avant la première administration, ce qui atténue également la toxicité aiguë.2
Tous les anticorps bispécifiques sont initialement administrés dans le cadre d’une hospitalisation par augmentation progressive de la dose. L’administration par voie sous-cutanée entraîne une concentration maximale retardée et moins élevée par rapport à l’administration par voie intraveineuse, ce qui contribue à son tour à une expression plus faible du CRS.
Lymphomes agressifs
Les anticorps bispécifiques (glofitamab, épcoritamab, odronextamab) se fixant aux récepteurs des cellules T CD3 et des cellules B CD20 ont finalement été testés pour les lymphomes à grandes cellules B. Dans d’autres entités de lymphomes à cellules B agressifs, comme le lymphome à cellules du manteau, on dispose jusqu’à présent de données issues d’une étude de phaseI/II portant sur une petite population.3
Monothérapie en cas de récidive
Les anticorps bispécifiques épcoritamab, glofitamab et odronextamab sont testés en monothérapie en cas de récidive de lymphome à grandes cellules B. Les patient·es inclus·es étaient ceux·celles qui avaient reçu au moins deux lignes de traitement précédentes et qui avaient un bon statut de performance ECOG, un lymphome diffus à grandes cellules B (DLBCL), un lymphome folliculaire (FL) avec transformation, un lymphome médiastinal primitif ou un lymphome de haut grade avec réarrangement de MYC et BCL2/BCL6.
Le traitement préalable ainsi que l’augmentation de la dose de glofitamab et d’épcoritamab sont différents, tout comme la durée du traitement. Le glofitamab est dosé sur une période définie de douze cycles, tandis que l’épcoritamab est administré jusqu’à la progression de la maladie.
La réponse, la toxicité et l’efficacité du glofitamab et de l’épcoritamab en monothérapie en cas de récidive sont comparables, avec respectivement une CR de 39% dans les deux cas ainsi qu’un ORR de 52% et de 63%.4,5
L’odronextamab présente un taux de réponse légèrement inférieur avec une CR/un ORR de 31% par rapport à 52%.6
Après une durée de suivi de trois ans (durée de suivi médiane: 37,7 mois), les patient·es traité·es par le glofitamab et en rémission complète après douze cycles de traitement présentent un taux de survie globale (OS) de 77% à 24 mois.7
Les résultats obtenus sous épcoritamab en administration continue (durée de suivi médiane: 37,1 mois) sont à nouveau comparables, avec 63% des patient·es en rémission complète et durable à trois ans.8
Traitement combiné en cas de récidive
Les traitements combinés avec une chimiothérapie «de sauvetage» de référence en cas de récidive d’un lymphome diffus à grandes cellules B montrent des résultats positifs pour glofitamab+rituximab-GemOx par rapport à rituximab-GemOx chez les patient·es non éligibles pour une greffe après une durée de suivi médiane de 27 mois, avec un avantage en termes de survie de 25,5 mois (18,3–NE) par rapport à 12,9 mois (7,9–18,5) (HR [IC à 95%]: 0,62 [0,43–0,88]; p=0,006). Avec ce résultat, le critère d’évaluation primaire de OS a été atteint pour la première fois pour un anticorps bispécifique CD3xCD20 dans une étude de phase III.9
Une étude de phaseIb/II portant sur la combinaison épcoritamab+rituximab-GemOx a récemment été publiée. Les patient·es non éligibles pour une greffe et ayant reçu un ou plusieurs traitements préalables ont également été inclus·es. Une nette différence apparaît dans la réponse en fonction du nombre de traitements préalables (CR: première ligne: 74%; >deuxième ligne: 53%). La durée médiane de la rémission complète était de 23,6 mois.10
Sur la base de ces résultats, les anticorps bispécifiques se combinent parfaitement pour l’immunochimiothérapie «de sauvetage» de référence par rituximab+gemcitabine/oxaliplatine, aussi bien avant une allogreffe de cellules souches qu’en transition avant un traitement par cellules CAR-T.
Traitement de première intention
Les résultats de plusieurs études de phaseIII menées sur des patient·es atteint·es de lymphomes à grandes cellules recevant une immunochimiothérapie de référence par des anticorps bispécifiques en première ligne sont attendus avec impatience. Toutes les études de phaseIII ont inclus des patient·es à haut risque atteint·es de lymphomes à grandes cellules B sur la base d’un score IPI élevé. Dans toutes les études mentionnées ici, les lymphomes primitifs du SNC ont été exclus.
L’étude SKYGLO évalue la combinaison glofitamab+polatuzumab-rituximab-CHP par rapport à ce bras de référence. Le recrutement pour cette étude internationale s’est achevé à l’automne 2024.11
Une étude de phaseIII randomisée portant sur la combinaison épcoritamab+rituximab-CHOP a choisi le rituximab-CHOP comme bras de référence.12
Une autre étude sur l’odronextamab n’utilise aucun anticorps CD20 complémentaire et est conçue uniquement avec la combinaison odronextamab+CHOP, car le site de liaison à l’antigène CD20 est identique à celui du rituximab, respectivement de l’obinutuzumab.13
Lymphomes indolents
Monothérapie en cas de récidive
Dans les études de phaseII sur les lymphomes folliculaires récidivants, les données sur les anticorps bispécifiques mosunétuzumab,14 épcoritamab15 et odronextamab16 sont disponibles après plus de deux traitements préalables.
Les études diffèrent par leur mode d’administration, le mosunétuzumab et l’odronextamab étant administrés par voie intraveineuse et l’épcoritamab par voie souscutanée. Le mosunétuzumab et l’odronextamab ont été testés en tant que traitements planifiés, l’épcoritamab jusqu’à la progression de la maladie. Les taux de réponse globale de ≈80% et les taux de rémission complète sont comparables: mosunétuzumab: 60%, épcoritamab: 62,5% et odronextamab: 73%, avec des taux de CRS de grade1 (45%) et de toxicité neurologique de grade1 (5%) également comparables. L’effet secondaire le plus fréquent de toutes les substances était une neutropénie à ≈25%.
Le mosunétuzumab, la substance dont la durée de suivi est la plus longue, présente une PFS médiane de 24 mois (IC à 95%: 12,0–NE) après une durée de suivi médiane de 37,4 mois.17 Il a également une PFS médiane de 17,8 mois et une OS médiane non encore atteinte dans le groupe défavorable des patient·es atteint·es d’un lymphome ayant progressé dans les deux ans et présentant une mutation TP53 ainsi que ceux·celles atteint·es d’un lymphome réfractaire après une immunochimiothérapie en première ligne.14,18
L’étude NHL-1 portant sur l’épcoritamab montre, après une durée de suivi de 17,4 mois, un taux de PFS de 49,8% (39,0–59,1) pour l’ensemble des patient·es ayant répondu au traitement et un taux de PFS de 73,8% en cas de rémission complète.15 Après une durée de suivi de 20,1 mois, l’odronextamab a obtenu une PFS médiane de 20,7 mois (IC à 95%: 17,2–27,5) et une PFS de 27,8 mois (IC à 95%: 23,0–NE) pour les rémissions complètes.16
Traitement combiné en cas de récidive
Dans l’indication après un ou plusieurs traitements préalables, les trois derniers anticorps bispécifiques dont il a été question font actuellement l’objet d’une étude de phaseIII (CELESTIMO, EPCORE FL-1, OLYMPIA-5).19–20
Aucune donnée n’est encore disponible pour le critère d’évaluation primaire des trois études, à savoir la PFS.
Le bras de référence a été défini comme celui recevant rituximab+lénalidomide (R2), un schéma thérapeutique sans chimiothérapie établi en cas de récidive de lymphome folliculaire, qui a démontré une PFS médiane de 40 mois après six cycles de traitement dans l’étude de phaseIII AUGMENT.21
Le traitement a été administré pour les trois anticorps bispécifiques sur une durée fixe de douze cycles.
Les premiers résultats de l’étude EPCOREFL-1 publiés pour la combinaison épcoritamab+R2 après douze cycles se limitent aux résultats du bras de traitement après une durée de suivi d’au moins deux ans. Les patient·es à haut risque ayant montré une progression après une immunochimiothérapie (POD24) et les patient·es réfractaires primaires ont également été inclus·es.
La plupart des patient·es avaient reçu un traitement préalable par des anthracyclines ou des alkylants, et un nombre très faible avaient déjà suivi un traitement par cellules CAR-T. L’ORR était de 96% et le taux de CR de 87%, indépendamment de la constellation de risque. La PFS à 24 mois estimée était de 70%.19
Les premiers résultats de l’étude CELESTIMO évaluant mosunétuzumab+lénalidomide par rapport à rituximab+lénalidomide chez les patient·es ayant reçu plus d’un traitement préalable seront bientôt présentés.19
Aucune donnée n’a encore été publiée pour l’étude de phaseIII OLYMPIA-5 portant sur l’odronextamab.20
Résumé
Les anticorps bispécifiques ont pris une importance considérable dans le traitement des lymphomes et ont redéfini l’algorithme thérapeutique. Que ce soit en monothérapie en cas de récidive de lymphome à grandes cellules ou en traitement combiné par immunochimiothérapie, ils permettent d’obtenir une bonne réponse et, une fois la rémission complète atteinte, une longue période sans progression.
Dans le cas des lymphomes folliculaires, les schémas thérapeutiques sans chimiothérapie sont déjà établis et deviendront très probablement une nouvelle option thérapeutique sans chimiothérapie grâce aux études de phaseIII encore en cours.
Littérature:
1 Crombie JL et al.: Consensus recommendations on the management of toxicity associated with CD3 x CD20 bispecific antibody therapy. Blood 2024; 143(16): 1565-75 2Falchi L et al.: Bispecific antibodies for the treatment of B-cell lymphoma: promises, unknowns, and opportunities. Blood 2023; 141(5): 467-80 3 Phillips TJ et al.: Glofitamab in relapsed/refractory mantle cell lymphoma: results from a phase I/II study. J Clin Oncol 2024; 43(3): 318-28 4 Dickinson MJ et al.: Glofitamab for relapsed of refractory diffuse large B-cell lymphoma. New Engl J Med 2022; 387(24): 2220-31 5 Thieblemont C et al.: Epcoritamab, a novel, subcutaneous CD3 x CD20 bispecific T-cell engaging antibody, in relapsed or refractory large B-cell lymphoma: dose expansion in a phase I/II trial. J Clin Oncol 2023; 41(12) 6Ayyappan S et al.: Final analysis of the phase 2 ELM-2 study:odronextamab in patients with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL). Blood 2023; Abstr. #436 7 Dickinson MJ et al.: Fixed-duration glofitamab monotherapy continues to demonstrate durable responses in patients with relapsed or refractory large B-cell lymphoma: 3-year follow-up from a pivotal phase II study. ASH 2024; Abstr. #865 8 Vose JM et al.: 3-year update from the EPCORE NHL-1 trial: epcoritamab leads to deep and durable responses in relapsed or refractory large B-cell lymphoma. ASH 2024; Abstr. #4480 9 Abramson JS et al.: Glofitamab plus gemcitabine and osaliplatin (GemOx) versus rituximab-GEmOs for relapsed or refractory diffuse large B-cell lymphoma (STARGLO): a global phase 3, randomized, open-label trial Lancet 2024; 404(10466): 1940-54 10 Brody JD et al.: Epcoritamab plus GemOx in transplant-ineligible relapsed/refractory DLBCL: results from the EPCORE NHL-2 trial. Blood 2025 11 Advani RH et al.: SKYGLO: a global phase III randomized study evaluating glofitamab plus polatuzumab vedotin + rituximab, cyclophosphamide, doxorubicin, and prednisone (Pola-R-CHP) versus Pola-R-CHP in previously untreated patients with large B-cell lymphoma (LBCL). ASH 2024; Abstr. #1718.1 12 Sehn LH et al.: Phase 3 trial of subcutaneous epcoritamab + RCHOP versus R-CHOP in patients (pts) with newly diagnosed diffuse large B-cell lymphoma (DLBCL): EPCORE DLBCL-2. Hematol Oncol 2023; 41(S2): 849-50 13 Tessoulin B et al.: Trial in progress: Phase 3 trial evaluating the efficacy and safety of odronextamab plus CHOP (O-CHOP) versus R-CHOP in previously untreated diffuse large B-cell lymphoma (OLYMPIA-3). Hemasphere 2023; 7(S3): e06798be 14Budde LE et al.: Safety and efficacy of mosunetuzumab, a bispecific antibody, in patients with relapsed or refractory follicular lymphoma: asingle-arm, multicentre, phase 2 study. Lancet Oncol 2022; 23(8): 1055-65 15 Linton KM et al.: Epcoritamab monotherapy in patients with relapsed or refractory follicular lymphoma (EPCORE NHL-1): a phase 2 cohort of a single-arm, multicentre study. Lancet Haematol 2024; 11(8): e593-605 16 Kim TM et al.: Safety and efficacy of odronextamab in patients with relapsed or refractory follicular lymphoma. Ann Oncol 2024; 35(11): 1039-47 17 Sehn LH et al.: Long-term 3-year follow-up of mosunetuzumab in relapsed or refractory follicular lymphoma after ≥2prior therapies. Blood 2025; 145(7): 708-19 18 Assouline S et al.: Mosunetuzumab demonstrates clinically meaningful outcomes in high-risk patients with heavily pre-treated R/R FL after ≥3 years of follow-up: subgroup analysis of a pivotal phase II study. EHA 2024; Abstr. #S233 19Falchi L et al.: Fixed-duration epcoritamab + R2 drives deep and durable responses in patients with relapsed or refractory follicular lymphoma: 2-year follow-up from arm 2 of the EPCORE NHL-2 trial. Blood 2024; 144(Suppl. 1): 342 20 Vitolo U et al.: Phase 3 trial of odronextamab plus lenalidomide versus rituximab plus lenalidomide in relapsed/refractory (R/R) follicular lymphoma (FL) and marginal zone lymphoma (MZL; OLYMPIA-5). ASCO 2022; Abstr. #TPS7094 21 Leonard JP et al.: AUGMENT: aphase III study of lenalidomide plus rituximab versus placebo plus rituximab in relapsed or refractory indolent lymphoma. JClin Oncol 2019; 37(14): 1188-99
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...