Microbiotes cibles dans le traitement des maladies gastro-intestinales
Auteur:
Dr méd. Adrian Frick
Universitätsklinik für Innere Medizin III
Gastroenterologie und Hepatologie
Medizinische Universität Wien
E-mail: adrian.frick@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Différents paramètres tels que l’alimentation, les antibiotiques et les maladies peuvent avoir une influence sur le microbiote. Les modifications de sa composition sont associées à de nombreuses maladies gastro-intestinales. C’est pourquoi on essaie de le moduler par transplantation de microbiote fécal (TMF).
Keypoints
-
Le microbiote est un système dynamique et fluctuant qui évolue en permanence. Il n’existe aucune composition «saine» du microbiote qui soit universellement valable.
-
Il n’y a aucune standardisation de la TMF et la conception des études est hétérogène, c’est pourquoi il n’est actuellement pas possible de formuler une recommandation claire pour la TMF en cas de MICI ou de SCI.
-
L’indication de la TMF reste limitée aux ICD récidivantes ou réfractaires. La TMF pourrait être une alternative valable aux traitements antimicrobiens répétés et être éventuellement envisagée à l’avenir comme traitement de première ligne.
-
Elle présente un potentiel en tant que traitement adjuvant aux inhibiteurs de points de contrôle immunitaires.
-
À l’avenir, l’accent devrait être mis sur la précision et la concordance, dans le but d’obtenir une modulation adéquate, plutôt que sur le don non caractérisé sur le plan fonctionnel, qui représente une perturbation microbienne chez le·a receveur·se.
Le microbiote humain, en particulier dans le tractus gastro-intestinal, est un ensemble fascinant et complexe de micro-organismes. Il abrite plus de 4000 espèces microbiennes et comprend environ 170 millions de gènes. Outre les bactéries, le microbiote comprend également des archées, des champignons, des virus et des parasites, ce qui souligne son immense diversité et sa complexité.
Les phyla dominants dans le microbiote intestinal humain sont les Bacillota (Firmicutes) et les Bacteroidetes. En outre, les Actinomycetota (Actinobacteria), Pseudomonadota (Proteobacteria), Fusobacteriia et Verrucomicrobiia jouent également un rôle. Ces micro-organismes interagissent de multiples façons entre eux et avec leur hôte humain, remplissant ainsi de nombreuses fonctions essentielles à la santé du tractus gastro-intestinal et de l’ensemble du corps. Chez un hôte en bonne santé, cette communauté microbienne reste relativement stable, bien que l’activité métabolique des micro-organismes puisse varier considérablement.1
Caractéristiques du microbiote gastro-intestinal
Le microbiote gastro-intestinal est essentiel pour la digestion des glucides complexes que le corps humain ne peut pas dégrader lui-même. Par fermentation de ces substances, les microbes produisent des acides gras à chaîne courte, tels que le butyrate, le propionate et l’acétate, qui constituent une source d’énergie importante pour les cellules intestinales et ont des propriétés anti-inflammatoires. De plus, le microbiote favorise la formation et le maintien de la barrière intestinale, qui sert de bouclier contre les micro-organismes pathogènes et régule l’absorption des nutriments.2
Une autre caractéristique importante du microbiote gastro-intestinal est son rôle dans l’éducation et la modulation du système immunitaire. Dès la naissance, le microbiote contribue à la maturation du système immunitaire et aide à développer une tolérance immunologique aux microbes inoffensifs et aux antigènes alimentaires, tout en constituant une défense contre les agents pathogènes.3 Bien qu’il faille noter qu’il existe des différences intra- et interindividuelles considérables dans le microbiote, de sorte qu’aucune composition spécifique n’est considérée comme une condition préalable à un bon état de santé. Au contraire, le microbiote «normal» est unique à chaque personne.4 La plupart des analyses du microbiote sont descriptives et il subsiste encore de nombreuses lacunes en termes de connaissances, notamment en ce qui concerne les interactions microbiennes dans l’intestin ainsi que leur dynamique spatiale et temporelle. La seule analyse du microbiote fécal en tant que représentant de l’ensemble du microbiote intestinal est donc problématique, car elle n’illustre pas tous les aspects du microbiote intestinal.5
Pertinence pour la santé gastro-intestinale
Différents paramètres tels que l’alimentation, les antibiotiques et les maladies peuvent avoir une influence sur la composition et la fonction du microbiote. Ces modifications de la composition sont associées à de nombreuses maladies gastro-intestinales, dont les maladies inflammatoires chroniques de l’intestin (MICI), le syndrome du côlon irritable (SCI) et les infections à Clostridioides difficile (ICD).6 En conséquence, des tentatives ont eu lieu pour influencer le microbiote par le biais de la transplantation de microbiote fécal (TMF). Il s’agit d’introduire dans l’intestin d’un receveur/d’une receveuse des selles préparées d’un donneur/d’une donneuse sain·e et soigneusement dépisté·e, dans le but de restaurer ou de modifier le microbiote. L’administration se fait par coloscopie, gastroscopie, lavement ou sous forme de gélules.7
Transplantation de microbiote fécal
Colite uléreuse et maladie de Crohn
Les études randomisées contrôlées (ERC) menées jusqu’à présent sur la TMF dans la colite ulcéreuse (CU) étaient de relativement petite envergure et hétérogènes en terme de méthodologie, ce qui ne permet pas de tirer des conclusions définitives. Des preuves appuient le fait que la TMF peut être efficace pour l’induction d’une rémission en cas de CU légère à modérée. Il n’existe toutefois pas de preuves suffisantes pour recommander la TMF comme traitement de routine de la CU – d’autant plus qu’une rémission durable au-delà d’un an après le traitement par TMF n’a pas été démontrée, de sorte qu’une administration répétée semble nécessaire.8 Des études supplémentaires sont toutefois nécessaires à ce sujet. La situation est comparable pour la maladie de Crohn (MC), bien qu’il n’existe ici qu’une poignée d’études de petite envergure.9
En résumé, il manque actuellement des preuves pour recommander la TMF pour l’induction ou le maintien d’une rémission dans la CU ou la MC. L’indication de la TMF reste actuellement limitée aux ICD récidivantes ou réfractaires (y compris dans le cadre d’une MICI), en tenant compte du déclenchement d’une poussée de la maladie comme complication possible.10
Syndrome du côlon irritable
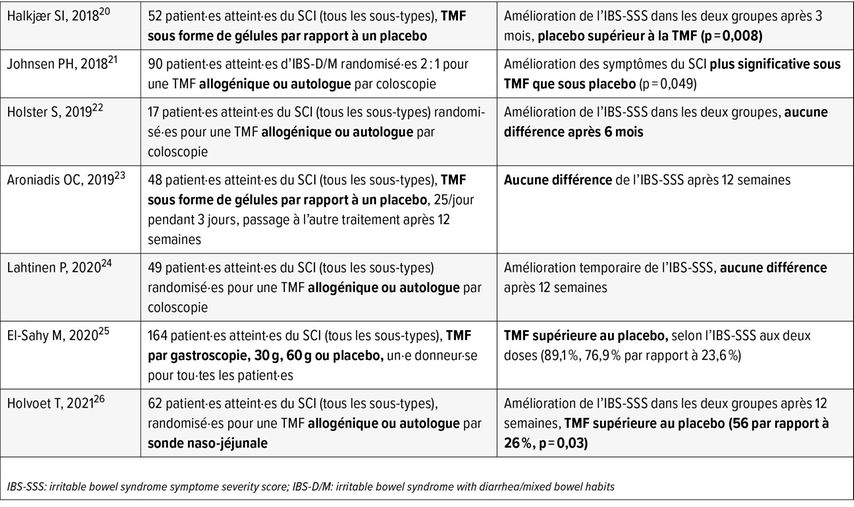
Les résultats des études sur la TMF en cas de syndrome du côlon irritable (SCI) sont très hétérogènes (Tab. 1). Actuellement, les méta-analyses ne fournissent aucune preuve claire d’un bénéfice.11
Tab.1: Aperçu des essais randomisés contrôlés sur la TMF dans le syndrome du côlon irritable (modifié selon Halkjær SI et al. 2023)11
On pense qu’elle pourrait présenter un bénéfice dans certains sous-groupes de patient·es atteint·es du SCI, mais des études supplémentaires sont nécessaires. Les résultats incohérents sont dus aux différents critères de sélection (différents sous-types de SCI, etc.), aux modes d’administration (par voie haute ou basse, gélules) et à la quantité transplantée. Chez certain·es patient·es atteint·es du SCI, on a constaté des modifications détectables du microbiote qui pourraient être pertinentes pour les symptômes, notamment en ce qui concerne l’axe intestin-cerveau.
Il convient en outre de tenir compte de l’effet placebo important dans les groupes de contrôle, notamment en ce qui concerne la transplantation de microbiote fécal autologue en tant que groupe de contrôle. Il n’est pas clair si ce type de traitement pourrait avoir plus qu’un simple effet placebo. En fin de compte, il manque toutefois un marqueur objectif de la réponse à la TMF.
Infections à Clostridioides difficile
15 à 20% des patient·es souffrant d’une infection à Clostridioides difficile (ICD) présentent une récidive, et 50% plusieurs récidives. Les ICD récidivantes réapparaissent typiquement 2 à 8 semaines après la fin du traitement, malgré un traitement adéquat (par la fidaxomicine ou la vancomycine). La TMF a désormais plus que fait ses preuves dans ces cas. Les méta-analyses font toutes état d’une excellente efficacité, indépendamment du mode d’administration.12 En conséquence, la TMF a également fait son entrée dans les directives. Dans les directives actuelles des sociétés américaines et britanniques de gastroentérologie, la TMF est citée comme une méthode valide et sûre dès la première récurrence d’une ICD.13,14
Deux agents thérapeutiques basés sur la TMF sont désormais autorisés aux États-Unis pour prévenir la récidive d’une ICD, mais ils ne sont pas destinés à traiter la maladie active. Il n’est pas encore possible de savoir dans quelle mesure ils seront également utilisés en Europe. Une question passionnante est de savoir si, à l’avenir, ces médicaments pourraient être utilisés en prophylaxie pour les patients à risque d’ICD. En outre, il existe un grand nombre de fabricants qui travaillent avec des communautés bactériennes dites définies, dans le but de les utiliser dans le cadre d’une ICD ou de la prophylaxie d’une ICD. L’avenir nous dira si des communautés définies ou des dons de selles préparés pour un usage professionnel/commercial traitent mieux les ICD.
Risques de la transplantation de microbiote fécal
Les risques liés à la TMF comprennent la transmission de maladies infectieuses et d’agents pathogènes, en particulier de différents germes résistants tels que les bactéries à Gram négatif multirésistantes (MRGN).15 C’est pourquoi un dépistage complet est effectué dans le cadre du traitement des dons ou du recrutement des donneur·ses afin d’exclure toute transmission potentielle d’agents pathogènes. En outre, une partie des dons est archivée afin de garantir la traçabilité en cas d’éventuelles complications à long terme.
Une étude récente a montré qu’un an après une TMF effectuée pour une ICD, les receveur·ses présentaient un risque accru de développer des symptômes du SCI. Cela s’appliquait toutefois uniquement en cas de différence entre le sexe du donneur/de la donneuse et celui du receveur/de la receveuse.16 L’avenir nous dira si cette observation se confirme dans des cohortes plus importantes.
Les risques mentionnés ci-dessus sont la raison pour laquelle le réseau européen de transplantation de microbiote fécal (EurFMT) a été créé. Outre l’établissement d’un registre européen, le réseau permet un contrôle de qualité mutuel. En mettant en place des procédures et des directives standardisées, le réseau s’assure que les pratiques de TMF des centres membres répondent aux normes de qualité et de sécurité les plus strictes. Cette approche harmonisée ne profite pas seulement aux patient·es, mais renforce également la crédibilité et l’intégrité de la recherche sur la TMF.
Transplantation de microbiote fécal et inhibiteurs de points de contrôle immunitaires
Ces dernières années, l’interaction entre le microbiote et le système immunitaire est devenue un sujet central de la recherche, notamment en ce qui concerne le rôle du microbiote dans le traitement par des inhibiteurs de points de contrôle immunitaires (ICI). La TMF a suscité un grand intérêt dans ce contexte, car des études ont montré que le microbiote peut avoir une influence considérable sur le succès des ICI. Ils agissent en bloquant des protéines spécifiques qui empêchent normalement le système immunitaire d’attaquer les cellules cancéreuses. Cependant, on a observé que tou·tes les patient·es ne réagissaient pas de la même manière à ce traitement, et le microbiote pourrait jouer un rôle crucial en ce sens. En conséquence, la TMF offre un point de départ pour modifier le microbiote en faveur d’une immunothérapie plus efficace.
Entre-temps, deux études menées sur des patient·es atteint·es de mélanome métastatique qui ne répondaient pas (ou plus) aux ICI traditionnels ont montré qu’il était possible de sensibiliser à nouveau le système immunitaire par transplantation d’un microbiote de patient·e ayant obtenu une bonne réponse au traitement. Une étude encore plus récente n’a pas eu recours à des donneur·ses ayant obtenu une bonne réponse, mais à des donneur·ses jeunes et en bonne santé. Comme dans les deux autres études, une réponse objective (CR/PR) a été obtenue chez jusqu’à 65% des patient·es n’ayant pas répondu (ou ne répondant plus) aux immunothérapies.17–19
L’Université de médecine de Vienne mène une étude prometteuse sur la TMF chez des patient·es atteint·es de carcinome hépatocellulaire (CHC) à l’Hôpital général (AKH) de Vienne. Les premières analyses montrent des résultats similaires à ceux des patient·es atteint·es de mélanome, ce qui suggère que la TMF pourrait être bénéfique non seulement pour le cancer de la peau, mais aussi pour d’autres cancers.
Perspectives
Bien que les résultats soient prometteurs jusqu’à présent, il reste encore de nombreux défis à relever pour que la TMF puisse être utilisée comme traitement adjuvant de routine à l’immunothérapie ou dans les autres indications mentionnées ci-dessus. L’un des principaux problèmes est d’identifier les bonnes combinaisons donneur·ses/receveur·ses afin de maximiser le succès de la transplantation. En outre, les effets à long terme de la TMF sur le système immunitaire et le microbiote doivent être étudiés de manière approfondie.
Un autre défi important est la standardisation de la TMF. Le microbiote étant très différent d’une personne à l’autre, il pourrait être nécessaire d’utiliser des communautés bactériennes bien définies plutôt que de recourir à des transplantations de microbiote fécal traditionnelles. La recherche sur le microbiote synthétique, dans lequel des microbes spécifiques sont utilisés de manière ciblée comme agents thérapeutiques, pourrait permettre de remédier à cette situation. La combinaison de la TMF et de l’immunothérapie a le potentiel d’améliorer considérablement le traitement des patient·es atteint·es de cancer, en particulier ceux·elles qui ne répondent plus aux traitements actuels.
À l’avenir, la TMF pourrait faire partie intégrante des approches thérapeutiques individuelles, dans lesquelles le microbiote des patient·es est modifié de manière ciblée afin de maximiser le succès du traitement. Cela pourrait non seulement augmenter l’efficacité du traitement, mais aussi réduire les effets secondaires en permettant au système immunitaire de lutter plus efficacement contre la tumeur.
Les recherches futures visent également à mieux comprendre les facteurs déterminants du succès d’une TMF. Il convient de prendre en compte non seulement la prise de greffe, c’est-à-dire l’augmentation du microbiote du donneur/de la donneuse, mais aussi le profil fonctionnel comme facteurs. Un autre objectif est de définir des critères de concordance et de procéder à des ajustements du régime alimentaire en parallèle.
Littérature:
1 Shkoporov AN, Hill C: Cell Host Microbe 2019; 25: 195-209 2 McCallum G, Tropini C: Nat Rev Microbiol 2024; 22: 105-18 3 Kalbermatter C et al.: Front Immunol 2021; 12: 683022 4 Shanahan F et al.: Gastroenterology 2021; 160: 483-94 5 Britton RA et al.: Gastroenterology 2024; 28: S0016-5085(24) 05000-5 6 Walker AW, Hoyles L: Nat Microbiol 2023; 8: 1392-96 7 Yadegar A et al.: Clin Microbiol 2024; 37: e0006022 8 Imdad A et al.: Cochrane Database Syst Rev 2023; 4: CD012774 9 Zhou S et al.: Int J Colorectal 2023; 38: 62 10 Lopetuso LR et al.: Gut 2023; 72: 1642-50 11 Halkjær SI et al.: World J Gastroenterol 2023; 29: 3185-202 12 Baunwall SMD et al.: EClinicalMedicine 2020; 29-30: 100642 13 Peery AF et al.: Gastroenterology 2024; 166: 409-34 14 Mullish BH et al.: Gut 2024; 73: 1052-75 15 DeFilipp Z et al.: Drug-resistant N Engl J Med 2029; 381: 2043-50 16 Sehgal K et al.: Gastroenterology 2024; 166: 704-706.e2 17 Baruch EN et al.: Science 2021; 371: 602-9 18 Routy B et al.: Nat Med 2023; 29: 2121-32 19 Davar D et al.: Science 2021; 371: 595-602 20 Halkjær SI et al.: Gut 2018; 67: 2107-15 21 Johnsen PH et al.: Lancet Gastroenterol Hepatol 2018; 3: 17-24 22 Holster S et al.: Clin Transl Gastroenterol 2019; 10: e00034 23 Aroniadis OC et al.: Lancet Gastroenterol Hepatol 2019; 4: 675-85 24 Lahtinen P et al.: Aliment Pharmacol Ther 2020; 51: 1321-31 25 El-Salhy M et al.: Gut 2020; 69: 859-67 26 Holvoet T et al.: Gastroenterology 2021; 160: 145-57.e8
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...