Mastocytose cutanée ou systémique: quel est le rôle de l’hématologie?
Auteur:
KD Dr méd. Axel Rüfer
Co-Chefarzt Hämatologie
Leiter Mastozytose-Exzellenzzentrum
Luzerner Kantonsspital
Universitäres Lehr- und Forschungsspital
E-mail: axel.ruefer@luks.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les mastocytoses constituent un groupe hétérogène de maladies influencées par un grand nombre de mutations génétiques sous-jacentes et de comorbidités, dont le tableau clinique est marqué par ces dernières. Le diagnostic hématologique vise à identifier le sous-type de mastocytose afin de pouvoir mettre en place un traitement personnalisé. Les mastocytoses ne sont pas des maladies allergiques, bien que les allergènes, ainsi que de nombreux autres agents, puissent entraîner la libération de médiateurs par les mastocytes. Dans le cas de la mastocytose systémique, cela peut aller jusqu’à un choc anaphylactique pouvant engager le pronostic vital, qui doit donc être évité grâce au diagnostic et au traitement.
Keypoints
-
Le diagnostic et le traitement des mastocytoses sont un parfait exemple d’interdisciplinarité: outre le cabinet du·de la médecin de premier recours, où la maladie doit être envisagée, il est également nécessaire d’inclure la dermatologie, l’allergologie, la pathologie et l’hématologie.
-
Envisager une mastocytose conduit, outre une anamnèse et un examen clinique approfondis, à la première analyse diagnostique: le dosage du taux sérique de la tryptase. Il peut déjà être réalisé dans le cabinet du·de la médecin de premier recours.
-
La mastocytose cutanée doit être distinguée de la mastocytose systémique, car le pronostic et les options thérapeutiques sont différents. Cette distinction n’est pas possible sans un examen de la moelle osseuse.
-
Des progrès importants ont été réalisés ces dernières années concernant les mastocytes, tant sur le plan diagnostique (détection de mutations activatrices de KIT et d’une expression aberrante de CD2, CD25 et/ou CD30 sur les mastocytes néoplasiques) que sur le plan thérapeutique (utilisation d’inhibiteurs de KIT).
-
Le diagnostic différentiel est large et comprend notamment le syndrome d’alpha-tryptasémie héréditaire, de loin la cause la plus fréquente d’augmentation du taux sérique basal de la tryptase, le syndrome d’activation mastocytaire et l’intolérance à l’histamine. Comme le pronostic et les options thérapeutiques sont également différents, une classification diagnostique est importante.
Le 27 mars 2025, l’atelier «Diagnostik und Therapie von Mastzellerkrankungen» (Diagnostic et traitement des mastocytoses) a été organisé par l’Hôpital cantonal de Lucerne.
L’interdisciplinarité nécessaire dans ce domaine s’est reflétée dans les trois exposés suivants: la Dre méd. Anna Kirsch du Centre de dermatologie et d’allergologie de l’Hôpital cantonal de Lucerne a mis en lumière les problématiques relevant de la dermatologie dans son exposé, le PD Dr méd. Oliver Fuchs, travaillant dans le même centre, a abordé le sujet des tests allergologiques, y compris l’importance du taux sérique basal de la tryptase et en cas de dégranulation mastocytaire, et le KD Drméd. Axel Rüfer a expliqué la différence entre mastocytose cutanée et systémique, ainsi que le rôle de l’hématologie dans ce contexte, y compris les diagnostics différentiels cliniquement pertinents.
L’Hôpital cantonal de Lucerne constitue un centre d’excellence de l’European Competence Network on Mastocytosis (ECNM). Le présent article traite exclusivement de l’hématologie de la mastocytose et de ses diagnostics différentiels dans la pratique clinique quotidienne.
Mastocytose cutanée ou systémique?
Alors que la mastocytose cutanée (MC) touche principalement les enfants, la mastocytose systémique (MS) concerne généralement les adultes. Ces derniers peuvent également présenter des lésions cutanées typiques avec infiltrats mastocytaires et un examen de la moelle osseuse est indispensable pour déterminer le stade.
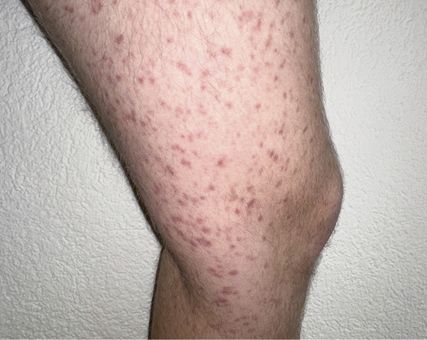
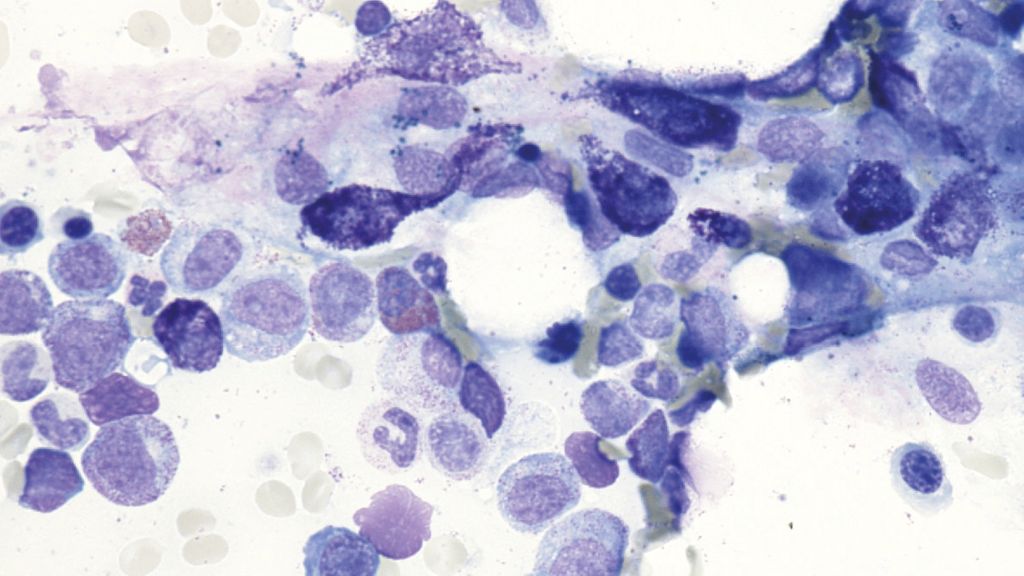
Fig.1: Mastocytose cutanée ou systémique en cas de lésions cutanées typiques avec infiltrats mastocytaires? Avec l’aimable autorisation.
La distinction entre MC et MS est importante pour le pronostic, car la survie sans progression est plus longue en cas de MC par rapport à la MS. La Figure1 montre des lésions cutanées typiques avec infiltrats mastocytaires. Le frottement mécanique d’une telle lésion provoque généralement une éruption cutanée (signe de Darier positif) chez les patient·es qui ne prennent aucun antihistaminique (Fig.1).
La MS se caractérise par une prolifération pathologique de mastocytes néoplasiques dans la moelle osseuse et dans d’autres organes, en particulier la rate, le foie et les ganglions lymphatiques. Les mastocytes expriment le récepteur de la tyrosine kinase KIT (CD117) et une mutation activatrice de KIT est détectable chez >90% des patient·es atteint·es de MS, laquelle entraîne une activation du récepteur KIT avec expansion clonale et accumulation de mastocytes dans les organes susmentionnés.1
Quand envisager la mastocytose? Quels sont les symptômes et les signes?
Les signes cliniques d’une mastocytose peuvent être multiples, ne sont pas spécifiques et dépendent du stade de la MS (non avancée ou avancée).
Outre les symptômes constitutionnels (fatigue, perte de poids, fièvre) et les manifestations cutanées (urticaire, angio-œdème, dermographisme, prurit, bouffées de chaleur), on observe principalement des symptômes systémiques associés aux médiateurs dans la MS non avancée (gastro-intestinaux: nausées, vomissements et intolérances alimentaires; respiratoires: dyspnées et stridors; cardiovasculaires: hypotension, tachycardie, syncopes, vertiges), et les symptômes musculo-squelettiques (douleurs osseuses, arthralgies, myalgies) sont fréquents. La présentation clinique classique est une réaction anaphylactique de haut grade (classification de Müller, grade3: insuffisance respiratoire, ou grade4: choc anaphylactique) après une piqûre d’hyménoptère (abeille, guêpe ou frelon) en cas d’allergie au venin.
Le phénotype de la MS avancée se caractérise par une augmentation de la taille et une limitation fonctionnelle des organes due à l’infiltrat mastocytaire, la moelle osseuse, la rate, le foie, le tractus gastro-intestinal, les ganglions lymphatiques et/ou les os pouvant être touchés.
Comme souvent, il est donc important d’envisager une mastocytose afin de préparer la suite du diagnostic et du traitement, généralement en contactant d’abord le·la médecin de premier recours.2 Il faut également penser à une mastocytose (dans la moelle osseuse) («bone marrow mastocytosis»; BMM) en cas de réactions anaphylactiques sans atteinte cutanée.
Critères diagnostiques de la mastocytose systémique
Dans le cabinet du·de la médecin de premier recours, une telle présentation clinique doit donner lieu à un dosage du taux sérique de la tryptase, qui présente une spécificité très élevée. Il est important de documenter le moment qui suit un tel événement. On observe un pic du taux sérique de la tryptase 30 à 120 minutes après la survenue des symptômes. Le taux sérique basal de la tryptase (BST) doit être mesuré plus de 24 heures après la disparition des symptômes ou pendant l’intervalle sans symptôme.
Si le BST est élevé, la cause la plus fréquente est un syndrome d’alpha-tryptasémie héréditaire, suivie d’une maladie rénale chronique avancée/insuffisance rénale chronique terminale et d’une mastocytose.3 Étant donné que les mastocytes non stimulés libèrent une quantité minimale de (pro)tryptase, le BST est l’expression du nombre total de mastocytes.
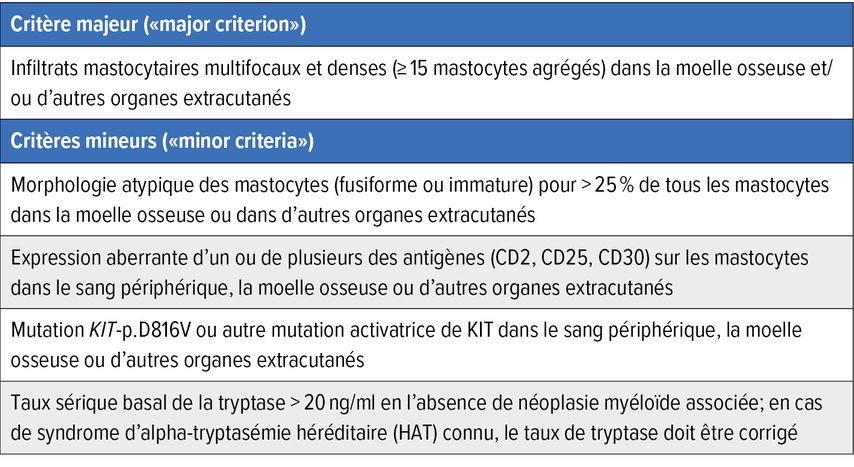
Conformément à la classification 2022 de l’OMS, il existe un critère majeur et quatre critères mineurs pour le diagnostic de la MS,4 qui sont présentés dans le Tableau1. Comme l’expression de CD30 par les mastocytes est associée à la MS, elle a été ajoutée au critère mineur correspondant. En outre, la présence d’une autre mutation activatrice de KIT (pas exclusivement la mutation KIT-p.D816V) a été reconnue comme critère mineur. Le diagnostic de la MS peut être posé si le critère majeur et au moins un critère mineur ou au moins trois critères mineurs sont remplis.
Une analyse rétrospective du registre de l’ECNM a montré que l’expression aberrante des mastocytes a également une valeur pronostique et qu’une absence d’expression de CD2 est associée à une réduction significative de la survie globale ainsi qu’à une augmentation significative de l’atteinte extramédullaire.5
Il convient de noter qu’un BST normal ou une légère augmentation du BST <20ng/ml n’exclut pas une mastocytose et que le taux sérique de la tryptase peut parfois n’être que légèrement élevé en cas de réaction anaphylactique sévère.
Suspicion de mastocytose systémique: diagnostic hématologique
Si l’anamnèse, les symptômes cliniques, l’examen physique et le dosage du BST laissent suspecter une mastocytose, un diagnostic hématologique est indiqué. Il comprend tout d’abord une différenciation de l’hémogramme (morphologie des monocytes et des éosinophiles, dysplasies) et le dosage des paramètres biochimiques (taux sérique de la tryptase, transaminases, PAL, LDH, bilirubine, créatinine, albumine, ferritine, vitamine B12, folates érythrocytaires, calcium, vitamine D, CRP, électrophorèse des protéines sériques avec immunofixation, coagulation plasmatique).
La mise en évidence d’une mutation KIT-p.D816V par CPR «droplet digital» ultrasensible à partir du sang périphérique permet de confirmer la suspicion de mastocytose et justifie davantage la nécessité d’un examen de la moelle osseuse par une probabilité pré-test accrue.
Cette mutation est présente chez environ 95% des adultes atteint·es de MS non avancée. Il convient de noter que tant les BMM que les MS indolentes (IMS) peuvent être négatives dans le sang périphérique et positives dans la moelle osseuse en cas de charge mastocytaire faible. D’autres mutations activatrice de KIT et donc pathogènes (p.ex. D816Y, D816H, D816F, D815K, F522C, V560G, D820G) peuvent être présentes, notamment en cas de MS avancée. Des mutations récurrentes supplémentaires à la mutation KIT-p.D816V peuvent alors être détectées. Les gènes les plus fréquemment concernés sont SRSF2, ASXL1 et RUNX1 (panel S/A/R), lesquels sont importants pour la stratification du risque dans le score MARS.6
Un examen de la moelle osseuse permet d’obtenir un prélèvement par ponction pour la cytologie, l’immunophénotypage (FACS) et les analyses génétiques, ainsi qu’un par biopsie pour l’histologie, l’immunohistochimie et les analyses génétiques. Il n’est pas nécessaire de recourir à un traitement préalable pour prévenir la dégranulation mastocytaire pour cet examen.
La cytologie permet d’évaluer la cellularité et les éventuelles dysplasies. En outre, il est important de quantifier les mastocytes, car un nombre ≥20% en dehors des fragments est considéré comme un critère de leucémie à mastocytes (MCL). En outre, un FACS est effectué sur le prélèvement de ponction de la moelle osseuse. Les analyses génétiques comprennent la détermination par génétique moléculaire de la mutation KIT-p.D816V avec charge mutationnelle («variant allele frequency», VAF) et par cytogénétique conventionnelle. Il n’existe toutefois aucune aberration spécifique à la MS, d’autant plus que celle-ci est rare pour la BMM et l’IMS.
Outre la quantification des mastocytes, la biopsie sert principalement à évaluer la présence d’infiltrats mastocytaires multifocaux et denses comme critère diagnostique majeur. Au-delà de la coloration, l’immunohistochimie est importante pour déterminer les mastocytes (tryptase, CD117, CD2, CD25, CD30) et mettre en évidence une éventuelle néoplasie hématologique associée (CD14, CD34, CD61).
Mastocytose systémique: quelsous-type?
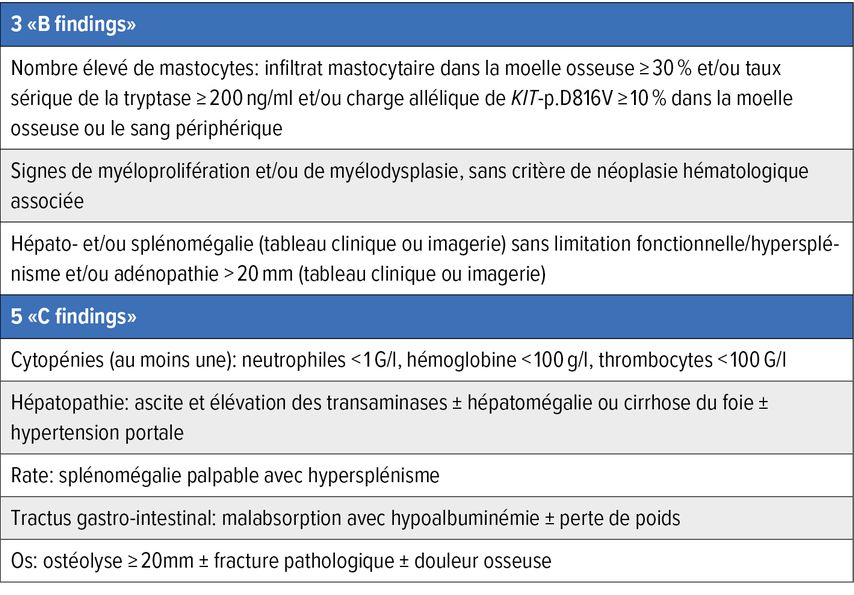
Si le diagnostic hématologique permet de poser le diagnostic de MS, il s’agit ensuite de déterminer le sous-type. Cela n’a pas seulement des conséquences pronostiques, mais aussi thérapeutiques. Pour déterminer le sous-type, il est important de vérifier la présence de «B findings» («burden of disease») ou de «C findings» («cytoreduction required»). Les «C findings» sont en fin de compte des limitations fonctionnelles des organes concernés dues à l’infiltrat mastocytaire. Les «B findings» et les «C findings» sont résumés dans le Tableau 2.
Pour compléter les examens diagnostiques, il faut procéder à une échographie abdominale en recherchant une hépato- et/ou splénomégalie, une adénopathie, une ascite et une hypertension portale.
En outre, ces patient·es doivent subir une ostéodensitométrie, non prise en charge, afin de déterminer s’ils·elles souffrent d’ostéopénie ou d’ostéoporose. Cela est important pour le diagnostic et le traitement. Le taux sérique de la tryptase, combiné avec d’autres cytokines des mastocytes, induit la formation de RANKL («receptor activator of NF-κB ligand») dans les ostéocytes et les ostéoblastes, et stimule ainsi les ostéoclastes, la colonne vertébrale étant particulièrement concernée. En cas de suspicion d’ostéolyse, une imagerie par résonance magnétique doit être réalisée.
En cas de symptômes gastro-intestinaux, une œsophagogastroduodénoscopie et une coloscopie doivent être effectuées. Dans ce cas, une biopsie avec marquage immunohistochimique par le CD117 doit toujours être effectuée, car les mastocytes expriment toujours le CD117, alors que la tryptase peut ne pas être exprimée. Le service de pathologie doit être informé en cas de suspicion d’infiltrat mastocytaire gastro-intestinal afin de réaliser l’immunohistochimie appropriée sur les biopsies et d’éviter le diagnostic erroné de colite éosinophile.
En tenant compte de tous ces paramètres, il est maintenant possible de déterminer le sous-type de MS. Les MS non avancées comprennent la BMM, l’IMS et la MS de type «smouldering» (SMS). Dans la BMM, on n’observe ni lésion cutanée, ni «B finding» ni infiltrat de MS extramédullaires denses, et le BST est <125ng/ml. On parle d’IMS en présence de lésions cutanées typiques et d’un «B finding» au maximum. L’ISM peut aussi se manifester par des lésions cutanées, mais le BST est alors ≥125ng/ml et/ou des infiltrats de MS extramédullaires denses sont présents. Dans le cas de la SMS, on observe au moins deux «B findings», mais aucun «C finding».
Les MS avancées (AdvMS) sont la MS agressive (AMS), la SM avec néoplasie hématologique associée (MS-AHN) et la MCL. Dans le cas de l’AMS, au moins un «C finding» est présent, mais il n’y a souvent aucune lésion cutanée. Dans le cas de la MS-AHN, une néoplasie hématologique définie par l’OMS doit être présente en plus de la MS, les deux maladies étant classées selon la définition de l’OMS. On observe ≥20% de mastocytes dans le frottis médullaire dans la LMC, ≥10% de mastocytes dans le sang périphérique dans la forme leucémique et <10% dans la forme aleucémique. En cas de MCL aiguë, un ou plusieurs «C findings» sont présents, alors qu’on ne constate aucun «C finding» dans le cas d’une MCL chronique, dont le pronostic est nettement meilleur.
Traitement de la mastocytose systémique
Les options thérapeutiques en cas de MS sont résumées dans la Figure 2. Le statut d’autorisation, la disponibilité et la prise en charge des coûts ne sont pas pris en compte dans cette représentation et doivent être clarifiés avant le traitement.
L’évolution clinique de la MS non avancée étant très variable d’un individu à l’autre, il en va de même pour le traitement. Celui-ci commence toujours par l’évitement des agents potentiellement déclencheurs, la tenue d’un journal étant recommandée pour faciliter l’identification. En règle générale, on administre un traitement prophylactique anti-médiateur, avec la prise d’antihistaminiques H1 (p.ex. desloratadine, cétirizine, fexofénadine et autres) et, le soir, d’antihistaminiques H2 (p.ex. famotidine 2–3x 40mg/j ou cimétidine 2–3x 400mg/j) en cas de troubles gastro-intestinaux. S’ils ne sont pas contrôlés de manière satisfaisante par un antihistaminique H2, il est possible d’utiliser en plus, en différé, un inhibiteur de la pompe à protons. Le traitement peut être intensifié par l’utilisation d’un stabilisateur des mastocytes (p.ex. acide cromoglicique) ou de corticoïdes (p.ex. budésonide).
En cas d’allergie au venin d’hyménoptère, une immunothérapie spécifique doit être administrée en traitement continu à vie. En présence de symptômes modérés à sévères, pour lesquels ce traitement symptomatique ne permet pas un contrôle suffisant, le traitement de l’IMS peut utiliser l’avapritinib, un inhibiteur spécifique de KIT, à raison de 25mg par jour.7
Le traitement de la MS avancée diffère de celui de la MS non avancée. Pour le traitement de première intention de la MS avancée, on utilise l’inhibiteur multikinase/KIT midostaurine à une dose de 2x 100mg (capsules à 25mg) par jour, les nausées constituant un trouble fréquent, de sorte qu’une prophylaxie régulière doit être mise en place, par exemple par l’ondansétron à 4–8mg/j. L’avapritinib est autorisé en monothérapie à la dose de 200mg par jour après au moins un traitement systémique préalable, les thrombocytes devant être >50G/l.8,9
Une polychimiothérapie intensive associée à la midostaurine, suivie d’une allogreffe de cellules souches hématopoïétiques (HSCT), est nécessaire en cas de MSA à progression rapide, de MS-AML et de LMC. Un traitement post-greffe par un inhibiteur de KIT doit alors être envisagé.
L’hydroxyurée peut être utilisée dans le cadre de soins palliatifs, notamment en cas de leucostase symptomatique ou de splénomégalie. L’interféron alfa et la cladribine ont été relégués au second plan depuis la disponibilité de la midostaurine et de l’avapritinib.
Tant l’ostéopénie que l’ostéoporose doivent être traitées de manière adéquate et d’autres causes secondaires doivent être exclues, par exemple une carence en vitamine D3, une hyperthyroïdie, une hyperparathyroïdie ou un hypogonadisme. Il faut en outre assurer une prise quotidienne de 1000–1200mg de calcium et de 800–1200 unités de vitamine D. Un traitement par des bisphosphonates, après contrôle dentaire, doit être instauré dès que le score T tombe en dessous de –2 afin de stopper précocement une ostéoporose qui s’aggrave rapidement. Si la stabilisation de l’ostéoporose n’est pas possible, l’utilisation du dénosumab, un inhibiteur de RANKL, doit être discutée. Toutefois, un tel traitement doit être suivi d’un bisphosphonate afin d’éviter un rebond du remodelage osseux. Contrairement aux bisphosphonates, le tériparatide a une action anabolique sur les os et est jusqu’à présent le produit le plus efficace, notamment en cas d’ostéoporose sévère et manifeste ou de fractures survenues malgré un traitement par des bisphosphonates.
Pour le traitement d’urgence d’une réaction anaphylactique de haut grade (grade3 ou 4 selon la classification de Müller), tous·tes les patient·es atteint·es de MS doivent être équipé·es d’une trousse d’urgence contenant deux comprimés d’antihistaminiques H1 (p.ex. lévocétirizine, 5mg) et de prednisolone (p.ex. Spiricort, 50mg). Il est en outre important d’équiper ces patient·es de deux auto-injecteurs à 0,3mg d’adrénaline, qui doivent être utilisés de manière autonome par voie intramusculaire en cas d’urgence.
Tous·tes les patient·es atteint·es de mastocytose doivent, si possible, être traité·es dans le cadre d’études. L’inclusion dans un registre international de la mastocytose (p.ex. registre de l’ECNM), qui constitue la base de l’analyse des données, doit également avoir lieu.
Diagnostics différentiels cliniquement pertinents
Syndrome d’alpha-tryptasémie héréditaire
En cas de symptômes évoquant une libération de médiateurs par les mastocytes, il faut envisager le syndrome d’alpha-tryptasémie héréditaire (HAT) en cas de taux sérique élevé de la tryptase. C’est également le cas des symptômes gastro-intestinaux avec réveils nocturnes ou des inflammations intestinales qui ne répondent pas au traitement. L’HAT est la cause la plus fréquente d’une augmentation du BST.10 Sa prévalence atteint 4 à 6% dans la population occidentale et est un trait héréditaire autosomique dominant causé par l’augmentation du nombre de copies du gène TPSAB1 codant l’alpha-tryptase.
Si le BST est ≥8ng/ml, l’HAT doit être recherché chez ces patient·es symptomatiques. L’HAT est plus fréquent chez les patient·es atteint·es de MS. Le traitement de l’HAT est similaire à celui de la MS, et le traitement de référence comprend des antihistaminiques. Des antihistaminiques H2, des antagonistes des récepteurs des leucotriènes et de l’acide cromoglicique peuvent également être utilisés à court terme pour contrôler les symptômes. Il existe des rapports de cas isolés de traitement efficace de l’urticaire par l’omalizumab. Dans les situations d’urgence, les antihistaminiques et les corticoïdes sont généralement suffisants.11
Syndrome d’activation mastocytaire
Les symptômes d’activation mastocytaire (MCA) sont variés: urticaire, angio-œdème, prurit, bouffées de chaleur, congestion nasale, respiration sifflante («wheezing»), gonflement du larynx, céphalées, hypotension ou diarrhée. Chez les patient·es présentant des symptômes systémiques sévères de MCA, affectant plus d’un système d’organes et se répétant, généralement sous la forme d’une réaction anaphylactique sévère, il convient de penser à un syndrome d’activation mastocytaire (MCAS). Ceci est considéré comme un critère diagnostique.
Un BST normal n’exclut pas un MCAS. Il faut documenter une augmentation du taux sérique de la tryptase d’au moins 20%+2ng/ml au-dessus du BST dans les quatre heures suivant la survenue des symptômes cliniques pour pouvoir conclure à une MCA (p.ex. BST de 10ng/ml→le taux sérique de la tryptase «pendant la crise» doit être >14ng/ml pour être considéré comme un critère de MCA). Cette augmentation du taux sérique de la tryptase constitue un critère diagnostique supplémentaire. On doit également observer une réponse thérapeutique, l’intervention thérapeutique devant être personnalisée et dépendre de l’étiologie sous-jacente (réduction du nombre de mastocytes, stabilisation des mastocytes, traitement anti-médiateur, traitement anti-allergique, immunothérapie, omalizumab, corticoïdes, anti-infectieux, traitement symptomatique). La réponse au traitement constitue un autre critère diagnostique. Pour poser le diagnostic de MCAS, les trois critères diagnostiques doivent être remplis.12
Il existe trois variantes du MCAS qui sont déterminantes pour l’intervention thérapeutique:
-
le MCAS primaire (clonal=monoclonal), dans lequel des mastocytes clonaux peuvent être détectés, soit dans le cadre du diagnostic de mastocytose (CM ou MS), soit en présence de seulement deux critères mineurs pour le diagnostic de MS,
-
le MCAS secondaire (réactif), qui peut être causé par une allergie médiée par les IgE, une autre réaction d’hypersensibilité ou une autre maladie immunitaire, et le MCAS idiopathique, dans lequel on n’observe aucune maladie réactive associée, aucune allergie médiée par les IgE, aucun HAT ou aucun mastocyte clonal.
Le HAT et le MCAS peuvent également survenir conjointement; cela vaut également pour le MCAS primaire et secondaire. Il convient de noter qu’un MCAS peut être l’expression d’une autre mastocytose ou d’une maladie médiée par les IgE.
Intolérance à l’histamine
Selon la Classification internationale des maladies, l’intolérance à l’histamine n’est pas un diagnostic officiel. Certain·es patient·es peuvent réagir à l’absorption supplémentaire d’histamine par une variété de symptômes non spécifiques semblables à ceux d’une intolérance alimentaire, tels que douleurs abdominale, diarrhée, nausée, vomissements, hypotension, tachycardie, vertiges, éternuements, congestion nasale, papules, prurit ou bouffées de chaleur. Parmi les aliments particulièrement riches en histamine, on retrouve certains fromages (longuement affinés), la charcuterie (salami, jambon cru), les poissons (en conserve, thon, maquereau), l’alcool (vin rouge, champagne), mais aussi les tomates, le raisin, les fraises ou les noix. Il est possible qu’il existe un déséquilibre entre l’absorption et la dégradation de l’histamine. La tenue d’un journal des symptômes et de l’alimentation est utile pour les patient·es avec suspicion d’intolérance à l’histamine.
Il n’existe aucune analyse de laboratoire unique permettant de poser un diagnostic. La détermination de l’activité de la diamine oxydase (DAO) dans le sérum n’a aucune valeur diagnostique, car elle ne permet pas de tirer des conclusions sur l’activité enzymatique dans l’intestin grêle. De plus, il est possible que la dégradation de l’histamine dans l’intestin se fasse également par l’intermédiaire de l’histamine N-méthyltransférase. La détermination de la concentration d’histamine plasmatique ou le dosage de l’histamine fécale sont controversés quant à leur valeur diagnostique, d’autant plus que certaines bactéries intestinales transforment l’histamine en métabolites.
Le diagnostic différentiel doit exclure aussi bien une mastocytose qu’une allergie médiée par les IgE.
Pendant la première étape du changement d’alimentation, soit la phase d’exclusion, une consultation en nutrition est recommandée et il convient d’adopter un régime alimentaire pauvre en histamine pendant 2 à 4 semaines. Si cette phase d’exclusion entraîne une amélioration des symptômes, une intolérance à l’histamine est très probable. Lors de la deuxième étape, la phase de test, l’objectif est d’élargir le choix des aliments en réintroduisant de manière ciblée les aliments suspectés, tout en tenant compte des facteurs individuels. Le changement d’alimentation en trois étapes culmine dans la troisième phase; l’alimentation permanente vise à fournir des recommandations nutritionnelles individuelles à long terme, axées sur les symptômes, afin de couvrir les besoins en nutriments et de prévenir toute carence tout en maintenant une qualité de vie élevée.
Outre l’évitement des facteurs déclenchants des symptômes, on utilise également des antihistaminiques ou des compléments alimentaires à base de DAO, qui entraînent une dégradation accélérée de l’histamine et doivent être pris avant le repas. Toutefois, l’efficacité d’une supplémentation en DAO n’a pas encore été scientifiquement prouvée.
Si la consultation en nutrition et l’adoption d’un régime alimentaire pauvre en histamine n’entraînent aucune amélioration des symptômes, il est recommandé de procéder à un diagnostic gastro-entérologique (diagnostics différentiels: syndrome du côlon irritable, maladies inflammatoires chroniques de l’intestin, maladie cœliaque, ulcère gastrique/duodénal).13,14
Une perturbation de la barrière muqueuse intestinale, par exemple par des inflammations, peut notamment entraîner une libération accrue d’histamine. Il existe des rapports de cas isolés d’utilisation efficace de vitamines A et D, de zinc, d’acides gras à chaîne courte, de méthionine, de glutamine et de probiotiques dans un tel cas, mais il manque des essais randomisés contrôlés.
De nombreux symptômes cliniques sont communs à la CM et la MS, au HAT, au MCAS et à l’intolérance à l’histamine. Le stress émotionnel peut entraîner une dégranulation mastocytaire et soit déclencher, soit au moins aggraver les symptômes de la mastocytose, du HAT, du MCAS et de l’intolérance à l’histamine. Outre les options thérapeutiques décrites ci-dessus, il est donc indispensable de proposer et d’organiser un suivi psychologique.
Littérature:
1 Valent P et al.: Updated diagnostic criteria and classification of mast cell disorders: a consensus proposal. Hemasphere 2021; 5(11): e646 2 Theoharides TC et al.: Mast cells, mastocytosis, and related disorders. N Engl J Med 2015; 373(2): 163-72 3 Waters AM et al.: Elevated basal serum-tryptase: disease distribution and variability in a regional health system. J Allergy Clin Immunol Pract 2022; 10(9): 2424-35 4 The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: myeloid and histiocytic/dendritic neoplasms. Leukemia 2022; 36(7): 1703-19 5 Rüfer A et al.: Prognostic impact of expression of CD2, CD25, and/or CD30 in/on mast cells in systemic mastocytosis: a registry study of the European Competence Network on Mastocytosis. Leukemia 2025; 39(3): 675-83 6 Jawhar M et al.: MARS: Mutation-adjusted risk score for advanced systemic mastocytosis. JClin Oncol 2019; 37(31): 2846-56 7 Gotlib J et al.: Avapritinib versus placebo in indolent systemic mastocytosis. N Engl J med Evid 2023; 2(6): EVIDoa2200339 8 DeAngelo DJ et al.: Safety and efficacy of avapritinib in advanced systemic mastocytosis: the phase 1 EXPLORER trial. Nat Med 2021; 27: 2183-91 9 Gotlib J et al.: Efficacy and safety of avapritinib in advanced systemic mastocytosis: interim analysis of the phase 2 PATHFINDER trial. Nat Med 2021; 27(12): 2192-9 10 Lyons JJ et al.: Incorporating tryptase genotyping into the workup and diagnosis of mast cell diseases and reactions. J Allergy Clin Immunol Pract 2022; 10(8): 1964-73 11 Rüfer A et al.: Hereditary alpha-tryptasemia – a potential cause of severe anaphylactic reactions and a modifier of mast cell diseases. Swiss Med Wkly 2025; 155: 3679-84 12 Valent P et al.: Mast cell activation syndromes: Collegium Internationale Allergologicum update 2022. Int Arch Allergy Immunol 2022; 183(7): 693-705 13 Hrubisko M et al.: Histamine intolerance – the more we know the less we know. A review. Nutrients 2021; 13(7): 2228 14 Reese I et al.: Guideline on management of suspected adverse reactions to ingested histamine: Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Society for Pediatric Allergology and Environmental Medicine (GPA), the Medical Association for German Allergologists (AeDA) as well as the Swiss Society for Allergology and Immunology (SGAI) and the Austrian Society for Allergology and Immunology (ÖGAI). Allergol Select 2021; 5: 305-14
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...