Les fibroblastes sénescents dans la peau vieillissante
Auteure:
Dre Sadaf Sanii, MD, PhD
Centre hospitalier universitaire vaudois (CHUV) Lausanne
E-Mail: sadaf.sanii@chuv.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La recherche de stratégies efficaces pour contrer le vieillissement cutané connaît un essor sans précédent. Sur le plan esthétique, les patient.es aspirent à une peau plus ferme, plus homogène et plus lumineuse. Sur le plan fondamental, les travaux se concentrent sur les mécanismes de la longévité cellulaire et de la régénération tissulaire.
Keypoints
-
Les fibroblastes sénescents constituent un acteur central du vieillissement cutané. Leur accumulation altère la matrice extracellulaire, entretient un état inflamma- toire chronique (inflamm-aging) et contribue directement aux signes cliniques du vieillissement (rides, relâchement, dyschromies).
-
Les approches anti-âge actuelles restent essentiellement symptomatiques. Bien qu’elles améliorent la texture et la luminosité cutanée, elles n’agissent pas sur la cause cellulaire profonde du vieillissement: la persistance des cellules sénescentes et leur phénotype sécrétoire délétère (SASP).
-
Les sénothérapeutiques représentent un changement de paradigme. En ciblant directement les cellules sénescentes (sénolytiques) ou en modulant leur activité sécrétoire (sénomorphi-ques), ces stratégies visent à restaurer un microenvi-ronnement dermique sain et fonctionnel.
-
Des perspectives prometteuses mais encore des défis à relever. La standardisation des biomarqueurs, la définition des doses optimales, la sécurité à long terme et la compréhension du rôle ambivalent de la sénescence demeurent des enjeux essentiels avant une intégration clinique à grande échelle.
Au centre de ces processus se trouvent les fibroblastes dermiques, véritables architectes du derme, responsables de la synthèse du collagène, de l’élastine et des glycosaminoglycanes (GAG), assurant ainsi la cohésion, la souplesse et la résilience de la peau. Avec l’avancée en âge, une proportion croissante de ces cellules entre dans un état de sénescence: elles perdent leur capacité proliférative, adoptent un phénotype sécrétoire pro-inflammatoire et participent activement à la dégradation progressive de la matrice extracellulaire, contribuant ainsi aux manifestations cliniques du vieillissement cutané.
Fibroblaste sénescent: un acteur central du vieillissement cutané
Il convient de distinguer le vieillissement cellulaire, processus lent et universel lié au passage du temps, de la sénescence cellulaire, qui correspond à une réponse aiguë et adaptative à divers stress ou dommages, tels que les cassures de l’ADN, le stress oxydatif, la dysfonction mitochondriale ou encore le raccourcissement des télomères.
Lorsqu’il devient sénescent, le fibroblaste dermique entre dans un état d’arrêt irréversible du cycle cellulaire, principalement médié par l’activation des voies p16INK4a/Rbet p21CIP1/WAF1/p53. Ces régulateurs inhibent la progression du cycle cellulaire et stabilisent le phénotype sénescent.
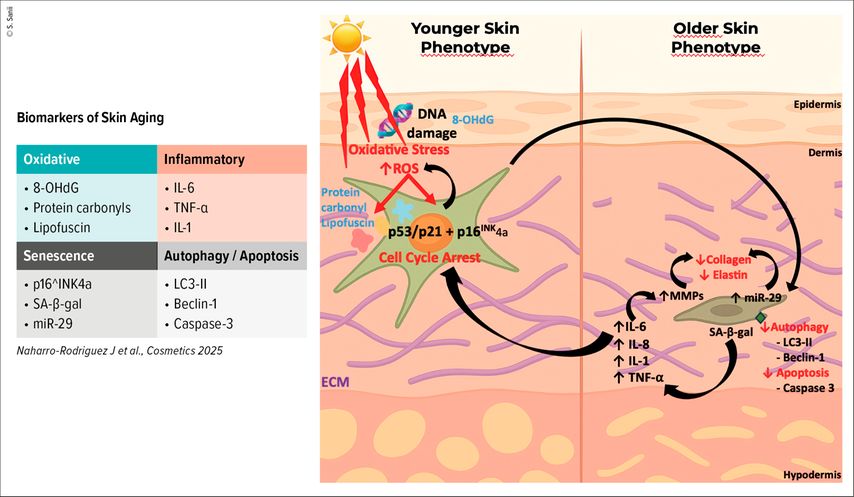
La cellule acquiert parallèlement un phénotype sécrétoire associé à la sénescence (SASP, Senescence-Associated Secretory Phenotype), caractérisé par la sécrétion accrue de cytokines pro-inflammatoires, de métalloprotéinases matricielles (MMP) et de facteurs de croissance, qui modifient profondément le microenvironnement dermique (Fig.1).
Fig. 1: Le phénotype sécrétoire associé à la sénescence (SASP) dans le vieillissement cutané. Le stress oxydatif induit par les UV et les ROS provoque des dommages à l’ADN (8-OHdG, protéines carbonylées, lipofuscine) et active les voies p53/p21 et p16INK4a, entraînant l’arrêt du cycle cellulaire des fibroblastes. Ces cellules sénescentes acquièrent un SASP caractérisé par la sécrétion accrue de cytokines pro-inflammatoires (IL-6, IL-1, TNF-α) et de métalloprotéinases matricielles (MMP), responsables de la dégradation du collagène et de l’élastine. Parallèlement, une diminution de miR-29 et une altération des voies d’autophagie/apoptose (LC3-II, Beclin-1, Caspase-3) contribuent à la persistance des cellules sénescentes et à la déstructuration du derme, marquant la transition d’un phénotype cutané jeune vers un phénotype vieilli (adapté de Naharro-Rodriguez J et al.2025)10
Enfin, les fibroblastes sénescents présentent une résistance à l’apoptose, liée notamment à la surexpression de protéines anti-apoptotiques telles que BCL-2, BCL-xL ou survivine, favorisant ainsi leur accumulation progressive dans le tissu cutané et le maintien d’un état inflammatoire chronique.
Ce profil sécrétoire altère profondément le microenvironnement dermique: il réduit la prolifération cellulaire et la synthèse des constituants de la matrice extracellulaire (ECM), augmente l’expression des MMP responsables de la dégradation du collagène et de l’élastine, entretient un état d’inflammation chronique connu sous le terme d’inflammaging et perturbe la pigmentation ainsi que les processus de réparation tissulaire.
Sur le plan clinique, ces altérations se traduisent par l’apparition de rides, un relâchement cutané, un amincissement du derme, une xérose et diverses dyschromies.
Facteurs intrinsèques et extrinsèques du vieillissement cutané
Le vieillissement cutané résulte de l’interaction complexe entre des facteurs extrinsèques et intrinsèques.
Les facteurs extrinsèques incluent principalement l’exposition chronique aux rayonnements ultraviolets, la pollution atmosphérique, le tabagisme, les déséquili- bres nutritionnels et le stress oxydatif qu’ils induisent.
Les facteurs intrinsèques, quant à eux, relèvent de la programmation génétique, des modifications hormonales liées à l’âge, notamment la ménopause, ainsi que de l’accumulation progressive de cellules sénescentes au sein du derme.
Une étude emblématique conduite par Guyuron et al.1 sur des jumeaux monozygotes a mis en évidence l’influence déterminante du mode de vie: malgré un patrimoine génétique identique, les sujets plus exposés au soleil ou au tabac présentaient davantage de rides et de dyschromies, soulignant ainsi le rôle prépondérant des facteurs environnementaux dans le vieillissement cutané visible.
Limites des traitements actuels
Les approches thérapeutiques con-ventionnelles telles que la photoprotection, l’application de rétinoïdes, de vitamine C, de niacinamide, ou encore l’utilisation d’acides alpha- et bêta-hydroxylés (AHA/BHA), de peelings chimiques, de lasers, de microneedling, ainsi que les injections de PRP ou d’acide hyaluronique permettent d’améliorer la texture cutanée et de stimuler, dans une certaine mesure, la néosynthèse de collagène.
Cependant, ces interventions agissent principalement sur les conséquences du vieillissement plutôt que sur ses mécanismes cellulaires sous-jacents. Elles ne ciblent pas spécifiquement les cellules sénescentes, dont la persistance entretient un état inflammatoire chronique et contribue à la dégradation progressive de la matrice ex- tracellulaire, limitant ainsi l’efficacité durable des traitements actuels.
Sénothérapeutiques: vers une nouvelle ère du vieillissement cutané
Les sénothérapeutiques ouvrent une perspective inédite dans la prise en charge du vieillissement cutané en ciblant directement la cellule sénescente, véritable nœud pathogénique de la dégénérescence dermique. Contrairement aux approches conventionnelles, ces stratégies visent à restaurer un microenvironnement tissulaire fonctionnel en réduisant ou en modulant le fardeau cellulaire sénescent. Deux axes principaux se dessinent: les sénolytiques, qui éliminent les cellules sénescentes, et les sénomorphiques, qui en neutralisent les sécrétions délétères.
Sénolytiques: éliminer la source du dysfonctionnement
Les composés sénolytiques induisent sélectivement la mort programmée des cellules sénescentes, réduisant ainsi la charge inflammatoire et favorisant la régénération du tissu dermique.
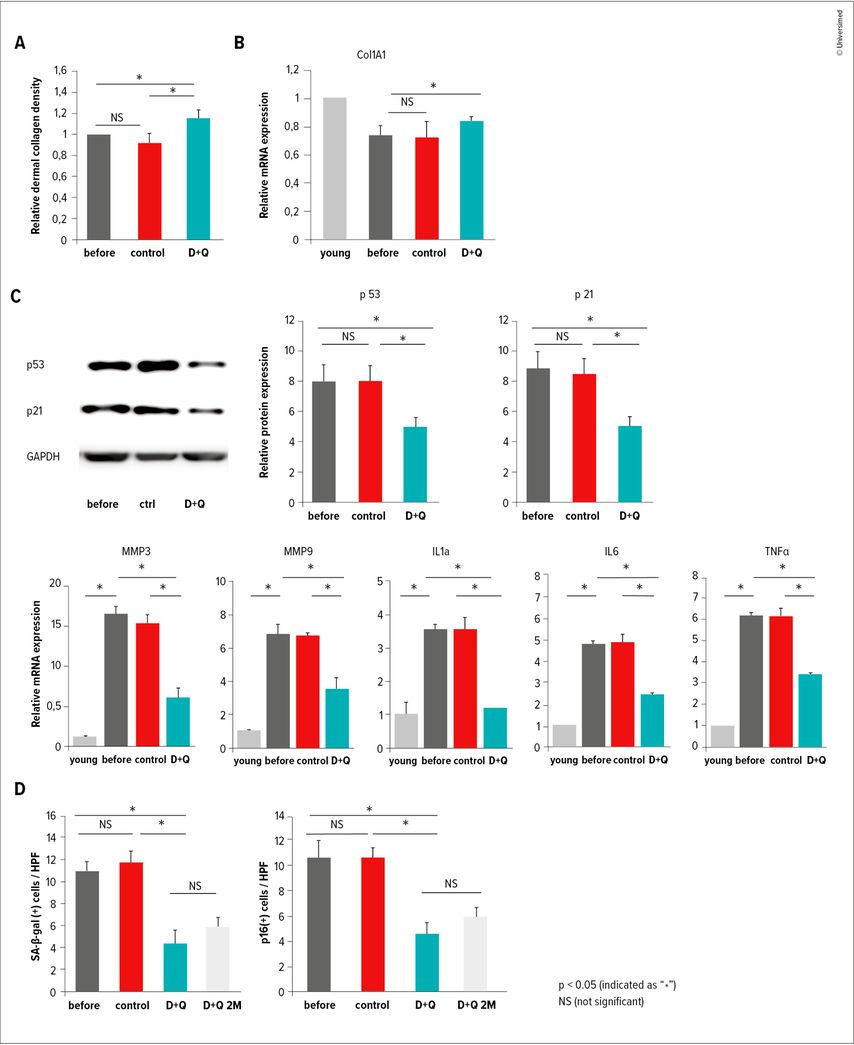
Parmi eux, l’association dasatinib+quer-cétine a démontré, sur des greffons de peau humaine âgée, une réduction marquée des cellules SA-β-gal+, p16/p21+, une diminution des cytokines pro-inflamma- toires du SASP et une restauration du réseau collagénique dermique (Fig.2).2,3
Fig. 2: Effet du traitement sénolytique dasatinib+quercétine (D+Q) sur des greffons de peau humaine âgée. Le traitement D+Q induit une restauration structurelle et fonctionnelle du derme: (A) amélioration du dépôt collagénique (H&E, trichrome); (B) augmentation de l’expression de COL1A1; (C) diminution des marqueurs de sénescence p53/p21 et des facteurs du SASP (MMP3, MMP9, IL-1α, IL-6, TNF-α); (D) diminution durable du fardeau sénescent (p16+, SA-β-gal+). Dans l’ensemble, D+Q réduit la sénescence et l’inflammation tout en restaurant la matrice collagénique dermique (adapté de Takaya K et al. 2024, Hickson LTJ et al. 2019, Ruggiero AD et al. 2023, Salamito M et al. 2023, Dąbrowska-Padewska A et al. 2023, Franco AC et al. 2022)2,3,11–14
De même, le fisetin, flavonoïde d’origine naturelle, a montré un effet sénolytique et antioxydant notable, se traduisant par une amélioration du dépôt de collagène et une diminution des marqueurs moléculaires de sénescence.4
Sénomorphiques: rééduquer plutôt que détruire
Les agents sénomorphiques n’éliminent pas les cellules sénescentes, mais réorientent leur phénotype sécrétoire afin d’en atténuer les effets pro-inflammatoires et pro-dégénératifs.
La rapamycine topique en est l’exemple le plus abouti: dans un essai clinique mené sur la peau dorsale des mains, son application quotidienne pendant 6 à 8 mois a entraîné une diminution de l’expression de p16, une réduction de l’élastose solaire, une amélioration de la différenciation épidermique et un rajeunissement clinique visible.5
D’autres combinaisons antioxydantes, telles que resvératrol, baicaline et vitamine E, ont également démontré une amélioration significative de la texture cutanée, des rides et de l’homogénéité pigmentaire après 12 semaines de traitement.6
Enfin, les peptides bioactifs, administrés par voie orale (collagen peptides) ou topique (GHK-Cu, Argireline®, SA1-III), ont été associés à une augmentation de la densité dermique, une meilleure hydratation, une réduction de l’activité des MMP et une atténuation des ridules.7–9
Ainsi, les sénothérapeutiques s’imposent comme un changement de paradigme: plutôt que de masquer les signes du vieillissement, elles visent à corriger les dérèglements cellulaires fondamentaux responsables de la dégradation du derme.
Perspectives et défis
Les données précliniques et les premiers essais cliniques convergent pour suggérer que le ciblage de la sénescence cellulaire pourrait profondément transformer la prise en charge du vieillissement cutané, en passant d’une approche palliative et symptomatique à une intervention véritablement étiologique.
Cependant, plusieurs défis majeurs demeurent. La standardisation des biomarqueurs de sénescence, la détermination des posologies et modalités d’administration optimales, ainsi que l’évaluation de la tolérance et de la sécurité à long terme des agents sénothérapeutiques constituent des prérequis indispensables à leur transposition clinique.
De plus, la sénescence exerce parfois des rôles physiologiques bénéfiques, notamment dans la réparation tissulaire et la suppression tumorale, ce qui impose une approche thérapeutique nuancée, évitant toute élimination indifférenciée des cellules sénescentes. Enfin, l’hétérogénéité cellulaire et tissulaire représente un obstacle supplémentaire à la mise au point de traitements ciblés et sélectifs.
Conclusion
Les fibroblastes sénescents se révèlent être un pivot central du vieillissement cutané, modulant à la fois la structure dermique et le microenvironnement inflammatoire.
Si les mesures de photoprotection et les traitements topiques conventionnels demeurent les piliers incontournables de la prévention et de la prise en charge esthétique, l’émergence des sénothérapeutiques, qu’il s’agisse de molécules pharmacologiques, de composés naturels ou de peptides bioactifs ouvre la voie à une approche plus intégrative et restauratrice, visant à promouvoir une peau non seulement d’apparence plus jeune, mais surtout fonc- tionnellement plus saine.
L’intégration de ces approches dans l’arsenal dermatologique nécessitera des études cliniques randomisées de grande envergure, accompagnées d’un suivi rigoureux des effets à long terme, afin de confirmer leur efficacité, leur sécurité et leur potentiel à redéfinir les paradigmes de la dermatologie anti-âge.
Littérature:
1 Guyuron B et al.: Factors contributing to the facial aging of identical twins. Plast Reconstr Surg 2009; 123(4): 1321-31 2 Takaya K et al.: Glutaminase inhibitors rejuvenate human skin via clearance of senescent cells: a study using a mouse/human chimeric model. Aging 2022; 14: 8914-26 3 Hickson LTJ et al.: Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine 2019; 47: 446-56 4 Yousefzadeh MJ et al.: Fisetin is a senotherapeutic that extends health and lifespan. EBioMedicine 2018; 36: 18-28 5 Chung CL et al.: Topical rapamycin reduces markers of senescence and aging in human skin: an exploratory, prospective, randomized trial. GeroScience 2019; 41: 861-9 6 Farris P et al.: Evaluation of efficacy and tolerance of a nighttime topical antioxidant containing resveratrol, baicalin, and vitamin e for treatment of mild to moderately photodamaged skin. J Drugs Dermatol 2014; 13(12): 1467-72 7 Asserin J et al.: The effect of oral collagen peptide supplementation on skin moisture and the dermal collagen network: evidence from an ex vivo model and randomized, placebo-controlled clinical trials. J Cosmet Dermatol 2015; 14(4): 291-301 8 Lintner K et al.: Peptides and Proteins. In: Cosmetic Dermatology: Products and Procedures. Hoboken: John Wiley & Sons Ltd. 2022 9 Pickart L et al.: GHK Peptide as a Natural Modulator of Multiple Cellular Pathways in Skin Regeneration. Biomed Res Int 2015; 2015: 648108 10 Naharro-Rodriguez J et al.: Decoding Skin Aging: A Review of Mechanisms, Markers, and Modern Therapies. Cosmetics 2025; 12: 144 11 Ruggiero AD et al.: Long-term dasatinib plus quercetin effects on aging outcomes and inflammation in nonhuman primates: implications for senolytic clinical trial design. Geroscience 2023; 45(5): 2785-2803 12 Salamito M et al: NRF2 shortage in human skin fibroblasts dysregulates matrisome gene expression and affects collagen fibrillogenesis. J Invest Dermatol 2023; 143(3): 386-97 13 Dąbrowska-Padewska A et al.: Cellular senescence in skin-related research: Targeted signaling pathways and naturally occurring therapeutic agents. Aging Cell 2023; 22(6): e13845 14 Franco AC et al.: Skin senescence: mechanisms and impact on whole-body aging. Trends Mol Med 2022; 28(2): 97-109
Das könnte Sie auch interessieren:
Régression de l’hypertension portale dans la cirrhose du foie par abstinence d’alcool
La recompensation hépatique est un nouveau concept selon lequel le traitement efficace de l’étiologie sous-jacente permet aux patient·es atteint·es d’une maladie hépatique décompensée de ...
Les systèmes «fully closed loop» continuent d’évoluer
Les systèmes «hybrid closed loop» pour l’insulinothérapie sont disponibles depuis quelques années et utilisés par de nombreuses personnes atteintes de diabète de type 1 (DT1). L’« ...
PID: voies vers le diagnostic et «treatable traits» potentiels
Les pneumopathies interstitielles diffuses (PID) ont souvent un pronostic défavorable, en particulier lorsqu’elles sont associées à une fibrose pulmonaire. Des traitements spécifiques ...