Insulinome: un caméléon neurologique
Auteur·es:
Dre méd. Svenja Leibnitz
Pr Dr méd. Emanuel Christ
Klinik für Endokrinologie, Diabetologie & Metabolismus
Universitätsspital Basel
E-mail: svenja.leibnitz@usb.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
En raison de sa rareté et de la diversité des symptômes non spécifiques, le diagnostic de l’insulinome est particulièrement difficile à poser. Malgré l’effort et la charge que cela représente pour les patient·es, l’épreuve de jeûne de 72h reste toujours l’examen diagnostique de référence. Ces dernières années, des progrès prometteurs ont toutefois été réalisés dans le diagnostic de localisation des insulinomes bénins ainsi que dans le traitement des insulinomes malins avancés.
Keypoints
-
En cas de suspicion d’insulinome, l’épreuve de jeûne de 72 heures reste l’examen diagnostique de référence. En cas d’hypoglycémie symptomatique (GL <2,5mmol/l), les examens des paramètres biochimiques suivants sont nécessaires: insuline, peptide C, pro-insuline, β-hydroxybutyrate et dépistage des sulfamides hypoglycémiants.
-
Les récepteurs au GLP-1 sont surexprimés dans 93% des insulinomes localisés, ce qui rend la TEP/TDM des récepteurs au GLP-1 supérieure aux autres méthodes d’imagerie et permet une localisation très sensible et spécifique des insulinomes bénins de petite taille.
-
La résection chirurgicale reste le traitement de référence dans les insulinomes localisés. Dans les insulinomes malins avec hypoglycémies réfractaires, tant la PRRT par 177Lu-DOTATATE que l’anticorps monoclonal ciblant le récepteur de l’insuline RZ358 donnent des résultats prometteurs.
Chez les personnes diabétiques, un taux de glucose <4mmol/l est considéré comme la limite de l’hypoglycémie. En revanche, il n’existe pas de définition uniforme pour celles qui ne sont pas diabétiques. Les directives (2023) de l’ENETS recommandent un seuil de 2,5mmol/l pendant une épreuve de jeûne de 72 heures, tandis que les directives relatives à la pratique clinique de l’Endocrine Society fixent le seuil à <3mmol/l. Dans la pratique clinique quotidienne, un seuil de 2,8mmol/l est souvent utilisé.1 Ces différences illustrent le défi que représente la définition précise de l’hypoglycémie chez les personnes non diabétiques et soulignent la nécessité de toujours l’évaluer dans un contexte clinique.
Triade de Whipple: la pierre angulaire du diagnostic de l’hypoglycémie
Aucun diagnostic de l’hypoglycémie n’est complet sans la triade de Whipple. Celle-ci comprend trois critères essentiels:
-
compatibilité des symptômes avec une hypoglycémie,
-
documentation d’une glycémie faible,
-
amélioration des symptômes après un apport en glucides.
En présence de la triade de Whipple, il convient d’abord d’examiner de plus près le contexte de survenue des symptômes: à jeun (surtout la nuit et tôt le matin) ou après les repas? Il est également essentiel de vérifier la prise de médicaments et la consommation d’alcool. Certains médicaments peuvent provoquer des hypoglycémies, tels que l’insuline, les glinides et les sulfamides hypoglycémiants, mais aussi des substances moins connues comme les antipaludiques, les bêtabloquants non sélectifs ou le lithium. D’autres causes telles que les états post-bariatriques ou les maladies auto-immunes comme la maladie d’Hirata doivent également être prises en compte. Alors qu’une anamnèse détaillée est décisive pour les premières causes citées, la détermination des taux d’insuline (concentrations très élevées) ainsi que la mesure des anticorps anti-insuline sont pertinentes en cas de maladies auto-immunes. Il est en outre important d’exclure d’autres maladies possibles, telles que l’insuffisance surrénale, hépatique ou rénale, ainsi que les maladies consomptives.
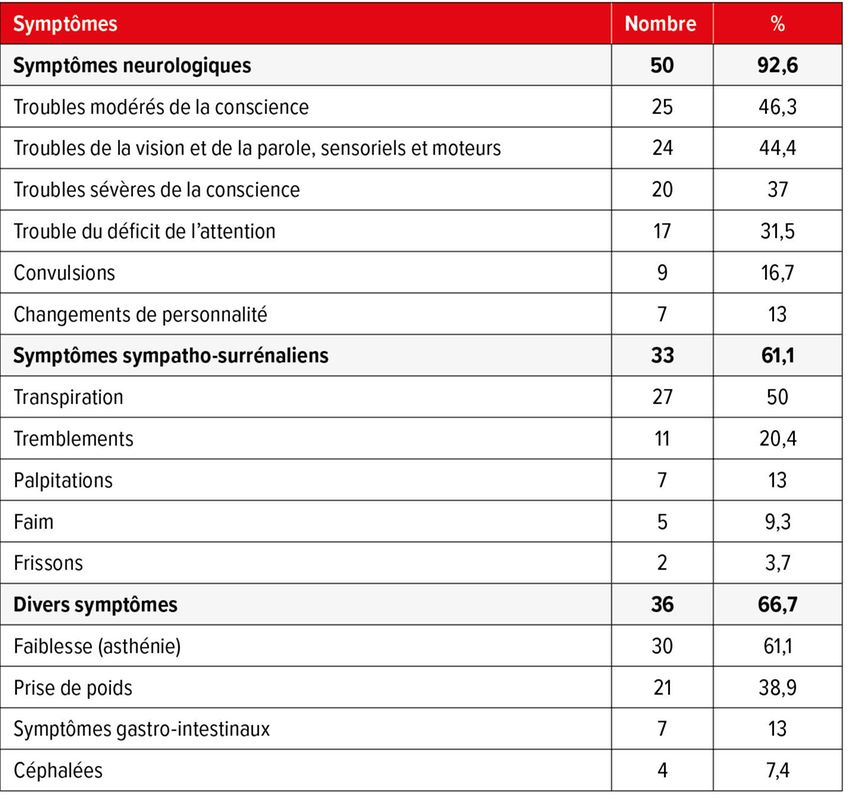
«Caméléon neurologique»
En raison de la diversité des symptômes autonomes et neuroglycopéniques, l’hypoglycémie est surnommée «caméléon neurologique». Une étude observationnelle menée à Bâle (2018) auprès de 54 patient·es souffrant d’hypoglycémie hyperinsulinémique endogène confirmée a montré que près de 93% des personnes concernées présentaient des symptômes neurologiques (Tab. 1).2 Parmi les plus fréquents figuraient des troubles modérés de la conscience ainsi que des troubles de la vision et de la parole. Des symptômes du système sympatho-surrénalien ont été observés chez 61,1% des patient·es, la transpiration étant le symptôme le plus fréquemment rapporté. Plus de la moitié des patient·es ont en outre indiqué une prise de poids significative au cours des dernières années.2 Ce vaste tableau clinique implique qu’il faut en moyenne au moins 12 mois, souvent même plus, pour poser un diagnostic définitif. Pendant cette période, les symptômes autonomes peuvent même disparaître en raison d’une insensibilité croissante à l’hypoglycémie.
Tab. 1: Aperçu des principaux symptômes de 54 patient·es souffrant d’hypoglycémie hyperinsulinémique endogène confirmée (traduit selon Valente et al. 2018)2
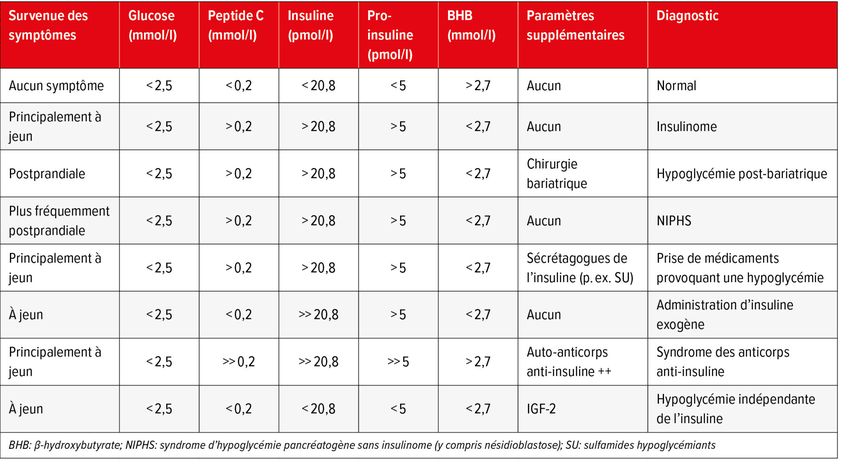
Si les symptômes surviennent à jeun, l’épreuve de jeûne de 72 heures est considérée comme l’examen de diagnostic de référence. Des études montrent qu’une hypoglycémie significative survient déjà après 48 heures chez 95% des patient·es concerné·es.3 Néanmoins, un épreuve complète de 72 heures est nécessaire pour exclure avec certitude une sécrétion d’insuline endogène. Pendant l’épreuve de jeûne supervisée, des échantillons de sang sont prélevés à intervalles réguliers jusqu’à ce qu’une hypoglycémie symptomatique soit détectable. En règle générale, on vise un taux de glucose inférieur à 2,5mmol/l.4 En cas de survenue d’une hypoglycémie, les paramètres biochimiques suivants sont nécessaires au diagnostic: insuline, peptideC ainsi que, le cas échéant, pro-insuline et β-hydroxybutyrate (BHB) (Tab. 2). En cas de suspicion d’hypoglycémie auto-induite, il est recommandé de tester les antidiabétiques oraux tels que les sulfamides hypoglycémiants et les glinides. Le test Mini Mental State (MMS) s’est avéré utile à intervalles réguliers pour évaluer les troubles neurocognitifs de manière standardisée.
Tab. 2: Critères cliniques et biochimiques chez les patient·es souffrant d’hypoglycémie non diabétique (traduit et adapté selon Hofland et al. 2023)4
TEP des récepteurs au GLP-1 dans le diagnostic des insulinomes bénins
Après confirmation biochimique d’un insulinome, on procède au diagnostic de localisation. L’algorithme diagnostique commence généralement par l’imagerie conventionnelle, comme l’IRM ou la TDM multiphasique avec phase artérielle précoce, afin de bien identifier les lésions typiquement hypervascularisées. En complément, l’échographie endoscopique (EUS) offre une grande sensibilité, car elle permet de détecter des lésions à partir de 2–5mm. Cependant, l’EUS dépend de l’examinateur·rice, est invasive et ne permet pas de visualiser la queue du pancréas dans son intégralité. Malheureusement, l’imagerie conventionnelle permet uniquement de diagnostiquer environ deux tiers des lésions bénignes, car celles-ci ne mesurent généralement que de 5 à 10mm.5
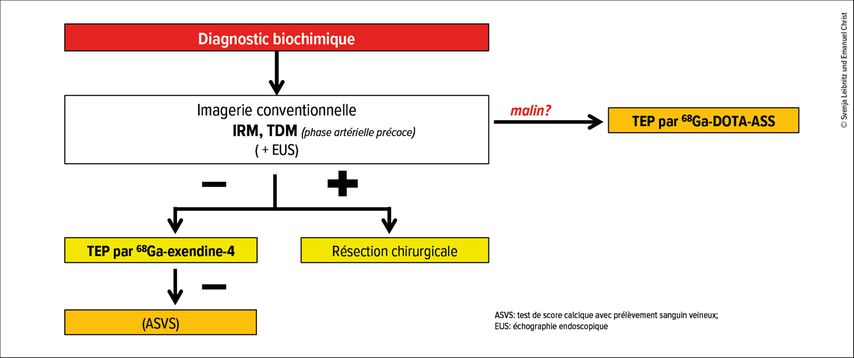
Si ces méthodes ne garantissent pas une localisation exacte, l’imagerie des récepteurs au GLP-1 est recommandée (Fig. 1). Les récepteurs au glucagon-like peptide-1 sont surexprimés dans 93% des insulinomes localisés, ce qui rend la TEP/TDM des récepteurs au GLP-1 nettement supérieure aux autres méthodes d’imagerie.5 Elle utilise un ligand spécifique, comme l’exendine-4, marqué par un radionucléide, par exemple le 68Ga pour la TEP ou le 111In pour la TEMP. Chez les patient·es dont l’imagerie conventionnelle est négative, la TEP par 68Ga-exendine-4 présente un taux de détection de 74%, ce qui est très prometteur dans ce groupe de patient·es particulièrement difficile. Si l’imagerie des récepteurs au GLP-1 n’est pas disponible, des méthodes alternatives telles que la TEP par 68Ga-DOTA-ASS ou 18F-DOPA peuvent être utilisées. Dans de rares cas, après confirmation biochimique d’un insulinome, mais échec de localisation par imagerie fonctionnelle, le test de score calcique peut être réalisé. Il permet toutefois d’identifier uniquement la zone d’approvisionnement de l’artère correspondante, non pas la localisation exacte de la tumeur.
Fig. 1: Algorithme de diagnostic de localisation en cas de suspicion d’insulinome
L’imagerie des récepteurs au GLP-1 est moins appropriée pour le diagnostic des insulinomes métastatiques, qui représentent environ 10% de tous les cas, car ils n’expriment souvent pas de récepteurs au GLP-1 – ils ne sont détectables que chez 36% des patient·es.5 Au lieu de cela, les insulinomes métastatiques expriment souvent des récepteurs de la somatostatine (SSTR2), ce qui fait de l’imagerie des SSTR une alternative importante.5 Cette méthode permet non seulement de localiser les tumeurs, mais constitue également la base d’une thérapie par fixation de radionucléides peptidiques sur les récepteurs (PRRT) par 177Lu-DOTATOC ou 177Lu-DOTATATE.
Nouvelles options thérapeutiques dans les insulinomes malins
La résection chirurgicale reste le traitement de référence dans les insulinomes localisés. Chez les patient·es présentant des maladies avancées, comme les insulinomes inopérables ou métastatiques, une approche thérapeutique multimodale est toutefois nécessaire. Outre la surveillance par mesure continue du glucose (CGMS) sous-cutanée, un régime alimentaire spécial à base de glucides complexes est d’abord recommandé sur le plan thérapeutique, tandis que l’apport en glucose par voie orale ou intraveineuse est essentiel en cas d’épisodes hypoglycémiques aigus.
Le traitement de première intention des insulinomes avancés est le diazoxide (50 à 600mg/j), qui inhibe la sécrétion d’insuline en bloquant les canaux potassiques ATP-dépendants dans les cellules β du pancréas. Bien que ce traitement soit souvent efficace, jusqu’à 80% des patient·es présentent des effets secondaires limitant la dose, tels que l’hirsutisme chez les femmes, la rétention de liquide et l’œdème.4 Les analogues de la somatostatine (ASS) de première génération peuvent être utilisés comme alternative ou en complément. Ils se lient avec une grande affinité aux récepteurs 2 et 5 de la somatostatine, inhibent la sécrétion d’insuline et ont également des propriétés antiprolifératives. Les insulinomes sans expression de SSTR2 présentent cependant un risque d’hypoglycémie paradoxale en raison de l’inhibition simultanée du glucagon par les analogues de la somatostatine.4
Dans les stades avancés de la maladie, notamment en cas de symptômes réfractaires aux analogues de la somatostatine et de progression de la tumeur, la PRRT par 177Lu-DOTATATE ainsi que l’inhibiteur de mTOR évérolimus donnent des résultats prometteurs. La PRRT cible les cellules tumorales exprimant SSTR2 et peut améliorer de manière significative les symptômes des patient·es hypoglycémiques. L’efficacité de la PRRT a été évaluée dans une étude à long terme rétrospective portant sur 26 patient·es souffrant d’hypoglycémie associée à un insulinome. Une réduction significative du score d’hypoglycémie a été obtenue chez 81% des patient·es. En outre, le traitement a permis de réduire la dose des médicaments antihypoglycémiants chez 58% des patient·es.6
Une approche innovante du traitement des hypoglycémies réfractaires a récemment été décrite dans le New England Journal of Medicine (août 2023).7 L’étude présente l’utilisation de l’anticorps monoclonal humanisé RZ358, qui module spécifiquement le récepteur de l’insuline. Un rapport de cas concernait un patient de 55 ans atteint d’un insulinome métastatique et d’une mutation MEN1, qui continuait à souffrir d’hypoglycémies engageant son pronostic vital malgré des traitements intensifs, y compris une PRRT. RZ358 agit en réduisant la liaison et la signalisation de l’insuline, ce qui entraîne une amélioration significative du contrôle glycémique. Après deux perfusions seulement, la glycémie du patient était stable et aucune hypoglycémie sévère n’est survenue au cours des neuf mois suivants. Ce cas illustre le potentiel du RZ358 en tant qu’option thérapeutique prometteuse en cas d’hypoglycémies réfractaires, en particulier dans les insulinomes malins.
Littérature:
1 Munir A: Approach to the Patient with Hypoglycemia. In: Endocrine Society (ed.) Endocrine Case Management: Meet The Professor 2024. Endocrine Society 2024: 209-18 2 Valente L et al.: Clinical presentation of 54 patients with endogenous hyperinsulinaemic hypoglycaemia: A neurological chameleon (observational study). Swiss Med Wkly 2018; 148: 1-5 3 Service FJ, Natt N: The prolonged fast. J Clin Endocrinol Metab 2000; 85: 3973-4 4 Hofland J et al.: European Neuroendocrine Tumor Society 2023 guidance paper for functioning pancreatic neuroendocrine tumour syndromes. J Neuroendocrinol. 2023; 35: 1-19 5 Christ E et al.: Innovative imaging of insulinoma: The end of sampling? A review. Endocr Relat Cancer 2020; 27: R79-92 6 Friebe L et al.: Peptide receptor radionuclide therapy is effective for clinical control of symptomatic metastatic insulinoma: A long-term retrospective analysis. J Nucl Med 2024; 65: 228-35 7 Osataphan S et al.: Anti–insulin receptor antibody for malignant insulinoma and refractory hypoglycemia. N Engl J Med 2023; 389: 767-9
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...