Inhibiteurs du SGLT2 dans l’insuffisance cardiaque: mise à jour sur les évidences et les recommandations
Auteurs:
Dr méd. Henri Lu
Dr méd. Patrick Yerly
Service de cardiologie
Unité d’insuffisance et greffe cardiaques
Centre hospitalier universitaire vaudois, CHUV
1011 Lausanne
E-mail: henri.lu@chuv.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les inhibiteurs du co-transporteur sodium-glucose de type 2 (iSGLT2) sont des antidiabétiques oraux ayant montré de nombreux bénéfices cardiovasculaires (CV) et rénaux dans la population diabétique à haut risque CV. Suite à la publication de plusieurs essais clefs, leur champ d’application est en cours d’élargissement aux patients présentant une insuffisance cardiaque, y compris les non-diabétiques. Nous présentons une revue de la littérature à jour portant sur les mécanismes d’action, indications et effets secondaires des iSGLT2.
Keypoints
-
En plus d’un effet glycosurique et diurétique osmotique, les iSGLT2 ont des effets directs sur le cœur et le rein qui contribuent aux bénéfices CV observés avec cette classe de traitement.
-
La dapagliflozine et l’empagliflozine sont actuellement fortement recommandés chez tous les patients avec HFrEF, y compris les non-diabétiques. Les indications devraient s’étendre progressivement à la HFmrEF et la HFpEF.
-
La tolérance aux iSGLT2 est bonne et le profil de sécurité rassurant. Les effets secondaires les plus fréquents sont les infections génito-urinaires non graves.
-
L’éducation thérapeutique des patients (hygiène intime, éviction de situations à risque pour une acidocétose euglycémique) est primordiale.
En Suisse, la canagliflozine, la dapagliflozine, l’empagliflozine et l’ertugliflozine sont les représentants de la classe des inhibiteurs du co-transporteur sodium-glucose de type 2 (iSGLT2), qui appartient à la famille des antidiabétiques oraux. Chez les diabétiques de type 2 à haut risque cardiovasculaire (CV), cette classe a montré une baisse des événements et de la mortalité CV, en plus de réduire la glycémie.1 De façon inattendue, les événements évités par les iSGLT2 étaient surtout des hospitalisations pour insuffisance cardiaque (IC) aiguë, ce qui a été confirmé par des études ultérieures ciblant spécifiquement des populations IC. Ces travaux ont aussi montré que l’effet bénéfique des iSGLT2 s’étendait aux insuffisants cardiaques non-diabétiques, permettant d’élargir les indications de ces médicaments à l’IC en général, surtout lorsque la fraction d’éjection du ventricule gauche (FEVG) est réduite. De nombreuses études sont en cours dans l’IC à fraction d’éjection ventriculaire gauche (FEVG) préservée et dans l’IC aiguë, avec de premiers résultats encourageants. Cette revue fait le point sur l’évidence des bénéfices des iSGLT2 dans l’IC et la place qu’ils occupent dans le traitement de l’IC.
Physiopathologie et effets des iSGLT2
Le SGLT2 est la protéine de transport qui permet au rein de réabsorber 90% du glucose filtré dans le tubule proximal du néphron, les 10% restants étant réabsorbés par le SGLT1 au niveau du tube distal chez le sujet normal. La réabsorption d’une molécule de glucose est couplée à la réabsorption d’un atome de sodium et le blocage du transport par les iSGLT2 provoque à la fois une glycosurie (d’environ 30g/j chez le non diabétique et de 70–90g/j chez le diabétique de type 2 pour 10mg de dapagliflozine2), une natriurèse et une diurèse osmotique.3
Dans le diabète, qui associe une hyperfiltration glomérulaire à une surexpression du SGLT2, la réabsorption du glucose est accrue, de même que la réabsorption de sodium et d’eau. Il s’agit là d’un des mécanismes clefs de l’hypertension artérielle et de la rétention hydrosodée dans cette maladie.4 L’inhibition du SGLT2 a un effet hypoglycémiant relativement modéré, avec une diminution de l’hémoglobine glyquée de 0,6% à 1,2%.4 En raison d’un effet neutre des iSGLT2 sur la sécrétion d’insuline et de la persistance d’une réabsorption de glucose par le SGLT1 dans le tubule distal, le risque d’hypoglycémie associé aux iSGLT2 est faible,5,6 sauf en cas d’administration concomitante d’insuline, de sulfonylurées ou de glinides.7
L’effet diurétique et natriurétique des iSGLT2 dans le diabète est transitoire,8,9 avec une contraction initiale modeste du volume plasmatique (0% à 7,3%) qui est réversible après 12 semaines de traitement.10–12 Le faible effet hypotenseur (baisse de pression artérielle systolique/diastolique de 3–6/1–2mmHg) serait surtout dû à une diminution de rigidité vasculaire de mécanisme encore peu clair, plutôt qu’à une diminution de volume circulant.4
En cas d’IC stable associée au diabète, l’effet diurétique des iSGLT2 semble par contre plus marqué et persistant. Bien qu’une faible augmentation de la natriurèse soit mesurable dans les heures qui suivent la prise du médicament,13 l’excrétion sodée mesurée sur 24 heures n’est pas différente de celle observée avec un placebo.14 L’effet diurétique des iSGLT2 dans l’IC est donc d’une autre nature et provient d’une augmentation de la clearance de l’eau libre induite par l’effet osmotique du glucose dans l’urine.14,15 En conséquence, le plasma se concentre et fait grimper la pression oncotique dans les capillaires, induisant une réabsorption nette de volume depuis le compartiment interstitiel vers le compartiment plasmatique.15,16 Ce mécanisme a pour effet de limiter la congestion de l’interstice des organes tout en préservant le volume plasmatique et « et en réduisant la stimulation du système rénine-angiotensine-aldostérone, observée avec les diurétiques de l’anse.15,16
Cet effet diurétique n’explique toutefois pas tous les bénéfices des iSGLT2 dans l’IC. En effet, la diminution de mortalité CV et du risque d’hospitalisation pour IC aiguë induite par l’empagliflozine semble identique chez les patients IC avec et sans congestion.17 De plus, l’introduction de dapagliflozine dans l’IC stable n’entraine pas plus de réduction des diurétiques standards qu’un placebo.18 Ces éléments impliquent l’existence d’effets directs des iSTLT2 sur le cœur, via des phénomènes énergétiques, électrophysiologiques, endocrino-métaboliques et modulateurs de la relaxation myocardique.19,20
De fait, les iSGLT2 sont associés à une optimisation de l’efficience énergétique du myocarde via une oxydation accrue de corps cétoniques et à leur capacité de produire plus d’ATP que le glucose ou les acides gras par molécule d’O2 consommée.21 Sur le plan de l’homéostasie ionique, ils entrainent une diminution salutaire des concentrations intra-cytoplasmiques de calcium et de sodium dans les cardiomyocytes grâce à une inhibition de l’échangeur sodium-hydrogène (NHE)-1 membranaire.22 De plus, de récentes données suggèrent que les iSGLT2 réduisent la masse de tissu adipeux viscéral (y compris épicardique), ce qui abaisse la production de cytokines pro-inflammatoires et aboutit à une désactivation des cascades de signalisation moléculaires profibrotiques et prohypertrophiques dans le myocarde.23 Finalement, l’empagliflozine réduit significativement in vitro la tension diastolique des fibres myocardiques grâce à un mécanisme NO-dépendant de phosphorylation de la titine,24 ce qui pourrait expliquer l’amélioration de fonction diastolique observée par échocardiographie chez les patients IC traités par iSGLT2.25
Les iSGLT2 pourraient enfin améliorer le pronostic de l’IC en ralentissant la progression de l’insuffisance rénale26 dont on connait l’impact pronostique dans l’IC27. Les mécanismes à l’origine de la protection rénale semblent liés au rétablissement du feed-back tubulo-glomérulaire et à une augmentation de sécrétion d’érythropoïétine.20
Contexte
Suite aux inquiétudes suscitées par la sécurité CV de nouveaux traitements antidiabétiques tels que la rosiglitazone, la Food and Drug Administration (FDA) américaine et l’Agence européenne des médicaments (EMA) requièrent depuis 2008 la conduite d’études sur le pronostic CV («cardiovascular outcome studies» ou CVOT) pour tout nouveau traitement antidiabétique.28 Pour les iSGLT2, ceci a conduit à la réalisation de quatre grands essais randomisés, avec des designs similaires et un outcome principal identique (composite de décès CV, accidents vasculaires cérébraux [AVC] et infarctus du myocarde [IM]).
Le premier, EMPA-REG OUTCOME, a testé l’empagliflozine contre placebo chez 7020 patients avec un diabète de type 2 (DT2) et une maladie CV. L’empagliflozine était associée à une baisse significative du critère de jugement principal (hazard ratio
[HR]: 0,86; intervalle de confiance à 95% [IC à 95%] : 0,74–0,99; p = 0,04), principalement induit par une réduction de la mortalité CV (HR: 0,62; IC à 95%: 0,57–0,82; p<0,001). La mortalité toutes causes était aussi significativement diminuée (HR: 0,86; IC à 95%: 0,57–0,82; p<0,001), ainsi que le risque d’hospitalisations pour IC(HR: 0,65; IC à 95%: 0,40–0,85; p=0,002).29
Le deuxième essai, CANVAS Program, a inclus 10142 patients avec un DT2 et un haut risque CV (34,4%) ou une maladie CV (65,6%).30 L’exposition à la canagliflozine était associée à une réduction significative du critère composite de jugement (HR: 0,86; IC à 95%: 0,75–0,97; p=0,02), toutefois sans différence significative pour chaque composant pris séparément. Une réduction du risque d’hospitalisation pour IC aiguë d’amplitude similaire à celle notée pour l’emplagliflozine a été relevée (HR: 0,67; IC à 95%: 0,52–0,87; p<0,001).
Le troisième essai, DECLARE-TIMI 58, a inclus 17160 patients avec un DT2 (40,6% avec une maladie CV et 59,4% à haut risque CV). Contrairement aux iSGLT2 précédents, la dapagliflozine n’a pas pu être associée à une diminution significative du critère de jugement composite (HR: 0,93; IC à 95%: 0,84–1,03; p=0,17), probablement en raison d’une moindre proportion de patients avec une maladie CV avérée dans la population étudiée. En revanche, le risque d’hospitalisation pour IC aiguë a pu être réduit dans une proportion similaire à celle observée dans les deux études précédentes (HR: 0,73; IC à 95%: 0,61–0,88).31
Le dernier essai, VERTIS-CV, a comparé l’ertugliflozine au placebo chez 8246 patients DT2 avec une maladie CV. L’ertugliflozine a été retrouvée non-inférieure au placebo en ce qui concerne le critère de jugement principal (HR: 0,97; IC à 95%: 0,85–1,11), mais diminuait à nouveau le risque d’hospitalisation pour IC de 30% (HR: 0,70; IC à 95%: 0,54–0,90).32,33
Si les résultats des CVOT concernant les bénéfices CV des iSGLT2 étaient variables, dépendant des molécules et des populations analysées, les études ont mis en évidence une diminution du risque d’hospitalisation pour IC aussi constante qu’inattendue, suggérant un effet de classe. Les bénéfices de ces traitements dans l’IC ont été confirmés dans une méta-analyse et concernent tous les patients, qu’ils soient connus ou non pour une IC au moment de l’initiation du traitement.33 Ces éléments suggèrent que: (1) les iSGLT2 pourraient prévenir l’apparition d’une IC chez les patients DT2, qui sont plus à risque de développer cette maladie que les non-diabétiques,34 et (2) que ces molécules pourraient avoir un effet bénéfique global dans l’IC, avec ou sans DT2 associé.
Efficacité des iSGLT2 dans l’insuffisance cardiaque
Suite aux résultats présentés ci-dessus, plusieurs essais cliniques ont été conduits sur des populations IC, avec ou sans DT2.
Rappelons que l’IC est divisée en trois catégories selon la valeur de FEVG: l’IC à FE réduite («heart failure with reduced ejection fraction», ou HFrEF), définie par une FEVG ≤40%, l’IC à FE modérément réduite («heart failure with mildly reduced ejection fraction», ou HFmrEF), définie par une FEVG entre 41 et 49%, enfin l’IC à FE préservée («heart failure with preserved ejection fraction», ou HFpEF), définie par l’association de symptômes et signes cliniques d’IC avec une FEVG ≥50%, des indices de dysfonction diastolique à l’échocardiographie et une augmentation des peptides natriurétiques.35
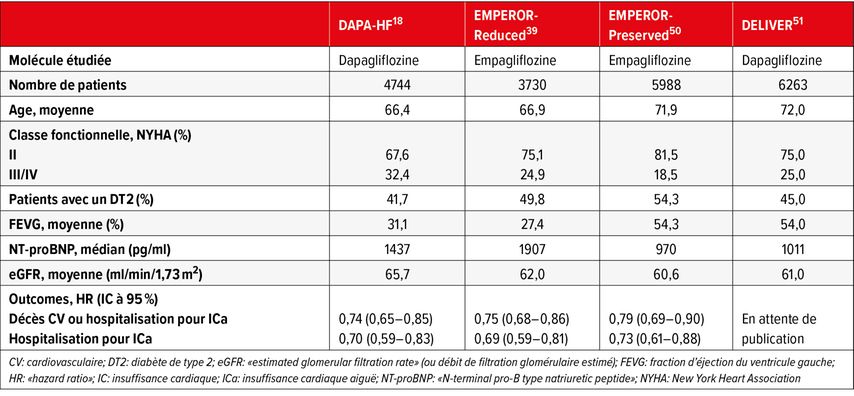
Le Tableau 1 résume les caractéristiques des grands essais cliniques publiés ou en cours, dans la HFrEF, la HFmrEF et la HFpEF.
Tab. 1: Essais cliniques principaux publiées ou en cours, portant sur les iSGLT2 en insuffisance cardiaque
Insuffisance cardiaque à FE réduite
DAPA-HF a été le premier grand essai clinique conduit avec un iSGLT2 dans la HFrEF.18 Il a comparé la dapagliflozine au placebo chez 4744 patients avec une HFrEF symptomatique ambulatoire, dont 55% étaient non-diabétiques. La dapagliflozine était associée à une diminution de l’incidence de survenue de l’outcome principal (composite de décès CV, hospitalisation pour IC, consultation urgente pour IC aiguë), avec un HR de 0,74 (IC à 95%: 0,65–0,85; p<0,001). En outre, cette étude a montré pour la première fois que l’amplitude du bénéfice associé à l’usage de dapagliflozine était similaire chez les patients avec ou sans DT2 (HR: 0,73; IC à 95%: 0,6–0,88 avec DT2 et HR: 0,75; IC à 95%: 0,63–0,90 sans DT2), démontrant que les effets des iSGLT2 dans l’IC étaient indépendants de leurs propriétés hypoglycémiantes. Dans une analyse post-hoc de DAPA-HF, l’effet bénéfique de la dapagliflozine sur l’outcome principal était observé sur un large éventail d’âge (entre 40 et 90 ans), suggérant qu’un âge avancé ne doit pas être un facteur limitant à l’introduction du traitement.36 Une autre analyse post-hoc a montré que la dapaglilozine était bien tolérée sur le plan tensionnel et induisait une baisse modeste de la pression artérielle systolique (–2,5mmHg en moyenne à 2 semaines), ce qui est d’autant plus intéressant qu’une hypotension artérielle peut être un facteur limitant d’initiation de traitements pronostiques dans la population HFrEF.37,38
Le deuxième essai clinique, EMPEROR-Reduced, avait un design globalement similaire à DAPA-HF, tout en incluant des patients avec une HFrEF plus avancée.39 De façon similaire à DAPA-HF, l’empagliflozine, comparée au placebo, était associée à une diminution significative du même outcome composite (HR: 0,75; IC à 95%: 0,65–0,85; p<0,001) chez les 3730 patients inclus. Les bénéfices de l’empagliflozine étaient indépendants des niveaux de peptide natriurétique, de la fonction rénale et de la présence ou non d’un DT2.40
Les iSGLT2 dans la HFrEF ont un profil de sécurité rassurant: dans une méta-analyse rassemblant les résultats de DAPA-HF et d’EMPEROR-Reduced, le risque d’effets indésirables graves associé aux molécules testées (insuffisance rénale, acidocétose, hypoglycémie) n’était pas augmenté par rapport au placebo.41
Suite aux résultats convaincants des deux études présentées ci-dessus, les guidelines de la Société européenne de cardiologie (ESC) recommandent la prescription de dapagliflozine ou d’empagliflozine avec un niveau de classe I à tous les patients en HFrEF, qu’ils soient ou non diabétiques. Ces deux iSGLT2 font donc désormais partie de la quadruple thérapie recommandée dans la HFrEF, au même titre que les bêtabloquants, les inhibiteurs de l’enzyme de conversion ou le sacubitril-valsartan, et les antagonistes des récepteurs minéralocorticoïdes.35,42 Il faut souligner que les patients déjà au bénéfice d’un traitement intensif comprenant notamment le sacubitril-valsartan bénéficient eux aussi d’une réduction significative de leur risque d’événements associés à l’IC ou à l’insuffisance rénale, sans augmentation des effets indésirables.43
Le moment opportun pour l’introduction du traitement n’est toutefois pas clairement précisé. L’effet bénéfique des iSGLT2 survenant très tôt (effet significatif de la dapagliflozine/empagliflozine sur le critère de jugement combiné visible déjà à partir de 28/21 jours de traitement),17,44 des experts proposent d’introduire le traitement immédiatement après la pose du diagnostic à la dose standard, en restant attentif à la nécessité d’ajuster éventuellement les diurétiques.45
Insuffisance cardiaque à FE modérément réduite et à FE préservée
Dans les pays occidentaux, la HFpEF compte pour environ la moitié des cas d’IC.46 Les classes de médicaments indiquées dans la HFrEF ont été évaluées dans la HFpEF sans succès, même si le candesartan,47 la spironolactone48 et le sacubitril-valsartan49 ont montré des résultats encourageants. Dans les guidelines de l’ESC, la décongestion et la prise en charge des comorbidités restent ainsi les seuls axes de traitement recommandés dans la HFpEF (recommandations de classe I, niveaux de preuve C).35 Ces guidelines ont cependant été rédigées avant la publication d’EMPEROR-Preserved. Cet essai a comparé l’empagliflozine au placebo chez 5988 patients avec une IC symptomatique et une FEVG ≥40% (HFmrEF et HFpEF), et un NTproBNP >300ng/l (>900ng/l en cas de fibrillation auriculaire).50 L’empagliflozine a mené à une réduction significative du critère de jugement principal (décès CV ou hospitalisation pour IC), avec un HR de 0,79 (IC à 95%: 0,69–0,90), principalement induit par une baisse du risque d’hospitalisation (HR: 0,73; IC à 95%: 0,61–0,88). Comme dans EMPEROR-Reduced, les bénéfices étaient indépendants de la présence ou non de DT2. Notons qu’en analyse de sous-groupes, le bénéfice de l’empagliflozine n’était significatif qu’avec une FEVG comprise entre 40 et 65%, ce qui est assez similaire aux effets du candesartan, de la spironolactone et du sacubitril-valsartan. De plus, l’empagliflozine n’a pas eu d’effet significatif sur la mortalité CV (HR: 0,91; IC à 95%: 0,76–1,09) ou totale (HR: 1,0), ce qui oblige à conclure à l’absence d’option thérapeutique améliorant la survie dans la HFpEF à ce jour. Un autre essai clinique très récemment présenté, DELIVER, testant la dapagliflozine contre placebo dans une population proche, a retrouvé des résultats globalement similaires.51
Suite à la publication des résultats d’EMPEROR-Preserved, les guidelines de l’American College of Cardiology parues début 2022, recommandent l’utilisation de l’empagliflozine à la fois dans la HFmrEF et dans la HFpEF (recommandations de classe IIa, niveaux de preuve B).42 De même, l’EMA recommande depuis peu l’initiation de ce traitement dans l’IC quelle que soit la FEVG. La décision de Swissmedic sur cette question n’avait pas encore été transmise lors de la rédaction de cet article.52
Insuffisance cardiaque aiguë
Fig. 1: Les iSGLT2 font désormais partie de la quadruple thérapie recommandée dans la HFrEF, au même titre que les bêtabloquants, les inhibiteurs de l’enzyme de conversion ou le sacubitril-valsartan, et les antagonistes des récepteurs minéralocorticoïdes
Si les essais présentés ci-dessus se sont intéressés aux effets des iSGLT2 dans l’IC stable, plusieurs ont aussi été menés dans l’IC aiguë. La première, SOLOIST-WHF, a comparé la sotagliflozine (inhibiteur à la fois du SGLT1 et du SGLT2) au placebo chez 1222 patients avec un DT2 hospitalisés pour une IC aiguë, quelle que soit la FEVG.53 La sotagliflozine était introduite une fois les patients stabilisés, soit pendant l’hospitalisation soit dans les jours suivant la sortie d’hôpital. Elle était associée à une baisse importante du critère de jugement principal (décès CV, hospitalisation pour IC ou consultation ambulatoire urgente pour IC aiguë), avec un HR de 0,67 (IC à 95%: 0,52–0,85; p<0,001), cet effet étant retrouvé pour une FEVG <50% (n=966) et pour une FEVG ≥50% (n=256).
Le deuxième essai clinique, EMPULSE, a étudié l’empagliflozine chez 530 patients avec une IC aiguë (de novo ou chronique décompensée) stabilisée, toutes FEVG confondues, avec ou sans diabète.54 Une amélioration significative du critère de jugement principal a été observée dans le groupe empagliflozine (composite de décès toutes causes, nombre d’évènements liés à une IC ou changement du «Kansas City Cardiomyopathy Questionnaire Total Symptom Score», ce dernier évaluant la qualité de vie) à 90 jours (win ratio: 1,36; IC à 95%: 1,09–1,68; p=0,0054), chez les patients DT2 et non-diabétiques.
Ces études suggèrent que les iSGLT2 pourraient être initiés dans un contexte aigu, en milieu hospitalier, une fois les patients stabilisés. Notons que les patients présentant un IM récent (<90 jours) étaient exclus de ces études, et que les iSGLT2 ne sont actuellement pas recommandés chez ces patients. L’essai DAPA-MI (identifiant clinicaltrials.gov: NCT04564742), évaluant la dapagliflozine dans ce contexte, est en cours.
En pratique
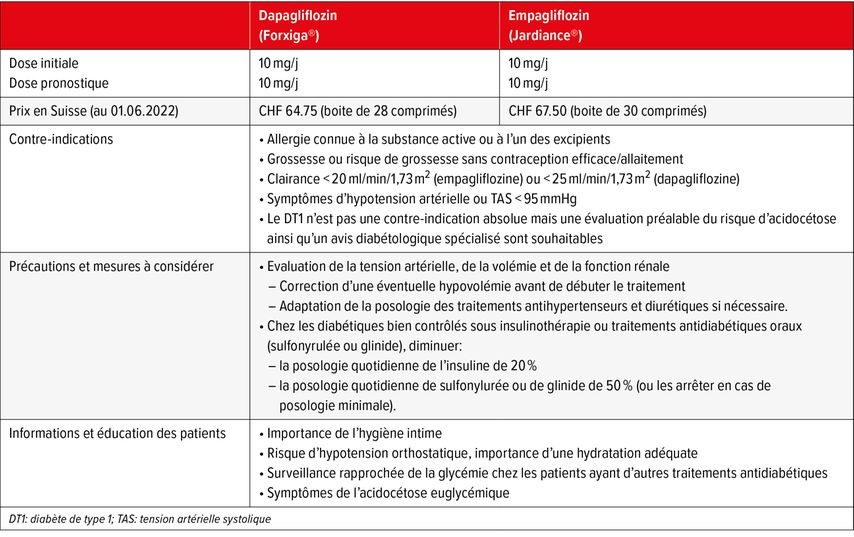
La dapagliflozine et l’empagliflozine sont globalement bien tolérées dans la population IC avec un risque faible d’effets indésirables graves. Ces médicaments ne nécessitent par ailleurs aucune titration ni aucun monitoring du potassium.38 La posologie pronostique est de 10mg/j en une seule prise pour les deux molécules.35 Les conseils de prescription sont résumés dans le Tableau 2.
Les effets indésirables les plus courants des iSGLT2 sont les mycoses génitales, qui sont liées à leur action glycosurique, et surviennent plus fréquemment chez les femmes. Ces infections sont en général bénignes et évoluent favorablement sous traitement antifongique local.6 Une augmentation du risque d’infection des voies urinaires basses a également été décrite.55 Une diminution modeste de la fonction rénale survient fréquemment lors des premières semaines de traitement (baisse de la clairance d’environ 4ml/min à 2 semaines), avec stabilisation par la suite. Une augmentation de créatinine ne doit en principe pas faire arrêter les iSGLT2, sauf si la clairance descend en-dessous des limites recommandées (cf. Tab. 2).40,56 Cette insuffisance rénale initiale est compensée par l’effet néphroprotecteur à moyen terme, avec une dégradation de fonction rénale plus lente chez les patients traités par iSGLT2.
L’acidocétose euglycémique est une complication rare (incidence d’environ 0,5/1000 patients-année) mais redoutée des iSGLT2.57 Probablement favorisée par une stimulation de la production de corps cétoniques, elle est définie comme une acidose métabolique à trou anionique augmenté en présence d’une glycémie normale et d’une augmentation des concentrations sanguines ou urinaires de corps cétoniques.58 Les manifestations cliniques sont peu spécifiques (nausées, vomissements, douleurs abdominales) mais peuvent mener à des conséquences graves (collapsus circulatoire, décès). Différents facteurs déclenchants ont été décrits: infections sévères, jeûne, déshydratation, chirurgie, arrêt brutal d’une insulinothérapie concomitante. En raison du risque augmenté d’acidocétose, une suspension des iSGLT2 est recommandée en cas d’évènement aigu.58 En outre, les iSGLT2 ne sont pas recommandés de routine dans le DT1. Si leur initiation est considérée nécessaire, un avis préalable diabétologique est souhaitable.
Parmi les effets indésirables très rares, notons une possible augmentation de l’incidence des amputations des membres inférieurs et des fractures osseuses, uniquement observées avec la canagliflozine dans l’essai clinique CANVAS Program30, ainsi que quelques cas de gangrène de Fournier.59
Conclusions
Initialement développés comme antidiabétiques oraux, les iSGLT2 ont maintenant vu leur champ d’application s’élargir à l’IC. La dapagliflozine et l’empagliflozine sont recommandés dans le traitement de la HFrEF au même titre que les IEC/sacubitril-valsartan, les bêtabloquants et les antagonistes des récepteurs minéralocorticoïdes, et leurs indications sont en cours d’extension à la HFmrEF, à la HFpEF, ainsi qu’à l’IC aiguë. Dans les années à venir, les cardiologues et les médecins de premier recours seront de plus en plus amenés à prescrire et à suivre des patients sous iSGLT2.
Littérature:
1 Brown E et al.: SGLT2 inhibitors and GLP-1 receptor agonists: established and emerging indications. Lancet 2021; 398: 262-76 2 Yakovleva T et al.: Comparison of the urinary glucose excretion contributions of SGLT2 and SGLT1: A quantitative systems pharmacology analysis in healthy individuals and patients with type 2 diabetes treated with SGLT2 inhibitors. Diabetes Obes Metab 2019; 21: 2684-93 3 DeFronzo RA et al.: Renal, metabolic and cardiovascular considerations of SGLT2 inhibition. Nat Rev Nephrol 2017; 13: 11-26 4 Brown E et al.: A review of the mechanism of action, metabolic profile and haemodynamic effects of sodium-glucose co-transporter-2 inhibitors. Diabetes Obes Metab 2019; 21 (Suppl 2): 9-18 5 Vallon V, Thomson SC: Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition. Diabetologia 2017; 60: 215-25 6 Lu H et al.: Use of SGLT2 inhibtors in cardiovascular diseases: why, when and how? A narrative literature review. Swiss Med Wkly 2020; 150: w20341 7 Vasilakou D et al.: Sodium-glucose cotransporter 2 inhibitors for type 2 diabetes: a systematic review and meta-analysis. Ann Intern Med 2013; 159: 262-74 8 Iijima H et al.: Pharmacokinetics, pharmacodynamics, and safety of canagliflozin in Japanese patients with type 2 diabetes mellitus. Adv Ther 2015; 32: 768-82 9 Tanaka H et al.: Factors affecting canagliflozin-induced transient urine volume increase in patients with type 2 diabetes mellitus. Adv Ther 2017; 34: 436-51 10 Sha S et al.: Effect of the sodium glucose co-transporter 2 inhibitor canagliflozin on plasma volume in patients with type 2 diabetes mellitus. Diabetes Obes Metab 2014; 16: 1087-95 11 Lambers Heerspink HJ et al.: Dapagliflozin a glucose-regulating drug with diuretic properties in subjects with type 2 diabetes. Diabetes Obes Metab 2013; 15: 853-62 12 Scholtes RA et al.: Natriuretic effect of two weeks of dapagliflozin treatment in patients with type 2 diabetes and preserved kidney function during standardized sodium intake: results of the DAPASALT trial. Diabetes Care 2021; 44: 440-7 13 Griffin M et al.: Empagliflozin in heart failure: diuretic and cardiorenal effects. Circulation 2020; 142: 1028-39 14 Mordi NA et al.: Renal and cardiovascular effects of SGLT2 inhibition in combination with loop diuretics in patients with type 2 diabetes and chronic heart failure: the RECEDE-CHF trial. Circulation 2020; 142: 1713-24 15 Boorsma EM et al.: Effects of empagliflozin on renal sodium and glucose handling in patients with acute heart failure. Eur J Heart Fail 2021; 23: 68-78 16 Mullens W, Martens P: Empagliflozin and renal sodium handling: an intriguing smart osmotic diuretic. Eur J Heart Fail 2021; 23: 79-82 17 Packer M et al.: Empagliflozin in patients with heart failure, reduced ejection fraction, and volume overload: EMPEROR-Reduced trial. J Am Coll Cardiol 2021; 77: 1381-92 18 McMurray JJV et al.: Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995-2008 19 von Lewinski D et al.: Glucose-transporter-mediated positive inotropic effects in human myocardium of diabetic and nondiabetic patients. Metabolism 2010; 59: 1020-8 20 Pabel S et al.: SGLT2 inhibitors and their mode of action in heart failure-has the mystery been unravelled? Curr Heart Fail Rep. 2021; 18: 315-28 21 Ferrannini E et al.: CV protection in the EMPA-REG OUTCOME trial: a “thrifty substrate” hypothesis. Diabetes Care 2016; 39: 1108-14 22 Baartscheer A et al.: Empagliflozin decreases myocardial cytoplasmic Na(+) through inhibition of the cardiac Na(+)/H(+) exchanger in rats and rabbits. Diabetologia 2017; 60: 568-73 23 Lahnwong S et al.: Potential mechanisms responsible for cardioprotective effects of sodium-glucose co-transporter 2 inhibitors. Cardiovasc Diabetol 2018; 17: 101 24 Pabel S et al.: Empagliflozin directly improves diastolic function in human heart failure. Eur J Heart Fail 2018; 20: 1690-700 25 Soga F et al.: Impact of dapagliflozin on left ventricular diastolic function of patients with type 2 diabetic mellitus with chronic heart failure. Cardiovasc Diabetol 2018; 17: 132 26 Heerspink HJL et al.: Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020; 383: 1436-46 27 Rangaswami J et al.: Cardiorenal syndrome: classification, pathophysiology, diagnosis, and treatment strategies: a scientific statement from the American Heart Association. Circulation 2019; 139: e840-78 28 Woodcock J et al.: Regulatory action on rosiglitazone by the U.S. Food and Drug Administration. N Engl J Med 2010; 363: 1489-91 29 Zinman B et al.: Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373: 2117-28 30 Neal B et al.: Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017; 377: 644-57 31 Wiviott SD et al.: Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019; 380: 347-57 32 Cannon CP et al.: Cardiovascular outcomes with ertugliflozin in type 2 diabetes. N Engl J Med 2020; 383: 1425-35 33 Zannad F, Cowie MR: VERTIS-CV: More evidence that sodium glucose cotransporter 2 inhibition brings rapid and sustained heart failure benefit. Circulation 2020; 142: 2216-18 34 Kannel WB, McGee DL: Diabetes and cardiovascular disease. The Framingham study. JAMA 1979; 241: 2035-8 35 McDonagh TA et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42: 3599-726 36 Martinez FA et al.: Efficacy and safety of dapagliflozin in heart failure with reduced ejection fraction according to age: insights from DAPA-HF. Circulation 2020; 141: 100-11 37 Serenelli M et al.: Effect of dapagliflozin according to baseline systolic blood pressure in the Dapagliflozin and Prevention of Adverse Outcomes in Heart Failure trial (DAPA-HF). Eur Heart J 2020; 41: 3402-18 38 Rosano GMC et al.: Patient profiling in heart failure for tailoring medical therapy. A consensus document of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2021; 23: 872-81 39 Packer M et al.: Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020; 383: 1413-24 40 Zannad F et al.: Cardiac and kidney benefits of empagliflozin in heart failure across the spectrum of kidney function: insights from EMPEROR-reduced. Circulation 2021; 143: 310-21 41 Zannad F et al.: SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. Lancet 2020; 396: 819-29 42 Heidenreich PA et al.: 2022 AHA/ACC/HFSA Guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol 2022; 79: e263-421 43 Packer M et al.: Influence of neprilysin inhibition on the efficacy and safety of empagliflozin in patients with chronic heart failure and a reduced ejection fraction: the EMPEROR-Reduced trial. Eur Heart J 2021; 42: 671-80 44 Berg DD et al.: Time to Clinical benefit of dapagliflozin and significance of prior heart failure hospitalization in patients with heart failure with reduced ejection fraction. JAMA Cardiol 2021; 6: 499-507 45 Tomasoni D et al.: Sodium-glucose co-transporter 2 inhibitors as an early, first-line therapy in patients with heart failure and reduced ejection fraction. Eur J Heart Fail 2022; 24: 431-41 46 Dunlay SM et al.: Epidemiology of heart failure with preserved ejection fraction. Nat Rev Cardiol 2017; 14: 591-602 47 Yusuf S et al.: Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362: 777-81 48 Pitt B et al.: Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014; 370: 1383-92 49 Solomon SD et al.: Angiotensin-neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med 2019; 381: 1609-20 50 Anker SD et al.: Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021; 385: 1451-61 51 Solomon SD et al.: Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction. N Engl J Med 2022; 387:1089-98 52 https://www.ema.europa.eu/en/documents/product-information/jardiance-epar-product-information_en.pdf 53 Bhatt DL et al.: Sotagliflozin in patients with diabetes and recent worsening heart failure. N Engl J Med 2021; 384: 117-28 54 Voors AA et al.: SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med 2022; 28: 568-74 55 Li D et al.: Urinary tract and genital infections in patients with type 2 diabetes treated with sodium-glucose co-transporter 2 inhibitors: A meta-analysis of randomized controlled trials. Diabetes Obes Metab 2017; 19: 348-55 56 Jhund PS et al.: of Dapagliflozin on renal function and outcomes in patients with heart failure with reduced ejection fraction: results of DAPA-HF. Circulation 2021; 143: 298-309 57 Rosenstock J, Ferrannini E: Euglycemic diabetic ketoacidosis: a predictable, detectable, and preventable safety concern with SGLT2 inhibitors. Diabetes Care 2015; 38: 1638-42 58 Lu H et al.: SGLT2 Inhibitors, what the emergency physician needs to know: a narrative review. J Clin Med 2021; 10: 2036 59 Bersoff-Matcha SJ et al.: Fournier gangrene associated with sodium-glucose cotransporter-2 inhibitors: a review of spontaneous postmarketing cases. Ann Intern Med 2019; 170: 764-9
Das könnte Sie auch interessieren:
Plus qu’un problème de sécheresse: gros plan sur la maladie de Sjögren
La maladie de Sjögren est une maladie auto-immune systémique inflammatoire chronique présentant une grande variabilité clinique. Elle fait partie de la famille des collagénoses, à ...
Le Pelargonium sidoides est-il une option thérapeutique chez les enfants atteints du syndrome mains-pieds-bouche?
Une étude a examiné pour la première fois l’extrait de racine de Pelargonium sidoides EPs®7630 chez des enfants atteints du syndrome mains-pieds-bouche et a démontré une réduction ...
Prise en charge des acouphènes en 2025
Le traitement des acouphènes a évolué au cours des dernières années. Les directives de l’AWMF sur la prise en charge des acouphènes proposent des recommandations fondées sur des preuves ...