Induction d’une tolérance obtenue par la transplantation combinée d’un rein et de cellules souches
Auteure:
Dre méd. Kerstin Hübel
Klinik für Nephrologie
Klinik für Viszeral- und Transplantationschirurgie
Universitätsspital Zürich
E-mail: kerstin.huebel@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’immunosuppression à long terme faisant suite à une transplantation rénale entraîne diverses complications et peut raccourcir la survie des transplantés. L’objectif est donc d’induire une tolérance immunologique. La transplantation combinée d’un rein et de cellules souches du sang, HLA identiques, qui fait l’objet de l’étude swisstolerance.CH, constitue une approche en ce sens.
Pour la plupart des patients en phase terminale d’insuffisance rénale, la transplantation rénale est le traitement primaire de la maladie, en l’absence de contre-indication à une immunosuppression à vie. La survie des greffons rénaux au cours des premières années qui suivent la transplantation est excellente depuis les dernières décennies, tandis que la survie à long terme n’a pas connu de progrès significatifs au cours de cette même période. Sous traitement immunosuppresseur à long terme, la survie des patients est raccourcie en raison de complications néoplasiques, infectieuses et cardiovasculaires. La durée de vie des allogreffes est limitée, entre autres, en raison du rejet chronique, de la toxicité des médicaments, des infections (p.ex. néphropathie à virus BK) et de la fibrose. Toutes ces complications pourraient être contrôlées, réduites ou totalement évitées si l’on parvenait à induire une tolérance immunologique.1 Par tolérance, nous entendons l’absence spécifique de réaction immunitaire destructrice vis-à-vis du tissu transplanté sans prise d’immunosuppresseurs.
Induction d’une tolérance
Dans des modèles précliniques, différentes approches visant à l’induction d’une tolérance ont été testées avec succès, notamment le blocage de la co-stimulation ou le transfert de différents types de cellules régulatrices. Cependant, la seule approche qui a été mise en œuvre avec succès jusqu’à présent dans le cadre de modèles primates et d’études cliniques repose sur la transplantation d’un rein et de cellules souches hématopoïétiques provenant du même donneur (transplantation de cellules souches hématopoïétiques, TCSH), ce qui entraîne un chimérisme lympho-hématopoïétique mixte.
Aux États-Unis, trois groupes ont conçu, indépendamment les uns des autres, des protocoles pour atteindre cet objectif, en utilisant différents schémas de conditionnement, différentes préparations de cellules souches et différentes échéances (conditionnement avant ou après la transplantation rénale).2–4 Seul le groupe de Stanford a conçu un protocole prévoyant un conditionnement après la transplantation rénale, de sorte que cette approche pourrait théoriquement être appliquée à la transplantation d’organes de donneurs décédés. Nous avons donc décidé d’utiliser un protocole similaire pour la première étude réalisée en Europe portant sur la transplantation rénale combinée à la TCSH.
Étude swisstolerance.CH
L’étude swisstolerance.CH est une étude de faisabilité sur la transplantation combinée d’un rein et de cellules souches du sang, HLA identiques, dans une fratrie, afin d’obtenir une tolérance immunologique spécifique au donneur vis-à-vis du greffon rénal.5 Le critère d’évaluation primaire de l’étude était l’acceptation du greffon rénal et la capacité à arrêter complètement le traitement immunosuppresseur après un an.
Les critères d’évaluation secondaires étaient la détection d’un chimérisme après 6 mois, l’absence de réaction du greffon contre l’hôte («graft-versus-host disease», GvHD) après 6 et 12 mois, l’absence de rejet de l’allogreffe rénale après 6 et 12 mois, la récupération des lymphocytes T et la reconstitution immunitaire, l’absence d’infections opportunistes (immunocompétence) et la qualité de vie. Le chimérisme se définit par la présence de cellules hématopoïétiques du donneur dans le sang périphérique.
Le centre de transplantation rénale de l’Hôpital universitaire de Zurich réalise entre 85 et 100 greffes du rein par an, dont environ 25 réalisées à la suite de dons d’organes par des personnes vivantes. Chaque candidat à une transplantation rénale est systématiquement examiné en vue d’un éventuel don d’organe par une personne vivante. Lorsqu’un candidat avait un donneur potentiel dans sa fratrie, il a été informé du concept et du protocole de l’étude swisstolerance.CH. Entre 2016 et 2020, huit receveurs et leurs donneurs, HLA identiques, issus de leur fratrie ont été évalués et trois d’entre eux ont été inclus dans cet essai pilote (Tab. 1). Les cinq autres ont été exclus de l’étude soit en raison d’une incompatibilité AB0 (critère d’exclusion), soit parce que le donneur présentait une contre-indication au don d’organe de son vivant.
Patiente 1
Notre première patiente était une femme caucasienne de 57 ans souffrant d’une maladie rénale chronique en phase terminale. La cause en était une glomérulopathie qui n’a pas pu être spécifiée au moment du diagnostic. Elle a bénéficié d’une transplantation rénale préemptive, le donneur étant son frère, HLA identique, âgé de 53 ans. L’immunosuppression a été effectuée selon le protocole standard au cours du premier mois (sérum antilymphocytaire [SAL], ciclosporine, mycophénolate mofétil et prednisone) et a été poursuivie à partir du deuxième mois sous forme d’administration de ciclosporineA en monothérapie. La ciclosporine a été progressivement réduite après la première biopsie réalisée six mois après la transplantation, ne révélant aucun signe de rejet, et arrêtée après la deuxième biopsie réalisée onze mois après la transplantation. Le chimérisme sur sang total était à cette échéance d’environ 50%.
La patiente n’a jamais dû être hospitalisée après la transplantation. La première année post-transplantation a été caractérisée par un nombre réduit de problèmes médicaux. Trois mois après la transplantation, elle a présenté un syndrome douloureux induit par un inhibiteur de la calcineurine (SDIC) révélant des caractéristiques typiques à la scintigraphie osseuse. Les douleurs ont été bien contrôlées par des analgésiques et ont disparu lorsque la ciclosporineA a été réduite puis arrêtée conformément au protocole de l’étude. Une infection des voies urinaires, traitée par antibiotiques, est survenue dix mois après la transplantation. En outre, une réactivation asymptomatique du cytomégalovirus (CMV), ne nécessitant aucun traitement (titre maximal: 600UI/ml), a été observée. Deux mois et demi après la transplantation, la patiente a repris son travail à son poste habituel. Environ un an après la transplantation, une légère albuminurie a été observée; elle a augmenté jusqu’à ce qu’elle atteigne environ 1g/j à la fin de la deuxième année. La troisième biopsie rénale a été pratiquée 18 mois après la transplantation et a révélé une glomérulonéphrite primaire (récidivante ou de novo). Désormais, cinq ans après la transplantation, la patiente présente une fonction rénale globalement stable et une albuminurie d’environ 2g/j.
Patiente 2
La deuxième patiente était une femme caucasienne de 61 ans souffrant d’une maladie rénale en phase terminale due à une glomérulopathie non spécifiée de manière plus précise. Elle était sous dialyse péritonéale depuis deux ans et neuf mois avant de recevoir le rein de sa sœur, HLA identique, âgée de 54 ans. L’immunosuppression a été effectuée selon le protocole standard de l’étude et a été poursuivie par l’administration de ciclosporineA en monothérapie à partir du deuxième mois. Le chimérisme du donneur obtenu était faible. Nous avons donc maintenu les taux de ciclosporineA sur sang total entre 200 et 250µg/l pendant 12 mois.
La ciclosporineA a finalement été arrêtée deux ans après la transplantation; la biopsie était normale à cette échéance. Presque quatre ans après la transplantation et sans traitement immunosuppresseur depuis pratiquement deux ans, la patiente présente désormais une fonction rénale stable en l’absence de protéinurie.
Depuis la transplantation, la patiente n’a jamais dû être hospitalisée. La seule complication majeure a été un ulcère gastrique à Helicobacter négatif, qui a été traité avec succès par un inhibiteur de la pompe à protons.
Patient 3
Le troisième patient était un homme caucasien de 49 ans souffrant d’une polykystose rénale (PKRAD). Il a été sous dialyse péritonéale pendant trois mois et demi avant de recevoir un rein par un donneur vivant, HLA identique, qui était sa sœur âgée de 46 ans. L’immunosuppression a été effectuée selon le protocole standard de l’étude et a été poursuivie par l’administration de ciclosporineA en monothérapie à partir du deuxième mois. Peu après la transplantation, le patient a dû être hospitalisé pendant trois jours pour la fenestration d’une lymphocèle périrénale.
La première biopsie du greffon, effectuée six mois après la transplantation, n’a révélé aucun signe de rejet. En raison de la diminution rapide du chimérisme du donneur, nous avons maintenu les taux de ciclosporineA sur sang total à 200–250µg/l jusqu’au 9e mois et n’avons commencé à réduire la dose qu’ensuite. La deuxième biopsie effectuée après 12 mois, pendant la réduction de la ciclosporineA, a révélé une légère néphropathie à virus BK. À cette échéance, une virémie BK a été détectée à un niveau très bas d’environ 975UI/ml. L’arrêt progressif du traitement par la ciclosporine a donc été poursuivi et, depuis le 14e mois post-transplantation, le patient ne nécessite plus d’immunosuppression. Deux ans après la transplantation et en l’absence de traitement immunosuppresseur depuis 10 mois, il présente désormais une fonction rénale stable, sans signe de protéinurie (Tab. 2) et sans virémie BK. Dix semaines seulement après la transplantation, il a repris son travail à 100%.
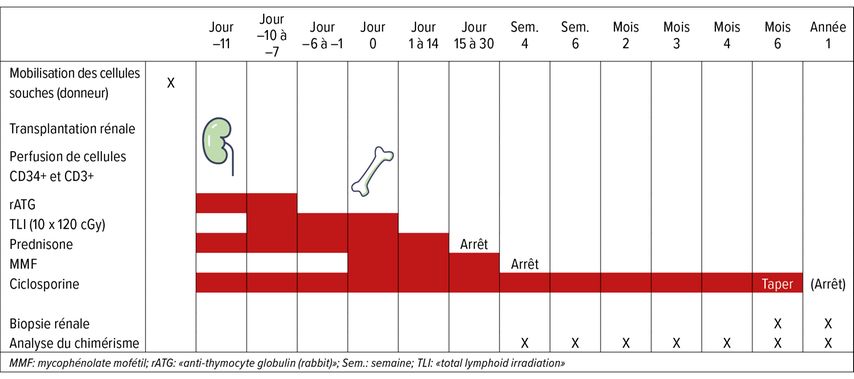
Tab. 2: Aperçu du protocole de l’étude indiquant les échéances de la transplantation rénale, de la transplantation de cellules souches du sang, de l’immunosuppression, mais aussi de l’analyse du chimérisme et des biopsies rénales (adapté d’après Fehr et al.)5
Discussion
L’étude swisstolerance.CH est la première étude européenne à utiliser un protocole établi visant à l’induction d’une tolérance.
Les résultats concordent avec ceux rapportés par Scandling et al. de l’Université de Stanford.3 Nous sommes donc parvenus à démontrer que ce protocole conçu pendant des années – en dépit de sa complexité – peut être reproduit avec succès par un deuxième groupe dans une autre partie du monde. Le critère d’évaluation primaire de notre étude a été atteint par les trois premiers patients présentés ici, à savoir l’acceptation d’un rein HLA identique sans immunosuppression à long terme, sans rejet aigu de l’allogreffe et sans réaction du greffon contre l’hôte. La tolérance vis-à-vis du greffon a en outre été démontrée chez l’un des patients par une analyse de l’expression génétique lors de la biopsie, où le profil d’expression génétique ne pouvait pas être distingué de celui d’un rein sain normal.6
Les avantages d’une acceptation de l’allogreffe sans la nécessité d’immunosuppression devraient acquérir une importance particulière, surtout à long terme. Plusieurs observations indiquent toutefois que nos patients en ont déjà tiré profit. Le nombre de complications liées à une infection était faible et aucun des patients n’a présenté de troubles métaboliques, tels qu’un diabète, après la transplantation.
Contrairement à l’immunosuppression générale, l’induction d’une tolérance devient encore plus intéressante dans le contexte de la pandémie actuelle de Covid-19. Les trois patients ont été transplantés avant que la pandémie n’atteigne l’Europe. Aucun d’entre eux n’a contracté le Covid-19. Les patients ont pu être vaccinés avec le vaccin à ARNm BNT162b2 alors qu’ils n’étaient plus immunodéprimés; ils ont présenté de fortes réponses anticorps neutralisantes protectrices spécifiques au SARS-CoV-2 et, pour deux sur trois d’entre eux, des réponses spécifiques des lymphocytes T. Le nombre de patients n’est pas suffisant pour réaliser une analyse définitive, mais les données indiquent une meilleure réponse immunologique au vaccin par rapport aux receveurs de transplantations rénales sous traitement immunosuppresseur.7–9 Cette situation épidémiologique exceptionnelle nous a donné la possibilité d’étudier la réponse immunitaire à un nouveau virus en situation clinique. En fin de compte, ces résultats ont été déterminants pour démontrer la spécificité, la tolérance immunologique obtenue avec ce protocole, permettant l’acceptation d’un rein transplanté tout en maintenant une réponse anti-vaccinale totalement protectrice.
En résumé, on peut dire que l’application du protocole conçu par les collègues de Stanford nous a permis, à nous aussi, d’obtenir une tolérance immunitaire spécifique au donneur chez certains patients en induisant un chimérisme hématopoïétique mixte. Les trois premiers patients inclus dans notre programme de tolérance ont réussi à se dispenser de tout traitement immunosuppresseur, la fonction du greffon restant stable et aucun signe de rejet ou de GvHD n’étant apparu. L’immunocompétence a été démontrée par des réponses immunitaires au vaccin protectrices contre le SARS-CoV-2 chez les trois patients. Le plus grand défi à relever à l’avenir sera de poursuivre la conception de ce protocole au-delà des limites HLA.
Littérature:
1 Cosimi AB et al.: The importance of bringing transplantation tolerance to the clinic. Transplantation 2021; 105: 935-40 2 Kawai T et al.: HLA-mismatched renal transplantation without maintenance immunosuppression. N Engl J Med 2008; 358: 353-61 3 Scandling JD et al.: Tolerance and chimerism after renal and hematopoietic-cell transplantation. N Engl J Med 2008; 358: 362-8 4 Leventhal J et al.: Chimerism and tolerance without GVHD or engraftment syndrome in HLA-mismatched combined kidney and hematopoietic stem cell transplantation. Sci Transl Med 2012; 4: 124ra28 5 Fehr T, Hübel K et al.: Successful induction of specific immunological tolerance by combined kidney and hematopoietic stem cell transplantation in HLA-identical siblings. Front Immunol 2022. doi: 10.3389/fimmu.2022.796456 6 Halloran PF et al.: Real time central assessment of kidney transplant indication biopsies by microarrays: the INTERCOMEX Study. Am J Transplant 2017; 17: 2851-62 7 Boyarsky BJ et al.: Antibody response to 2-dose SARS-CoV-2 mRNA vaccine series in solid organ transplant recipients. JAMA 2021; 325: 2204-6 8 Kamar N et al.: Three doses of an mRNA Covid-19 vaccine in solid-organ transplant recipients. N Engl J Med 2021; 385: 661-2 9 Crespo M et al.: Negative immune responses to two-dose mRNA COVID-19 vaccines in renal allograft recipients assessed with simple antibody and interferon gamma release assay cellular monitoring. Am J Transplant 2021. doi: 10.1111/ajt.16854
Das könnte Sie auch interessieren:
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...