De nombreuses études montrent des progrès avec une prolongation de la survie globale
Compte-rendu:
Dre rer. nat. Ine Schmale
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La prolongation de la survie est l’objectif thérapeutique le plus important pour la plupart des patient·es atteint·es de cancer. Diverses études ont montré que des médicaments expérimentaux permettaient de répondre à ce souhait des patient·es. Lors du symposium ASCO Genitourinary Cancers (ASCO GU), des évaluations finales, des mises à jour d’études et des résultats de nouvelles études sur des cancers urologiques ont été présentés, dont une sélection figure ici.
Cancer de la prostate
Ajout de la radiothérapie en cas de maladie oligométastatique
L’étude de phaseII randomisée GROUQ-PCS 9 a évalué un traitement ciblant les métastases en plus du traitement de référence par suppression androgénique (ADT) plus enzalutamide comme nouvelle option de traitement de première intention chez les patient·es atteint·es de mCRPC avec une à cinq métastases.1 Au total, 100 patient·es ont reçu soit l’association enzalutamide plus ADT, soit l’association plus radiothérapie stéréotaxique (SBRT). Le critère d’évaluation primaire de l’étude était la survie sans progression radiologique (rPFS). L’âge médian des patient·es était de 72 ans et il·elles présentaient essentiellement des métastases osseuses (75,0 et 61,5%, respectivement) ou des métastases ganglionnaires (21 et 32,5%, respectivement).
L’ajout de la radiothérapie a permis de réduire le risque de progression radiologique de 52% (HR: 0,48; IC à 95%: 0,27–0,86; p=0,014). La rPFS médiane était de 2,3 ans sous enzalutamide plus ADT par rapport à 4,6 ans en cas d’ajout de la SBRT. Une progression du PSA a été observée après un délai médian de 3,1 par rapport à 4,6 ans (HR: 0,58; IC à 95%: 0,32–1,03; p=0,065) et le délai médian jusqu’au premier traitement ultérieur était de 2,9 par rapport à 5,1 ans (HR: 0,42; IC à 95%: 0,22–0,80; p=0,009). La survie globale (OS) médiane n’était pas encore atteinte dans les deux bras de l’étude. Un avantage numérique a été observé avec une réduction du risque de décès de 29% grâce à la SBRT ciblant les métastases (HR: 0,71; IC à 95%: 0,31–1,59; p=0,407). Le profil de sécurité de la SBRT plus enzalutamide et de l’ADT était comparable à celui de l’hormonothérapie seule.
Carcinome urothélial
Nivolumab en traitement adjuvant dans le cancer de la vessie
Pour le traitement adjuvant du carcinome urothélial infiltrant le muscle (MIUC) à haut risque après chirurgie radicale, l’étude de phaseIII randomisée, en double aveugle CheckMate 274 a évalué le nivolumab par rapport à un placebo.2 Ont été randomisé·es 709 patient·es présentant des tumeurs de stade ypT2–ypT4a ou ypN+ et ayant reçu une chimiothérapie néoadjuvante antérieure, ainsi que des tumeurs de stade pT3–pT4a ou pN+ et n’ayant reçu aucune chimiothérapie néoadjuvante antérieure. Le critère d’évaluation primaire de l’étude était la survie sans maladie (DFS) au sein de la population ITT ainsi que la DFS chez les patient·es dont l’expression de PD-L1 était ≥1%.
Chez 79% des patient·es, la tumeur primitive était un carcinome de la vessie infiltrant le muscle (MIBC). Seule cette cohorte de patient·es a été évaluée dans le cadre d’une analyse exploratoire du MIBC. Avec une durée médiane de suivi de 36,1 mois pour la population ITT et de 34,5 mois pour la population MIBC, le nivolumab a plus que triplé la survie médiane, qui est passée de 8,5 à 25,6 mois. Le risque de progression de la maladie a été réduit de 37% par rapport au placebo avec l’administration adjuvante de nivolumab (HR: 0,63; IC à 95%: 0,51–0,78). En cas de chimiothérapie néoadjuvante antérieure, la DFS médiane chez les patient·es atteint·es de MIBC était de 19,6 par rapport à 8,3 mois (HR: 0,58; IC à 95%: 0,43–0,79). Si les personnes concernées n’avaient reçu aucune chimiothérapie néoadjuvante antérieure, la DFS médiane était de 25,9 par rapport à 13,7 mois (HR: 0,69; IC à 95%: 0,50–0,94). Pour l’OS, une réduction de 30% du risque de décès a été calculée dans la population MIBC (HR: 0,70; IC à 95%: 0,55–0,90). 75,3% des patient·es sous nivolumab par rapport à 66,2% sous placebo étaient en vie à 24 mois et 64,2 par rapport à 53,7% l’étaient à 36 mois. Lorsque les patient·es atteint·es de MIBC présentaient un statut PD-L1 positif (≥1%), la proportion de patient·es ayant une OS d’au moins deux ans augmentait à 82,6 par rapport à 67,4% et d’au moins trois ans à 71,8 par rapport à 52,0% (HR: 0,48; IC à 95%: 0,29–0,77).
Enfortumab vedotin plus pembrolizumab en traitement de première intention
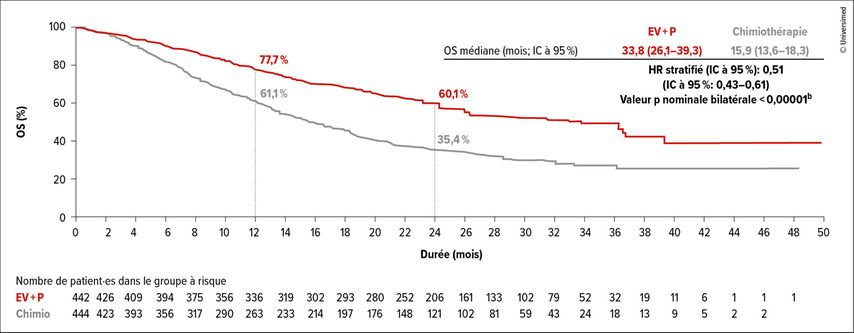
Après une année supplémentaire de suivi, les données actualisées de l’étude de phaseIII EV-302/KEYNOTE-A39 ont également été présentées à l’ASCO GU.3 La comparaison randomisée d’enfortumab vedotin plus pembrolizumab par rapport à la chimiothérapie chez les patient·es naïf·ves de traitement atteint·es de carcinome urothélial localement avancé ou métastatique avait mis en évidence un doublement de la PFS médiane de 6,3 à 12,5 mois et de l’OS médiane de 16,1 à 31,5 mois.
Après une durée de suivi de 2,5 ans, la PFS (HR: 0,48; IC à 95%: 0,41–0,57) et l’OS (HR: 0,51; IC à 95%: 0,43–0,61) sont restées systématiquement plus avantageuses sous traitement combiné sans chimiothérapie (Fig. 1). Les taux à 2 ans de PFS étaient de 37,1 par rapport à 12,6% et d’OS de 60,1 par rapport à 35,4%. Les analyses de sous-groupes ont montré un avantage en termes de PFS et d’OS pour tous les groupes de patient·es pré-spécifiés. Une réponse a été observée chez 67,5 par rapport à 44,2% (p<0,00001), avec des rémissions complètes chez 30,4 par rapport à 14,5% des patient·es. La durée de la réponse était de 23,3 par rapport à 7,0 mois. À 24 mois, 49,4 par rapport à 24,0% des patient·es ayant obtenu une réponse étaient en rémission durable. 74,3 par rapport à 43,2% des patient·es ayant obtenu une réponse complète étaient toujours en rémission à 24 mois.
Fig.1: Survie globale (OS) sous enfortumab vedotin (EV) plus pembrolizumab (P) par rapport à la chimiothérapie (modifiée selon Powles T et al.)3
Carcinome à cellules rénales
PFS prolongée sous ITK et double inhibition des points de contrôle immunitaires
Dans l’étude COSMIC-313, les patient·es atteint·es de CCR ont reçu le cabozantinib en association avec le nivolumab et l’ipilimumab. Les résultats finaux de l’étude de phaseIII randomisée, contrôlée par placebo ont été présentés à l’ASCO GU.4 Au total, 855 patient·es ont été randomisé·es et, avec une durée de suivi médiane de 45,0 mois, 734 d’entre eux·elles ont terminé le traitement à l’étude. Les patient·es étaient âgé·es en moyenne de 60 à 61 ans et présentaient un risque de progression modéré dans 75% des cas et élevé dans 25% des cas selon l’IMDC.
Avec une durée de suivi plus longue, un avantage en termes de PFS a été confirmé par l’ajout du cabozantinib au nivolumab plus ipilimumab. La médiane était de 16,6 par rapport à 11,2 mois et le taux de PFS à 24 mois de 44 par rapport à 37%. La différence entre les courbes était statistiquement significative (HR: 0,82; IC à 95%: 0,69–0,98). Les analyses de sous-groupes ont confirmé l’avantage en termes de PFS sous cabozantinib, en particulier en cas de risque de progression modéré (HR: 0,76; IC à 95%: 0,62–0,93). Les patient·es présentant un risque de progression de la maladie élevé n’ont pas bénéficié de l’ajout du cabozantinib (HR: 1,04; IC à 95%: 0,73–1,48).
Avec un hazard ratio de 1,02 (IC à 95%: 0,85–1,23; p=0,84), les courbes de Kaplan-Meier relatives à l’OS étaient comparables pour les deux bras de l’étude. La durée de vie médiane des patient·es était de 41,9 par rapport à 42,0 mois. Les analyses de sous-groupes n’ont pas identifié de groupe présentant un bénéfice accru, à l’exception des patient·es sans métastases viscérales (HR: 0,53; IC à 95%: 0,29–0,97). Dans les deux bras de traitement, environ la moitié des personnes concernées ont reçu au moins une autre ligne de traitement. Le délai jusqu’au premier traitement systémique ultérieur était de 14,5 mois avec cabozantinib par rapport à 9,7 mois sans cabozantinib. Les effets secondaires liés au traitement étaient plus fréquents dans le bras de traitement et ont entraîné l’arrêt d’au moins une des substances actives chez 49 par rapport à 26% des patient·es.
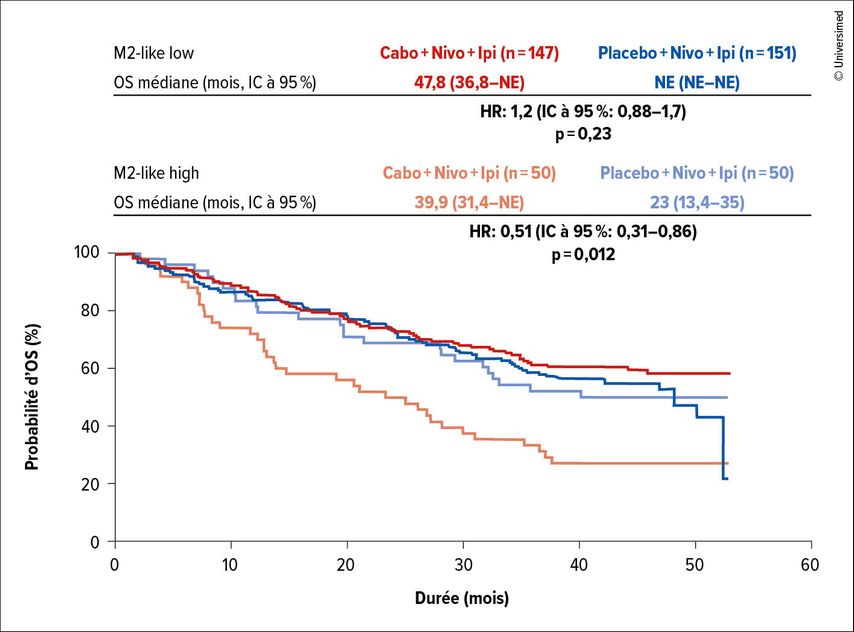
Les analyses exploratoires des biomarqueurs des séquences d’ARN n’ont montré aucun lien clair entre les groupes moléculaires et le succès thérapeutique. Un effet du cabozantinib sur différents types de cellules immunitaires a également été étudié et a montré que les macrophages M2-like supprimaient la réponse immunitaire. Les patient·es présentant un risque de progression plus élevé et des métastases viscérales avaient des taux plus élevés de macrophages M2-like. L’ajout du cabozantinib à la double immunothérapie a permis d’inverser le pronostic défavorable dû à l’immunosuppression médiée par les macrophages M2-like (Fig. 2).
Fig.2: Survie globale (OS) sous nivolumab (Nivo) plus ipilimumab (Ipi) avec ou sans cabozantinib (Cabo) en cas d’expression faible (low) ou élevée (high) des macrophages M2-like (modifiée selon Albiges L et al.)4
Bons résultats d’efficacité sous lenvatinib plus belzutifan
Après un traitement par un inhibiteur de PD1/PD-L1 et un inhibiteur de tyrosine kinase (ITK) anti-VEGF, les données relatives aux options de traitement combiné ne sont pas claires. L’étude de phaseI/II ouverte KEYMAKER-U03 a donc évalué des traitements combinés chez des patient·es ayant reçu un traitement antérieur dans le cadre d’un essai «umbrella». Les résultats des associations pembrolizumab plus belzutifan (n=62), lenvatinib plus belzutifan (n=64) et pembrolizumab plus lenvatinib (n=73) ont été présentés lors de l’ASCO GU.5 Le critère d’évaluation primaire pour les différents bras de l’étude était le taux de réponse (ORR); aucune comparaison formelle n’était prévue entre les bras de l’étude. Les durées médianes de suivi pour les bras de l’étude étaient respectivement de 16,6, 17,6 et 19,4 mois.
L’âge médian des patient·es était compris entre 60 et 63 ans. Un bon tiers (36–37%) avait reçu un inhibiteur de CTLA-4 en première ligne. 36 à 37% des patient·es avaient reçu deux lignes de traitement et 42 à 57% ≥3 lignes de traitement.
Le pronostic selon le score de risque IMDC était favorable pour 21 à 23% des personnes concernées, modéré pour 60 à 69% et défavorable pour 11 à 17%. Au final, l’association lenvatinib plus belzutifan a permis d’obtenir l’ORR le plus élevé (46,9%) et l’association pembrolizumab plus belzutifan l’ORR le plus faible (19,4%). 39,7% des patient·es ont répondu à l’association pembrolizumab plus lenvatinib. La durée médiane de la réponse n’était pas encore atteinte sous pembrolizumab plus belzutifan et était de 22,1 mois sous lenvatinib plus belzutifan ainsi que de 8,3 mois sous pembrolizumab plus lenvatinib.
À six mois, 41,8% des patient·es du bras sous pembrolizumab plus belzutifan, 63,1% du bras sous lenvatinib plus belzutifan et 66,7% du bras sous pembrolizumab plus lenvatinib étaient en vie sans progression. À 12 mois, le taux de PFS pour les trois bras de l’étude était de 28,6, 51,8 et 34,5%. La médiane était respectivement de 5,4, 12,5 et 9,4 mois. Des taux d’OS de 67,9, 79,5 et 81,7% à 12 mois ainsi que de 57,6, 74,4 et 73,2% à 18 mois ont été observés. La médiane s’élevait à 27,4 et 32,3 mois pour les associations à base de belzutifan et n’était pas encore atteinte pour l’association pembrolizumab plus lenvatinib.
Des effets secondaires liés au traitement de grade3 à 5 ont été le plus fréquemment rapportés sous lenvatinib plus belzutifan (60,3%). La fréquence était de 49,3% sous pembrolizumab plus lenvatinib et de 41,9% sous pembrolizumab plus belzutifan. L’association lenvatinib plus belzutifan est désormais comparée au cabozantinib dans l’étude de phaseIII randomiséeLITE-SPARK-011.
Source:
Symposium ASCO Genitourinary Cancers (ASCO GU), 14–16 février 2025, San Francisco
Littérature:
1 Niazi T et al.: ASCO GU 2025; Abstr. #22 2 Milowsky MI et al.: ASCO GU 2025; Abstr. #658 3 Powles T et al.: ASCO GU 2025; Abstr. #664 4 Albiges L et al.: ASCO GU 2025; Abstr. #438 5 Beckermann KE et al.: ASCO GU 2025; Abstr. #440
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...